Химияның теориялық негіздері: стехиометриялық заңдар, бейорганикалық қосылыстар номенклатурасы және атом құрылысы


Дәріс №1
Химияның теориялық негіздері. Химияның негізгі стехиометриялық заңдары.Дәрістің мақсаты : атом-молекулалық ілімнің негізгі қағидаларымен танысу. Атом, молекула, моль, мольдік масса, эквивалент, эквивалент заңымен есеп шығара білу.
1. АМІ - нің негізгі қағидалары.
2. Химияның негізгі ұғымдары.
3. Химияның негізгі стехиометриялық заңдары.
Негізгі химиялық түсініктер мен заңдар:
Химиялық элемент. Ядро зарядтары бірдей атом түрлері.
Атом - химиялық реакция негізінде бөлінбейтін элементтің қасиетін сақтайтын кіші бөлігі.
Молекула - заттың химиялық қасиетін сақтайтын кіші бөлігі
Жай зат - бір түрлі элемент атомдарынан тұратын зат.
Күрделі зат әр түрлі элемент атомдарының құралған зат.
Массасының атомдық бірлігі (м. а. б) көміртегі - 12(
12
С) изотопы атом массасының
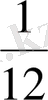 бөлігі, яғни 1, *10
-27
кг. Элементтің салыстырмалы атомдық массасы (Аr) өлшеусіз бірлік, табиғи элементтің изотоптық құрамының орта массасының
6
С
12
изотопы массасының
бөлігі, яғни 1, *10
-27
кг. Элементтің салыстырмалы атомдық массасы (Аr) өлшеусіз бірлік, табиғи элементтің изотоптық құрамының орта массасының
6
С
12
изотопы массасының
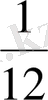 бөлігіне қатынасына тең шама.
бөлігіне қатынасына тең шама.
А
r
=
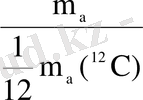 ; мұндағы (r - латынның relotivins - салыстырмалы деген сөзінен шыққан) .
; мұндағы (r - латынның relotivins - салыстырмалы деген сөзінен шыққан) .
Шартты бөлшек - шынайы, нақты кездесетін бөлшектердің кез - келген түрі (атомдар, молекулалар, иондар, электрондар, атомдық топтар т. б. ) және шартты түрде кездесетін
 Ba
2+
,
Ba
2+
,
 H
3
PO
4
тәрізді бөлшек үлестері. Моль -
6
С
12
изотопының массасы 0, 012 кг қанша бөлшек болса, сонша бөлшек болатын зат мөлшері. (яғни 6, 02*10
23
) Бұл сан бөлшектер молін емес олардың санын көрсетеді.
H
3
PO
4
тәрізді бөлшек үлестері. Моль -
6
С
12
изотопының массасы 0, 012 кг қанша бөлшек болса, сонша бөлшек болатын зат мөлшері. (яғни 6, 02*10
23
) Бұл сан бөлшектер молін емес олардың санын көрсетеді.
Сондықтан «сутек атомдарының молі» дегеннен гөрі «атомды сутек молі» деген ұғым дұрысырақ. Моль санын ν (ню) деп белгілеу қабылданған. Кей оқулықтарда - «n» деп белгілейді: ν (Н) = 1 моль, ν(Н 2 О) =1 моль.
Авогадро тұрақтысы (N A ) кез - келген жүйенің бөлшектер санының (N) жүйе заттары мөлшеріне (ν) немесе (n ) қатынасына тең. N (ν) =N A (N/n=N A ) . N A моль -1 =6, 02*10 23 моль -1 . Осыдан кейін былай деп тұжырымдаймыз.
Бірдей жағдайда (Т, р) әр түрлі газдардың бірдей молекуласы бірдей көлем алады.
Газдың мольдік көлемі (V m ) 22, 4 л/моль, газдың кез - келген көлемі V=n*V m болғандықтан зат мөлшері 1 моль (қ. ж. ) газ көлемі 1 моль*22, 4л/моль=22, 4л.
Заттың мольдік массасы.
М(х) зат массасының (m) зат мөлшеріне (ν) қатынасымен анықталатын шама. М(х) =
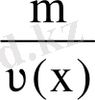 немесе М(х) =
немесе М(х) =
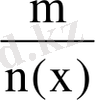 ;
;
Мольдік масса бірлігі кг*моль -1 немесе г*моль -1 . Мольдік масса сан жағынан салыстырмалы молекулалық массаға тең. Мысалы,
Ar (Na) =23 Mr (H 2 SO 4 ) =98
M(Na) =23г/моль M(H 2 SO 4 ) =98г/моль.
Мольдік көлем V m - зат көлемінің осы көлемдегі зат мөлшеріне қатынасымен анықталатын шама.
V
m
=
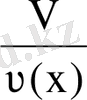 ;
;
Бірлігі - м 3 /моль немесе л/моль. ν(х) =1 моль, V m =22, 4 литр, немесе 22, 34*10 -3 м -3 .
Абсолюттік атом массасы (кг, г) - элементінің мольдік массасының Авогадро тұрақтысына қатысы. Мысалы,
m(O) =

m(O) =
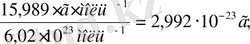
Абсолюттік массасының мәні сол сияқты массаның атомдық бірлігі мен салыстырмалы атомдық масса көбейтіндісіне де тең. Мысалы, m(O) =15, 999∙1, 6605∙10 -23 кг; (орын ауыстыру)
Абсолюттік молекула массасы (кг, г) берілген зат салыстырмалы массасының Авогадро тұрақтысына қатынасы көрсетіледі.
m(H
2
O) =
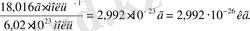
m(H
2
O) =
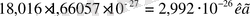 .
.
Стехиометрия - заттардың құрамына кіретін элементтердің немесе химиялық реакцияларға түсетін заттардың сандық арақатынастарын зерттейтін химия саласы. Стехиометриялық заңдарға масса сақталу заңы, құрам тұрақтылық заңы, еселі қатынастар заңы, эквиваленттер заңы, көлемдік қатынастар заңы, Авогадро заңы жатады.
Жалпы материяның сақталу заңын 1748 ж. М. В. Ломоносов тұжырымдаған: « . . . Бір денеден қанша кемісе, екіншісіне соншама қосылады; бір жерден бірнеше материя азайса, басқа жерде соншаға артады . . . ». Химиялық реакцияларға қатысты бұл заң былай оқылады: «Химиялық реакцияға түсетін заттардың массасы әрқашан оның нәтижесінде түзілетін заттар массасына тең болады». Химиялық реакция кезінде бастапқы заттар құрамына кірген элемент атомдары ешқайда жойылып кетпейді, алынған қажетті мөлшерінде жаңа заттардың құрамына кіреді, сондықтан жалпы масса өзгермейді. Мысалы:
СuO + H 2 SO 4 → CuSO 4 + H 2 O
1 моль 1 моль 1 моль 1 моль
80 г + 98 г = 160 г + 18 г
Құрам тұрақтылық заңын 1801 ж. француз ғалымы Ж. Л. Пруст тұжырымдады:
«Кез келген химиялық таза заттың құрамы оның алыну жолдарына тәуелсіз тұрақты болады».
Бұл заң молекулалық құрылысты заттар үшін дұрыс болады, себебі молекула - тұрақты бөлшек, оның құрамы өзгермейді. Мысалы, СО
2
құрамында әрқашан, оны қандай жолмен алса да, үнемі 27, 27 % көміртегі және 72, 73 % оттегі болады. Бертолленің пікірінше, заттардың құрамы алыну жағдайларына сәйкес ауыспалы болады. Қазіргі кезде біз білеміз: бұл - молекулалық емес құрылысты заттар. Олардың құрамы кристалдың түзілу жағдайларына байланысты өзгеруі мүмкін, себебі кристалдық затта әр бөлшектің өз орны болады. Егер кристалдың қалыптасу барысында қандай да бір кемшіліктер кетсе, жалпы кристалдағы әртүрлі элемент атомдары санының арақатынасы бұзылады, яғни заттың формуласына сәйкес келмеуі мүмкін. Мысалы, ТiO
2
құрамы мына аралықта өзгеруі мүмкін: ТiO
1, 9-2, 0
. Сонымен, молекуласы бар заттардың құрамы үнемі тұрақты болады, оларды
дальтонидтер
деп атайды. Ал алыну жағдайларына байланысты құрамы өзгеріп отыратын молекулалық құрылысы жоқ заттар
бертоллидтер
деп аталды.
Қазіргі кезде эквивалент ұғымына келесідей түсінік беріледі.
Эквивалент - бұл бөлшек.
Эквивалент деген сонда қандай бөлшек?
Эквивалент - бұл химиялық реакцияларда сутегінің бір атомына (ионына) сәйкес келетін , яғни сонымен қосылысатын, оның орнын басатын немесе өзінен оны бөліп шығаратын заттың нақты немесе шартты бөлшегі.
Ал тотығу-тотықсыздану реакцияларында эквивалент бөлшегі бір электронға сәйкес келеді.
Дәріс №2
Бейорганикалық қосылыстардың негізгі кластары. Химиялық реакция түрлері.
Дәрістің мақсаты: студенттердің бейорганикалық қосылыстардың кластары жөніндегі білімдерін жүйелеп, қорытындылау, өз бетімен жұмыс істей отырып, білімдерін тереңдету.
1. Негізгі бейорганикалық қосылыстар.
2. Химиялық реакциялар.
Бейорганикалық қосылыстардың номенклатурасы олардың құрамы мен байланыс типіне қарай аталады. Бинарлы гетероатомды қосылыстар орыс тілінде бинарлы ковалентті немесе электрооң бөлігі ионды қосылыстарда бірінші болып электротеріс бөлігі соңынан электрооң бөлігі аталады, және элементтің латынша атына - ид жұрнағы қосылып, тәуелдік жалғау жалғанады.
PbS - қорғасын сульфиді
CaS - кальций карбиді
CO - көміртегінің (ІІ) оксиді.
Оттекті қосылыстар. Оттекті қосылыстардың халықаралық атауы оксидтер. Оттегі барлық элемент атомдарымен қосылыс түзеді және электротерістік бөлігін құрайды.
О - О - атом тобы бар пероксидтер кездеседі. Na 2 O 2 - натрий пероксиді. Сонымен қатар супероксидтер болады, мысалы КО 2 калий супероксиді.
4. 1 Галогенді қосылыстар
Халықаралық номенклатура бойынша галогендерді галидтер деп атайды. Мысалы NaJ - натрий галиді, КВr - калий галиді. Сонымен қатар галидтердің жеке аттары бар.
AgCl - күміс хлориді;
KJ - калий иодиді;
NaBr - натрий бромиді.
Егер галидтің құрамына айнымалы валенттілік көрсететін элемент кірсе, онда атауының алдына префикс (грек сандары) қойылады.
Кесте 3
4. 2 Басқа бейметалл қосылыстары
Д. И. Менделеевтің периодтық жүйесінің VІ тобының негізгі топша элементтерімен (электротеріс бөлшек) қосылыстар - сульфидтер, селенидтер, теллуридтер деп аталады немесе оларды жалпы түрде халькогенидтер деп атайды.
V топтың негізгі топшасы элементтері мен қосылыстар пниктогенидтер деп жалпы атпен аталса, азот қосылыстары нитрид, фосфор қосылыстары фосфид, мышьяк қосылыстары арсид (арсенид), сурьма қосылыстары стибид (антимонид) деп аталады.
IV топтың негізгі топшасы элементтердің қосылыстары: көміртегі - карбид, кремний - силицид (силид) деп аталады. Бор қосылыстары борид деп аталады.
Кесте 4
4. 3 Бейметаллдардың сутегімен қосылыстары
Егер бейметалдардың сутекті қосылыстарының судағы ерітіндісі қышқыл болса, оларды атағанда бейметалл атына сутек деген сөз қосып атайды:
HCl - хлорсутек; НBr - бром сутек;
HJ - иод сутек; Н 2 S - күкірт сутек;
H 2 Te - теллур сутек.
Бұлардан басқа бейметаллдардың сутекті қосылыстары дәстүрлі атаулармен аталады.
Н 2 О - су; СН 4 - метан;
NH 3 - аммиак; SiH 4 - силан;
РН 3 - фосфин; В 2 Н 6 - диборан;
С 2 Н 6 - этан; Si 2 H 8 - дисилан;
AsH 3 - арсин;
Металдардың сутекті қосылыстары гидрид деп аталады. Себебі сутегі бұндай қосылыстарда электротеріс.
LiH - литий гидриді;
СаН 2 - кальций гидриді.
4. 4 Үш және одан да көп элементтерден тұратын қосылыстар
Оксоқышқылдарды дәстүрлі немесе жартылай жүйелік атауды ең алғаш Лавуазье ұсынған.
Оттекті қышқылдар (оксоқышқылдар)
Қышқылдардың аталуы қышқыл түзуші элементтің қандай тотығу дәрежесінде болуына байланысты жұрнақ қосылады:
Ең төменгі тотығу дәрежесінде болса, -лылау жұрнағы, орта тотығу дәрежесінде -лы, -ты, -ті, жоғарғы тотығу дәрежесінде жұрнақсыз қышқыл деген сөз қосылып айтылады. Егер қышқыл түзуші элемент бір тотығу дәрежесінде бірнеше (байланысқан су молекуласы саны әр түрлі) қосылыс түзсе, онда қышқыл деген сөзге перфикстер жалғанады:
Мета - байланысқан су молекуласы аз болса;
Мезо - байланысқан су молекуласы орташа болса;
Орто - байланысқан су молекуласының саны максимальды болғанда.
Көпшілік элементтер үшін тотығу дәрежесі екіден көп болуына байланысты «гипо», «пер» деген қосымшалар қолданылады. Мұндай жүйенің қолайсыздығы қанша оттегі атомы болатынын, сутегі атомы оттегі атомымен байланыса ма, жоқ па көрсете алмайды.
Кесте 5
H 2 MnO 4
НСlO 4
HClO 3
HClO 2
HClO
Марганецті қышқыл
Хлор қышқылы
(хлорная кислота)
Хлорлы қышқыл
(хлороватая кислота)
Хлорлау қышқылы
(хлористая кислота)
Хлорлылау қышқылы
(хлорноватистая кислота)
Сутек тетраоксоманганат (VI)
Дисутек тетраоксоманганат
Сутек тетраоксохлораты (VII)
Сутек триоксохлораты (V)
Сутек диоксохлораты (ІІІ)
Сутек монооксохлораты (І)
Кесте 6
Хлор
қышқылы
Мезоид
қышқылы
Азот
қышқылы
Маргенцті
қышқыл
Азотты
қышқыл
Марганец
қышқылы
Күкірт
қышқылы
Күкіртті
қышқыл
Селен
қышқылы
Көмір
қышқылы
Қазіргі кезде дәстүрлі атау тек кейбір өте жиі қолданылатын қышқылдар үшін ғана сақталған:
H 2 SO 4 - күкірт қышқылы;
H 2 SO 3 - күкіртті қышқыл;
H 3 PO 4 - фосфор қышқылы;
H 2 CO 3 - көмір қышқылы.
Негізінен қышқылдарды атауда жүйені қолдану тиімді. Мұндай атау екі сөзден тұрады. Алдымен сутек деген сөз аталып, оған керегіне байланысты «ди», «три» және т. б. сандық қосымшалар қосылып, ал екінші болып координациялық номенклатура бойынша құрылған анион аты беріледі. Ол төрт бөліктен құралады. Бірінші барлық орталық атоммен байланысқан радикалдар аты, оған орталық атомның латынша атын - ат жұрнағы жалғанып беріледі. Егер бірнеше лиганда болса, олар алфавиттік ретпен аталады.
Бір-бірінен қышқыл түзуші элемент санымен айырылатын қышқылдар полиқышқылдар деп аталады.
H 2 S 2 O 7 - қос күкірт қышқылы;
H 4 P 2 O 7 - пирафосфор (қосфосфор) қышқылы;
H 2 B 4 O 7 - төрт бор қышқылы.
НЕГІЗДЕР. ОН - тобын халықаралық номенклатура бойынша гидроксид деп атайды. NaОН - натрий гидроксиді, Са(ОН) 2 - кальций гидроксиді.
Егер металл бірнеше гидроксид түзсе, онда гидроксид деген сөздің алдында грек сандары аталады немесе металл атынан соң цифрімен валенттілігі қойылады.
Fe(OH) 2 - темірдің дигидроксиді. Темір (ІІ) гидроксиді.
Fe(OH) 3 - темірдің тригидроксиді. Темір (ІІІ) гидроксиді.
Амфотерлі гидроксидтер егер оларды негіздермен әрекеттеседі деп қарастырсақ қышқыл ретінде, ал қышқылдармен әрекеттеседі десек негіз ретінде санауымызға болады.
Ті(ОН) 4 - титан (ІV) гидроксиді.
Н 4 ТіО 4 - ортатитан қышқылы.
ТҰЗДАР. Тұздарды катиондар мен аниондар түзілген қосылыс ретінде қарастырамыз.
Оттекті қышқыл аниондарының аты қышқылды түзуші элементтің латынша атына төменгі тотығу дәрежесінде -ит, жоғарғы тотығу дәрежесінде -ат жұрнағы қосылып айтылады: SO 4 2- -сульфат ион, SO 3 2- сульфит ион, NO 3 - -нитрат ион, NO 2 - - нитрит ион.
Егер қышқыл түзуші элементтің айнымалы валенттік күйі екіден көп болса, онда - лау, -лы жұрнақты қышқылдарының бәрінің + ионына -ат жұрнағы жалғанады:
Ең жоғарғы валенттілік көрсететін элементі бар анион атына «пер» - префиксі қосылады: ClO
 - хлорат - ион, ClO
- хлорат - ион, ClO
 - перхлорат ион, MnO
- перхлорат ион, MnO
 - перманганат ион.
- перманганат ион.
Егер қышқыл анионына -лылау жұрнағы сәйкес келсе, онда гипопрефиксі жалғанады: ClO 2 - - хлорит ион, ClO - - гипохлорит ион.
Мета -, мезо -, орто-қышқылдар префиксі аниондарда да сақталады.
PO 3 3- - метафосфат ионы;
PO 4 3- - ортофосфат ион.
Бір атомды катиондар аты элемент атына ион сөзі қосылып, егер айнымалы валентті болса, валенттілігі рим цифрмен жақша ішінде көрсетіледі.
Сu + - мыс (І) ионы;
Cu 2+ - мыс (ІІ) ионы.
Егер күрделі немесе комплексті катион болса, онда атом топтары немесе катион құрамына кіретін нейтрал молекуланың табиғатын көрсететін қосымша жалғанады.
MgOH + - гидроксомагний ионы;
Al(OH) 2 +1 - дигидроксоалюминий ионы;
FeOH + - гидроксотемір (І) ионы;
FeOH 2+ - гидроксотемір (ІІІ) ионы;
Дегидратталған (сусыз) катиондарды «гидроксо» қосымшасы орнына «оксо» қосымшасын айтамыз.
BiO + - оксовисмут (ІІІ) - ионы;
VO + - оксованадий (ІІІ) - ионы;
VO 2 + - диоксованадий ионы;
VO 2+ - оксованадий (IV) ионы;
Комплексті NH 4 + катионы аммоний, ал AsH 4 + арсоний, SbH 4 + - стибоний, ОН 3 + - гидроксоний, РН 4 + - фосфоний деп аталады. Басқа барлық комплексті катиондардың аталуын лиганданың латынша аталуы мен комплекс түзуші элемент атына дефис арқылы ионы сөзі қосылып айтылады. Мысалы: [Zn(NH 3 ) 4 ] 2+ - тетраамин мырыш ионы.
Бір атомды анион атауы элементтің латынша атына - ид жұрнағы жалғанып, дефис арқылы ионы деген сөз қосылып айтылады.
Ғ - - фторид - ионы; S 2- - сульфид - ионы;
Сl - - хлорид - ионы; CN - - цианид - ионы;
О 2- - оксид - ионы; О 2 2- - пероксид - ионы.
Егер анион құрамына сутегі атомы енсе, гидро-префиксі ион атауының алдына қойылады.
ОН - - гидрооксид - ион;
НО 2 - - гидропероксид-ион;
HS - - гидросульфид-ион.
Қышқыл тұздар анионы атына егер сутегі біреу болса, онда гидро- қосымшасы жалғанады, ал сутегі саны бірден артық болғанда сәйкес грек сандары қосылып айтылады:
HPO 4 2- - гидроортофосфат-ион;
Н 2 РО 4 - - дигидроортофосфат-ион.
Кейбір оттекті катиондар үшін жартылай жүйелік атау сақталған, ол -ил жұрнағымен аяқталады. Мысалы, UO 2 2+ - уранил, VO 2+ -ванадил, SbO + -стибил не антимонил, ВіО + -висмутил.
Оттекті қышқылдар аниондарының аталуы
Кесте 7
Анион
формуласы
Анион
формуласы
NO
NO 3 -
BO 2 -
ВО 3 3-
B 4 O 7 2-
JO -
Нитрит-ион
Нитрат-ион
Метаборот-ион
Ортоборот-ион
Тетраборот-ион
Иодот-ион
SO 3 2-
HSO 3 -
SO 4 2-
HSO 4 -
CO 3 2-
HCO 3 -
Сульфит-ион
Гидросульфит-ион
Сульфат-ион
Гидросульфат-ион
Карбонат-ион
Гидрокарбонат-ион
SiO 3 2-
SiO 4 4-
MnO 4 2-
MnO 4 -
AsO 4 3-
AsO 2 4-
Метасиликат-ион
Ортосиликат-ион
Манганат-ион
Перманганат-ион
Ортоарсенат-ион
Метаарсинит-ион
PO 3-
PO 4 3-
НРО 4 2-
Н 2 РО 4 -
CrO 4 2-
Cr 2 O 7 2-
Метафосфат-ион
Ортофосфат-ион
Гидроортофосфат-ион
Дигидроортофосфат-ион
Хромат-ион
Дихромат-ион
Комплексті анионның аталуы: комплекс түзуші элементтің латынша атының алдына грек сандарынан префикс сан қойылады, ол лиганда санын көрсетеді, одан кейін лиганданың латынша аты беріліп, оған -ат жұрнағы жалғанады. Егер лиганда анион болса, оның атына о - дауысты дыбысы жалғанады: [Zn(CN) 4 ] 2- терацианоцинкат ион. Егер комплекс түзуші айнымалы валенттік көрсетсе, валенттілігін рим цифрымен жақша ішінде комплекс түзуші алдында көрсетілуі керек: [Fe(CN) 6 ] 3- - гексацианоферрат (ІІІ) ион, [Fe(CN) 6 ] 4- - гесацианоферрат (ІІ) - ион. Егер комплексте бірнеше лиганда болса олардың аты бірінен кейін бірі жазылады: [Pt(NH 3 ) Cl 3 ] -аминтрихлороплатинат (ІІІ) - ион.
Кез-келген тұздың аты ілік септіктегі катион аты мен тәуелдік жалғаудағы анион атынан тұрады. Ілік септік жалғауын жазбай қоюға болады: NaCl-натрий хлориді, ВаСО 3 - барий карбонаты, Fe 3 (PO 4 ) 2 - темір ортофосфаты(ІІІ), Са(Н 2 РО 4 ) 2 - кальций дигидрофосфаты, [Al(OH) 2 ] 2 SO 4 - алюминий дигидроксо-сульфаты, K 3 [Fe(CN) 6 ] - калий гексоцианофераты (ІІІ), VO 2 Cl -диоксованадий хлориді, КAl(SO 4 ) 2 - алюмокалий сульфаты, [Cu(NH 3 ) 4 ] SO 4 - тетрааминмыс (ІІ) сульфаты.
Анион лигандалар атына үнемі жалғастырушы дауысты дыбыс -о қосылады. Мысалы:
F - - фторо; OH - - гидроксо;
Cl - - хлоро; CN - - циано;
O 2- - оксо; NCS - - тиоцианато;
S 2- - тио; H - - гидридо;
Бұл ережеге көмірсутек аниондары бағынбайды. Мысалы, С 2 Н 5 - циклопентадинил. Нейтрал лигандаларды атағанда лиганда ролін атқарып тұрған зат аты өзгеріссіз алынады. Мысалы, N 2 H 4 - гидрозин, С 2 Н 4 - этилен. Бұған бағынбайтын арнайы атауы бар төмендегі лигандалар:
Н 2 О - аква; СО - карбонил;
NH 3 - аммин; NO - нитрозил.
Кейбір күрделі органикалық лигандалардың аталуы әріптік белгілеулермен алмастырылады:
en - этилендиамин NH 2 CH 2 CH 2 NH 2 ;
Ру - пиридин С 6 Н 5 N;
ur - карбамид (NH 2 ) 2 CO;
PEt 3 - триэтилфосфин Р(С 2 Н 5 ) 3 ;
Нейтрал комплекстер аталуы ешқандай қосымшасыз жоғарыда келтірілген ережелер бойынша жазылады:
[Fe 2 (CO) 9 ] - екі темір нонакарбонилі;
[Mo 6 Cl 4 ] - төрт хлорогексамолибден;
Катионды комплекстер аталуы күрделі заттардың номенклатура ережесіне сай жүреді, яғни соңынан комплексті катионды комплекс түзушінің тотығу дәрежесін көрсетіп, соңынан анион белгіленеді. Мысалы:
[Ag(NH 3 ) 2 ] + - диаминкүміс (ІІ) катионы;
[Fe(H 2 O) 6 Cl 3 - гексаакватемір (ІІІ) хлориді;
[Bi(OH) 12 ] 6 + - (ІІІ) катионы;
[Al(H 2 O) 5 (NO) ] SO 4 - (ІІІ) сульфаты.
Анионды комплексті атағанда комплексті ион атауына -ат жалғауы қосылып, комплекс түзушінің тотығу дәрежесі көрсетіліп, катион атынан кейін жазылады.
K 3 [Fe(H 2 O) 2 (OH) 4 ] - калийдің (ІІІ) ;
K 3 [Ru(CN) 6 ] - калийдің гексацианорутенаты (ІІІ) ;
K 4 [Ru(Cl) 6 ] - калийдің гексахлорорутенаты (ІІ) ;
Na 3 [COF 6 ] - натрийдің гексофторокобальтаты (ІІІ) ;
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz