Химиялық байланыс: түрлері, қасиеттері және молекула құрылысы мен құрамы



Оңтүстік Қазақстан медицина академиясы
Химиялық пәндер кафедрасы
РЕФЕРАТ
Тақырыбы: “ Химиялық байланыс. Химиялық байланыстың негізгі түрлері және сипаттамасы. Химиялық байланыс қасиметтері, молекула құрамы мен құрылысы”
Орындаған: Дуйсенбекова А.
Топ: В-ЖМҚБ-02-19
Қабылдаған: СейтимбетоваК.
Шымкент, 2019
Химиялық байланыс. Химиялық байланыстың негізгі түрлері мен сипаттамасы. Химиялық байланыстың қасиеттері, молекула құрылысы мен құрамы”
Химиялық байланыс- молекулалардың немесе молекуллық қосылыстардың түзілуіне алып келетін, атомдардың арасында болатын байланыс. Химиялық байланыс пайда болуы үшін атолмдардың оларды үнемі айналыпа тұратын электрондары өзара әрекеттеседі. Химиялық байланыстың қазіргі кездегі сипаттамасы кванттық механикаға негізделген.
Химиялық байланыс түрлері:
- Ковалентті байланыс;
- Иондық байланыс;
- Сутектік байланыс;
- Металдық байлайланыс.
Колвалентті байланыс- электрондардың жұптасуы әсерінен пайда болатын байланыс. ” Ковалентті байланыс” сөзін латын тілінен аударатын болсақ болсақ, “cо”- бірге, ал “vales”- күш-қуат, қабілеттілік дегенді білдіреді. Яғни, атомдардың басқа бір атомдармен байланыса алу қабілеттілігі деген сөз . Ковалентті байланыс тек бейметалдадың арасында жүреді. Коввлентті химиялық байланысты ең алғаш рет 1916 жылы американдық химик Дж. Льюисом анықтаған болатын. Алғашында оның жаңалығы тек гипотеза деп қана, қарастырылып кейіннен барып толық тәжірибиелік тұрғыдан дәлелденді. Тәжірибиеден бейметалдардың электртерістілігіи анағұрлым жоғары екендігі, яғни, екі бейметал атомдарының химиялық әрекеттесуі кезінде бір-біріне электрондарын толық беріп жіберуі мүмкін еместігі анықталды. Бұл жағдайда октет ережесінің орындалуы үшін электрондардың бірігу қажеттілігі туындайды. (Октет ережесі- s- және p- элементтердің электрондарды беріп жіберуі, қосып алуы немесе жұптастыру нәтижесінде сыртқы энергетикалық қабатын 8-электронға дейін толтыруға негізделген. ) Мысал ретінде сутегі және хлор атомдарының өзара әрекеттесуін қарастырып көрейік.
H 1s 1 - сыртқы қабатында бір электрон
Cl 1s 2 2s 2 2p 6 3 s 2 3p 5 сыртқы қабатында жеті электрон.
Толық аяқталған сыртқы электрондық қабатқа ие болуы үшін екі атомға да бір бір электроннан жетіспей тұрғандықтан, әр атом “ біріккен қолданыс ”үшін бір бір электроннан береді. Міне осы кезде октет ережесі орындалады жене екі атом арасынды ковалентті байланыс пайда болады.
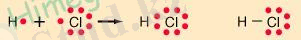
Қорыта келе ковалентті байланыс екі бейметалл атомдарының электрондарыныңти қосылуынан пайда болады және пайда болған жаңа зат молекула деп аталады.
Ковалентті байланысқа тән қасиеттер:
- Байланыс ұзындығы
- Байланыс энергиясы
- Қаныққандылығы
- Бағытталуы
- Полярлылығы
- Поляризациялануы
Байланыс ұзындығы атом ядроларының арақашықтығы. Байланыс ұзындығы атом радиусымен тікелей байланысты. Атом радиусы ұзын болса, байланыс ұзындғы да соншалықты ұзын болады.
Кей атомдардың ковалентті радиустарының мәні: (пм; 10 -12 м) :
- H = 30 пм;
- F = 58;
- O = 73;
- N = 75;
- C = 77;
- Cl = 99;
- S = 103;
- P = 110;
- Si = 118;
- Al = 130.
Симметриялы молекулаларда (H 2 , F 2 , Cl 2 . . . ) байланыс ұзындығының жартысын ковалентті радиус дейді. Ковалентті радиусты білу арқылы молекуладағы коваленттік байланыстың ұзындығын білу оңай болады. Мысалы, HF молекуласындағы ковалентті байланыс ұзындығы:
HF = 30 + 58 = 88 пм.
Байланыс энергиясы байланыс түзуге жұмсалған энергияны айтамыз. Байланыс энергиясы неғұрлып жоғары болса, байланыс соғұрлым берік болады.
Ковалентті байланыстың қаныққандылығы дегеніміз атомның шектік сан түзу қабілеттілігі. Яғни, атом дардың белгіл бір мөлщерде ғана коваленттік байланыс түзуі. Себебі барлық бос электрондар байланыс түзуге қатысады. Ал атомдардан түзілген байланыс сандары оның сыртқы атомдық орбитальдар санымен шектелген.
Ковалентті байланыстарлдың бағытталуы молекулалардың кеңістіктегі құрылымына, яғни, пішініне себепші болады. Бағытталуы дегеніміз қабаттасуы нәтижесінде пайда болатын химиялық байланстың белгілі бір бағдары.
Байланыс арасындағы бұрышты валентті бұрыш деп атайды.
Байланыстың полярлылығы атомдардың электртерістілігінің айырмашылығың болуына байланысты. Электротерістілігінде айырмашылық қаншалықты көп болса, байланыс соншалықты полярлы болып келеді.
Байланыстың поляризациялануы сыртқы электр өрісінің әсерінен электрондардың полярлы болу қабілеті. ПОляризация мүмкіндігі электрондардың қозғалтқыштығымен анықталады. Электрондар неғұрлым қозғалмалы болса соғұрлым ядродан алыс орналасады. Яғни, коваленттік байланыстың поляризациясы байланыс ұзындығына тура пропорционал. Дәлірек айтқанда, егер байланыс ұзындығы артса электрондар атом ядросынан алыстап кетеді, электрон ядродан қаншалықты алыстаса электрондар соғұрлым әлсіз болады. Сондықтан оларға әсер еткенде жылжуы оңай болады.
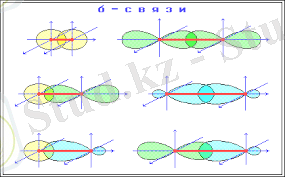
Ковавлентті байланыс электрон бұлттарының қабысуы бойынша екіге жіктеледі:
1) Егер электрон бұлттарының қабысуы ядроны кесіп өтетін осьте түзілсе мұндай ковалентті байланыс σ- байланыс деп атаймыз.
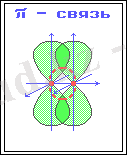
2) Егер электрон бұлттарының қабысуы ядроны кесіп өтетін осьтің екі жағында түзілетін байланеысты π-байланыс деп атаймыз.
Электрондық жұптарынеың санына байланысты ковалентті байланыс:
- Егер атомдар тек бір жұп электрондарымен алмасса онда олдара байланыс(H2, HCl) ;
- Егер атомдар ЕКІ жұп электрондарымен алмассақос байланыс(O2) ;
- Егер үш жұп элекьрондарымен алмассаүштік байланысдеп аталады(N2) .
Сигма байланыс пи байланысқа қарағанда берік болып келеді. Кез келген бір байланыс сигма байланыс, кез келген қос байланыстың біреуі сигма біреуі пи байланыс, ал үш байланыс болған жағдайда екі пи және бір сигма байланыс болады.
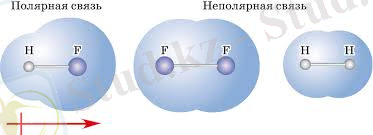
Ковалентті байланыстың полярлылығына байланысты ковалентті полюсті және ковалентті полюссіз деп аталатын екі түрі бар.
Ковалентті полюсті байланыс- электртерістілігі әртүрлі атомдар арасында пайда болады, яғни, әртүрлі бейметалл атомдарының арасында пайда болады. Көп жағдайда молекуладағы ковалентті байланыс түзуге қатысатын электрондар электртерістілігі жоғары элемент атомына жақынырақ орналасады.

Ковалентті полюсті байланыс- электротерістілігі бірдей атомдар арасындағы болатын байланыс түрі.
Ковалентті байланыс түзілудің механизмдері:
- Ковалентті байланыс түзудіңалмасу механизмікезінде әр атомның өз бос электрондары болады. Сондай әртүрлі атомдардың бос электрондары ортақ элекрон жұбын түзеді. Мысалы: HCl
- Донорлы-акцепторлымеханизм кезінде бір атомда еркін электрон жұбы болады, ал екінші атомда бос орбиталь болады. Бірінші атом(донор) озінің еркін электрон жұбын екінші атомға(акцептор) ортақ қолданысқа береді. Мысалы: аммони катионында азот өз электрон жұбын бос орбитальі бар сутек ионына береді, осыдан ковалентті байланыс түзіледі
... жалғасыКөрсетілген екі мысалдағы ковалентті байланыстарда еш айырмашылық жоқ айырмашылық тек олардың түзілу механизмінде.
Иондық байланыс дегеніміз- қарама қарсы зарядталған иондардың электростатикалық әсерлесуі нәтижесінде пайда болатын химиялық байланыс. Ол электртерістілігінде үлкен айырмашылығы бар атомдар араснда пайда болады. Электртерістілік дегеніміз жалпылама айтқанда атомдардың бір мезетте өз электрондарын ұстап тұра алуы және басқа атомдардың электрондарын қосып алу қабілеттілігі.
Иондық байланыс металлдар мен бейметаллдар арасында пайда болады. Себебі, металлдар өздерінің электрондарын беріп жіберуге қабілетті келеді ал бейметаллдар оларды өдеріне оңай қосып алады. Бұл теорияны 1916 жылы неміс ғалымы Вальтер Кроссель ұсынған болатын.

1888-1956 ж. ж.
Иондық байланыстың пайда болуына мысал ретінде натрий хлоридін алып қарастырып көрейік.
Натрий атомының өз электронын беріп жіберуі оң зарядталған Na+ катионының пайда болуына алып келеді. Натрий электронынығң хлор атомына қосылуы теріс зарядталған Cl- анионының пайда болуына алып келеді.
Қарама қарсы зарядтары бар Na+ және Cl- иондарының арасында электростатикалық тартылыс пайда болады, нәтижесінде химтиялық байланыстың иондық типі бар натрий хлориді түзіледі.
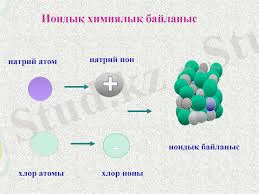
Иондық байланысты ковалентті байланыстың шекті түрі деп қарастыру керек. Иондық байланыстың ковалентті байланыстан айрашылығы : бағытталмайды, қанықпайды, зарядталады:
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz