Физика-химиялық талдау әдістерінің шолуы: электрохимиялық, спектроскопиялық және хроматографиялық тәсілдер


Кіріспе . . . 3
1. Электрохимиялық талдау әдістері . . . 4
1. 1. Кондуктометрия . . . 4
1. 2. Потенциометрия . . . 7
1. 3. Вольтамперометрия . . . 10
2. Спектроскопиялық және басқа да оптикалық әдістері . . . 13
2. 1. Атомдық эмиссиондық спектрлері . . . 15
2. 2. Нефелометрия және турбидиметрия . . . 17
2. 3. Рефрактометрия . . . 19
3. Хромотографиялық талдау әдістері . . . 21
3. 1. Радиометрлік талдау әдістері . . . 22
3. 2. Кинетикалық талдау әдістері . . . 23
Қорытынды . . . 25
Пайдаланылған әдебиеттер . . . 26
\
Кіріспе:
Физикалық-химиялық талдау әдістері белгілі бір химиялық реакция нәтижесінде талданатын жүйедегі өзгерістердің: жарық сіңіру, жарықтың сынуы, электр өткізгіштік, жылу өткізгіштік сияқтылардың физикалық сипатын бақылауға негізделген. Бұл әдістің басты өзгешелігі, мұнда заттардың реагенттермен өзара әсерлесуі ғана емес, электр тогының немесе әр түрлі сәуле шығару мен бөлшектер шашырандыларының затпен әсерлесуі жиі қолданылады.
Физикалық-химиялық талдау әдістері тобынан физикалық әдістерді жеке-дара бөліп қарастырудың негізі жоқ. Өйткені затты талдау барыснда оның физикалық және химиялық қасиеттері бірдей қарастырылады . Бұл әдіс көбіне өлшегіш аспаптармен жабдықтардың көмегіне сүйенетіндіктен, шетелдік ғылыми әдебиеттерге мұны аспаптық әдіс деп те атайды.
Физикалық-химиялық талдау әдістерінің мынандай артықшылықтары бар:
1. Сұрыптамалы- ондаған құрамдас бөліктері арасынан бір мезгілде керектісін сұрыптап, таңдап алу, қайсыбір спиральды, полярографиялық, масс-спектрометр сияқты әдістермен бірге бірнеше құрамдас бөліктерді сандық әрі сапалық тұрғыдан анықтау; 2. талдауды жүргізудің тым шапшандығы; 3. физикалық-химиялық әдістерді автоматтандыру оңай. Бұл өндіріс жағдайында технологиялық процестерді бақылауға, оны автоматты түрде реттеуге мүмкіндік береді.
Талдаудың физикалық-химиялық әдістерін жік-жікке бөлу негізінде зерттелетін заттың физикалық қасиеті алынады. Физикалық қасиеттрге байланысты әдістер: спектрлік, элеткр-химиялық, хромотографиялық, радиометрлік, масс-спектрометрлік, термиялық деп аталатын топтарға бөлінеді.
Спектрлік талдау әдістері талданатын жүйенің оптикалық қасиетін өлшеуге негізделген. Ол абсорбциялық, спектроскопия, спектрофотометрия, люменесценция, рефрактометрия, поляриметрия, нефелометрия, турбидиметрия, т. б. әдістерді қамтиды.
Электрохимиялық талдау әдістері зерттелетін жүйунің электрлік және химиялық қасиетін өлшеуге, дәлірек айтқанда, электродтарда немесе элеткродтар арасындағы кеңістікте өтетін процестерді анықтайды. Мұндай кезде жүйенің потенциал, ток, электр мөлшері, кедергі, ток өткізгіштік сияқты парметрлері пайда болып, өзгеріске түседі. Мәндері талданатын заттың концентрациясына пропорционал, жүйенің тиісті әрі ерекше сипаттамалары мен электрохимиялық әдістің өзін жіктеу электродтарда жүретін процестерге негізделген.
1. Электрохимиялық талдау әдістері
Қазіргі кездегі аналитикалық химияны ХХ ғасырда қарқынды дами бастаған сапалық және сандық талдаудың электр химиялық дами бастаған сапалық және сандық талдаудың электр химиялық әдістерінсіз қарастыру мүмкін емес. Оның қауырт дами бастауы теориялық электрохимиямен және өлшеуіш радиоэлектрондық аппаратураларды зерттеумен байланысты. Мұнсыз талдаудың электр химиялық әдістері жоғары сезімталдық, дәлме-дәлдік, тездік, қайта өңдеп шығару, автоматтандыру мен компьютерлеу сияқты қасиеттерге жете алмаған болар еді.
Электрохимиялық әдістің көмегімен кез келген агрегаттық күйдегі анорганикалық және органикалық қосылыстарды сандық және сапалық тұрғыдан талдауға болады. Зерттелетін ортадағы электр химиялық процесстер өзара жанасатын фаза шекараларында немесе олардың көлемінде жүреді, олар құрылымның, валенттік күйдің, химиялық құрамның, концентрацияның және басқа да параметрлердің өзгерісімен байлпнысты.
Электрохимиялық талдау әдістерін әрқайсысын жіктеуге болатын топ-топтарға бөліп қарастыруға болады. Мысалы, потенциометрия, кондуктометрия және жоғарғы жиіліктегі титрлеу, вольтамперметрия және полярография, кулонометрия, диэлектрометрия.
Потенциометрияға электр қозғаушы күші немесе қайтымды электролитті тізбектегі Рн не Рх электродтарға тиісті потенциалдарды өлшеуге негізделген әр түрлі физикалық-химиялық шамаларды, иондардың не молекулалардың концентрациясын анықтайтын әдістер жатады.
Вольтамперметрия термині электрохимиялық өлшеу әдістеріне ХХ ғасырдың 40 жылдарында енді. Бұл әдіс зерттелетін электролитті ұяшыққа берілетін поляризация тогының поляризациялану кернеуіне тәуелділігін анықтауға негізделген. Бұл кезде жұмыс істеп тұрған электрод потенциалы оның тепе-теңдіктегі күйіндегіден едәуір өзгеше болады.
Кулонометрия әдісі элетктрохимиялық түрленуге түскен заттың мөлшері мен электролиттік ұяшық арқылы өтетінток мөлшері мен электролиттік ұяшық арқылы өтетін ток мөлшері арасындағы байланысты орнықтыратын Фарадей заңына (1834) негізделіп жүргізілетін талдау тәсілдерін қамтиды.
Кондуктометрия электрометрдің электр өткізгіштігін, яғни балқымалар, коллоидтер сулы және сусыз ортада нағыз ерітінді күйінде болатын иондық өткізгіштерді анықтауда негізделген. Бұл әдістің басқалардан басты ерекшелегі, ол тек электродтар арасындағы кеңістіктегі иондардың концентирациясын өлшеуге ғана негізделген, және ол электродтардағы тепе-теңдік потенциалының өзгеруімен байланысты емес.
2. Кондуктометрия
Электролиттердің концентрациясын кондутометрлік әдіспен анықтау талданатаын ерітіндінің электр өткізгіштігін өлшеуге негзіделген. Кондуктометрия- ең қарапайым эәне таідап сұрыптаудың электр химиялық әдісі. Кондуктометрлік әдістердің барлығы жылдамдығымен барлығы жылдамдығымен, өлешуіш приборларының оңай табылуымен, жұмысының ыңғайлылығымен, қанағаттанарлық дәлдігімен, өндірістік, технологиялық және лабораториялық жағдайларда ьалдауды автоматты түрде әрі қашықтықтан жүргізу мүмкіндігімен сипатталады. Тікелей кондуктометрлік анықтаудың қателігі 1-2%. Ал белгілі бір арнайы жағдайды сақтағанда ьалдау қателігі 0, 2%-ке дейән азаяды кондуктометрлік ұяшықтарды термосататсыз өлшегенде бұл қателіктер 3%-ке артады, өйткені температураның бір градусқа жоғарылауы элекр өткізгіштікті 2 және 3 проценттей өзгертеді. Демек, ерітінділерді термостаттау кондуктометрлік талдау әдісінің дәлдігін арттырады.
Кондуктометрияның теориялық негізі
Электролит ерітнділерінің электр өткізгіштігі осы ерітіндінің кедергісіне кері шама, әрі ол сыртқы электр өрісінің әсерінен еріген заттың электр тогын өткізу қабілетіне байланысты. Ендеше бұл әдіс электрдің негізгі заңдарының бірі Ом заңына бағынады:
I= E/R ,
Кондуктометрияда өлшенетін шама ерітіндінің кедергісі немесе электр өткізгіштігі болуы мүмкін. Электрөткізгіштігінің бірлігі - кедергісі 1Ом өткізгіштің өткізгіштік қабілеті. Электролит ертітіндісінің электр өткізгіштігі- сыртқы кернеу көзі әсерінен заттың электролиттік диссоциация және иондар қозғалуының нәтижесі. Электролит ерітіндісі- үш өлшемді өткізгіш. Ал кез келген ерітінді кедергісінің шамасы ұяшықтың құрамына, шамасына және электродтардың кеңістіктегі орналасуына тәуелді.
Барлық белгілі өткізгіштер электр тогы өткен кездегі электрдің тасымалдану механизміне қарай үш топқа бөлінеді: электрондық, иондық, аралас.
Электрондық өткізгіштер. Мұнда өткізгіштердегі электрді тасымалдаушылар-электрондар. Электрондық өткізгіштерге металдар, жартылай өткізгіштер, металл құймалар және кейбір тұздар мен тотықтар жатады.
Иондық өткізгіштер. Мұндағы электр тасымалдаушылар- иондар. Осы өткізгіштерге газдар, электролиттер және олардың ерітінділері жатады.
Аралас өткізгіштер әрі иондық, әрі электрондық қасиетке ие. Осыған сұйық аммиактағы сілітілік жер элементтердің ерітінділері, тұздар және кейбір сұйық құймалар жатады. Мұндай өткізгіштерде температураның белгілі бір аралықтарында ток өткізу сипаты өзгереді.
Кондуктометрлік әдістердің жіктелуі
Кондуктометрияны тура және жанама деп жіктейді. Тура кондуктометрия әдісі зат концентарциясын ерітіндінің электр өткізгіштігі бойынша анықтайды, онда да бұл екеуінің арасындағы тура пропорционалдық тәуелділіктің болуына байланысты.
Жанама кондуктометрия әдісі. Бұл әдіс көп кұрамды ерітіндідегі тек бір ғана құрамдас бөлікті талдаған кезде, кондуктометриямен қатар талдаудың басқа да физикалық-химиялық әдістерін қолдануга негізделген. Сол сияқты жанама кондуктометрия әдісіне ерітіндідегі әйтеуір бір қосылыс немесе сумен әрекеттесіп, электр өткізгішті өзгертуге себепші болатын газдың концентрациясын анықтау да енеді, мысалы, С02, NH3, S02, S03, N02 және т. б.
Кондуктометрлік титрлеу
Титрлеу процесін бақылау үшін электр өткізгіштікті өлшеу әдісін колдануды берілген ерітіндінің электр өткізгіштігі реагент не реакция өнімінікінен айтарлықтай өзгеше болған жағдайда қолдануға болады. Титрлеу кезінде ұяшык тұрактысын білу шарт емес, өйткені ә. н. -ді табу үшін салыстырмалы шамалар да жеткілікті. Алайда электродтар арасы өзгеріссіз қалғаны абзал, яғни олар кеңістікте мықты орналасуы керек.
Кез келген ион ерігіндісінің электр өткізгіштігіне қосар үлесі, оның концентрациясы мен эквиваленттік электр өткізгіштігіне тура пропорционал, бірақ титрлеу барысында реагенттің қосылуына қарай ерітіндінің көлемі артып отырады. Бұған электр өткізгіштікті есептеу кезінде ерітіндіні сұйылтқанда өзгеріс енгізу керек. Сызықты тәуелділіктен ауытқу іс жүзінде реакцияға түсуші зат не өнімнің гидролизденуі немесе тұнбанын ішінара еруі не тұрақтануы салдарынан байкалады.
Титрлеу қисығының пішінін теориялық тұрғыдан болжауға болады. Титрлеу кезінде жүйелі нүктелердегі әр ионының концентрациясын стехиометрия, тепе-теңдік, сұйылту заңдарына, тендеуіне негізделген белгілі әдіспен есептейді.
кесте-1. Кейбір иондардың қозғалғыштығы
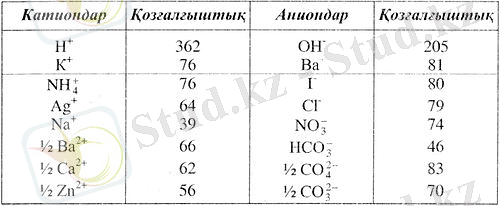
Концентрацияны шамасына көбейгіп, әрбір ионның cалыстырмалы үлесін алсақ, онда олардың қосындысы титрлеу қисығын береді.
Сұйығылған ерітіндінің электр өткізгіштігін есептегенде, иондардың қозғалткыштығының мәнін жиі пайдалануға тура келеді Ерітіндідегі әр түрлі иондар бір-бірінен қозғалғыштығымен өзгешеленеді.
Қышқыл мен негіздің өзара әсерлесу реакциялары
Қышқыл мен негіздің өзара әсерлесу реакциялары . Мұндай әрекеттесу кезінде титриметрлік кисықтың пішіні мен олардың тармақтары арасындағы бұрыштын шамасы титрлейтін жүйеде кездесетін иондардың қозғалгыштыгына ғана емес, қышқыл мен негіздің дәрежесіне, олардың ерітіндідегі концентрацнясына тәуелді болады. Қышқылды-негізді титрлеу кезінде аса қозғалғыш сутек пен гидроксид иондарынан аз диссоциацияланған қосылыс - су және күшті диссоциацияланатын тұз түзіледі, алайда тұз иондарының қозғалғыштығы сутек пен гидроксид иондарыныкінен аз:
Н+ + A- + Ме+ + ОН-> Н20 + Ме+ + А-
Күшті қышкыл-күшті негіз. Кондуктомегрлік қисық екі түзу сызықты тармақтан тұрады. AC тармағын нейтралдау қисығы дейді және ол электр өткізгіштігінің қосынды эффектісін көрсетеді.
Орташа күшті қышқыл - күшті негіз. Бұл жағдайда титрлеу қисығының минимумы болады да, аналитикалық мәні бола бермейді. Титрлеудің бірінші сәтінде әлсіз қышқыл мен күшгі негізден түзілетін тұздың пайда болуы нәтижесінде электр өткізгіштік кемиді, өйткені бұл тұз жақсы диссоциацияланған және қышқылмен ортақ анионы болғандықтан, оның дисеоциациялануын басады, яғни сутек иондары конценграциясының кемуі басталады. Мұнан кейінгі сілтінің қосылуы тұздағы электр өткізгішгікті арттырады. Эквиваленттік нүктеден кейін ерітіндінің электр өткізгіштігі гидроксид иоидарының көбейіп кетуі салдарынан тез өседі.
Әлсіз қышқыл - күіиті негіз. Бұл жұпта тұздан түзілетін гидролиздің ықпалы э. н. маңайында қисықтың баяу иілуімен кескінделеді Бұл жағдайда эквиваленттік нүктені кәдімгі графиктік тәсілмен анықтау мүмкін бола бермейді.
Әлсіз қышқыл - әлсіз негіз. Бұл жағдайда титрлеу қисығы э. н. - ге біршама баяу өгетіндіктен, оны ЭЕМ көмегінсіз байқау мүмкін емес. Ал кондуктометрлік титрлеуді белгілі бір дәрежеде, тек оның жоғарғы рК НА шегінде ғапа жүргізуге болады, оны мына деректермен шектейді:
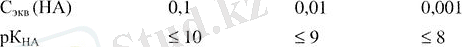
1. 2. Потенциометрия
Потенциометрлік әдіс қайтымды немесе қайтымсыз гальваникалық элеменггердегі электродта пайда болатын электр потенциалдарының айырымын өлшеуге негізделген. Мұны ерітіндідегі заттың мөлшері мен физикалық-химиялық сипаттамасын анықтау үшін қолданады.
Бұл әдісте қолданылатын гальваникалық элемент индикаторлық, салыстырмалық деп аталатын екі электродтан тұрады. Бұларды тасымалсыз элемент болатындай бір ерітіндіге немесе аралары сұйық қосқыш арқылы жалғасқан тасымалды тізбек құратын әр түрлі ерітіндіге енгізуте болады. Индикаторлық электродтың потенциалы ерітіндідегі анықталатын иондардың активтігіне, яғни концентрациясына тәуелді. Ал оның мәнін өзге иондарға тәуелсіз тұрақты потенциалы бар салыстырмалы, яғни қалыпты электрод көмегімен анықтайды.
Талдауда қолданатын потенциометрлік әдістің басты артықшылығы - оның аса дәлдігі, сенімділігі, сезімталдығы, оңай қайталампаздығы, сұйытылған, боялған әрі лайлы ерітінділерге қолдану мүмкіндігі. Сондай-ақ, бұл әдіспен алдын ала жеке бөліп алмай-ақ, екі не одан да көп заттан тұратын құрамдас бөліктерді де анықтай береді. Бұл оның талдау мүмкіндігінің шеңберін кеңейте түседі. Мұндағы титрлеуді сулы, сусыз не аралас ортада да жүргізуге болады, яғни суда бөлініп, жеке титрлене бермейтін бірнеше құрамдас бөліктері бар қоспалардың құрамын анықтайды. Мұнымен қатар суда ерімейтін немесе суда ыдырайтын біраз өнімдерді де талдауға болады. Бұл әдістің тағы да бір артықшылығы сигналдарды, сенсорларды пайдаланып, титрлеу ісін автоматты жүргізуге, тіпті едәуір қашықтықтан (не көрші бөлмеден де) басқаруға болады.
Әдістің жіктелінуі.
Тура потенциометрия. Бұл әдіс бойынша ерітіндідегі талданатын заттың концентрациясын немесе активтілігін табу үшін тәжірибе кезінде өлшенген тізбектің ЭҚ күшін немесе салыстыру электроды арқылы анықталған индикаторлық электрод потенциалының мәнін Нернст теңдеуіне қояды. Тура потенциометрияда рН-метрия және ионометрия дейтін екі түрлі тәсіл бар.
рН-метрия әдістері биологиялық, дәрі-дәрмектік, химиялық, ауылшаруашылық, түрлі технологиялық құбылыстар мен мұнай, тамақ, қағаз, т. б. салаларда тікелей қолданатын және үлкен моні бар әр түрлі орталардағы сутек иондарының концентрациясын және активтігін анықтайды.
Ионометрия әдістері сулы және сусыз ерітінділердегі газдар мен әр түрлі иондарды анықтауда аса маңызды рөл атқарады. Оны да медицина саласында дәрі-дәрмек үшін биологиялық, химиялық зерттеулерде айнала коршаған ортаны, технологиялық процестерді талдау кезінде қолданады.
Редоксиметрия әр түрлі жүйедегі тотығу-тотықсыздану потенциалын өлшеуге негізделген бірнеше әдістердің басын біріктіреді. Бұл әдісте протолиттік процестер мен кешенді қосылыс түзілуі, зерттеу, дәрі-дәрмек, және т. б салаларда немесе зерттеу жұмыстарында кеңінен қолданылады.
Потенциометрияның теориялық негіздері.
Талдаудың потенциометрлік әдістері, электрохимиялық ұяшықта пайда болатын электр қозғаушы күштің талданатын ерітіндідегі анықталатын құрамдас бөлік таралымына тәуелділігін пайдалануға негізделген. Екі электрод потенциалының айырымы ЭҚК болады, яғни
ЭҚК = Е1-E2
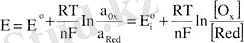 Электрод потенциалын Нернст теңдеуімен өрнектесек,
Электрод потенциалын Нернст теңдеуімен өрнектесек,
немесе
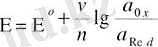
мұндағы E - әрбір электродтың потенциалы; E0 - белгілі редоксжұптағы электродтың стандартты потенциалы: R - газ тұрақтысы - 8. 312 Дж (моль*К) ; Т - абсолюттік температура; F - Фарадей тұрақтысы (96500 Кл/моль) ; n - электродты реакцияға қатынасын электрон мөлшері, әдетте, ол бір молекула (ион) қабылдаса - оң, берсе - теріс таңбаланады; α0x, αRed, [0X], [Red] - анықталатын заттың тотыққан және тотықсызданған түрлерінің активтігі мен концентрациясы; u=2. 3 RT/Ғ немесе қалыпты жағдайдағы u=0, 059 шама.
Электрод типтері
Потенциометриялық талдау әдістерінде қолданатын электродтар екі топқа бөлінеді: салыстыру электроды және индикаторлық электродтар. Салыстыру электродтары . Бұл типтегі электродтар ток күші әлсіз болғанда да, потенциалдың тұрақты түрде болуын қамтамасыз етеді, өйткені электродтардың потенциалын өлшегенде оларды үлгі ретінде қолданады. Жалпы оларға қойылатын негізгі талаптар: потенциалды анықтаушы электродты реакциялар термодинамикалық тұрғыдан алғанда қайтымды болуы керек.
Индикатор электродтары. Талданатын құрамдық заттың концентрациясы Нернст теңдеуімен байланысқан кезде индикаторлы электродтың потенциалы салыстыру электродына қатысты анықталады. Олар мына шарттарға сәйкес болуы керек: электрод потенциалы тез қайталанып, оңай қалыптасуы; кейбір жағдайларда электрод қайтымды болуы; электрод ерітіндідегі заттармен әрекеттеспеуі керек.
Рн-метрия
рН-метрия 1909 жылы Зеренст гальваникалық элементтің электр қозғаушы күшін өлшеу кезінде сутек иондарының концентрациясын потенциометрлік апықтауды жүзеге асырады: Pt, Н2 НСІ (х)КСІ (0, 1 М) Hg2, Cl2, Hg
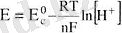 Мұндай элементтің ЭҚК-ін есептеуге арналған Нернст теңдеуін былай жазады:
Мұндай элементтің ЭҚК-ін есептеуге арналған Нернст теңдеуін былай жазады:
мұндағы Е°c-шамасы тәжірибе кезінде анықталады. қалыпты ерітіндідегі сутек иондарынын концентрациясын (Н+) формуласы бойынша есептейді. ал осындағы тұз қышқылының диссоциясы дорежесі ток өткізгіштік бойынша өлшенеді, С - тұз қышқылының ерітіндідегі мольдік концентрациясы. 25°С-та Е°c = 0. 3376 В, рН = (Е - 0, 3376) /0, 0592;
Потенциометрлік титрлеу
Эквиваленттік нүктені табуға негізделген титрлеу реакциясыпа қатынасқан қосылыстың тек біреуі ғана электродты құбылыска араласатын болғанда, эквиваленттік нұктенің маңында индикаторлы электродтың потенциалы өзгереді. Айталық кышқылды - негізді әдіс бойынша титрлегенде, шыны электродын хлоридті хлор-күміс арқылы жүзеге асырады. Мұндағы реакциялар тез өтіп, соңына дейін толық жүреді. Жалпы потенциометрлік титрлеуді жүргізу үшін талданатын ерітіндідегі индикаторлы электрод пен салыстыру электродынан тұратын тізбекті жинақтайды.
Төменгі суретте титрлеу кисықтары мысал ретінде келтірілген:
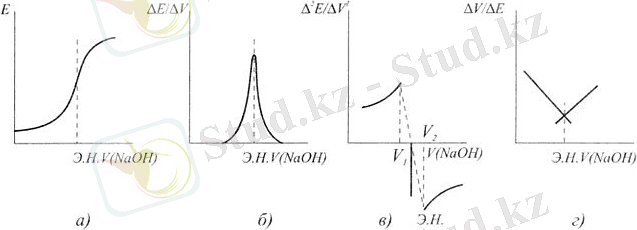
а-кәдімгі қисық; б-дифференциалды қисық; в-екпінді туынды бойынша титрлеу қисығы; г-Гран қисығы.
Потенциометрлік өлшеу
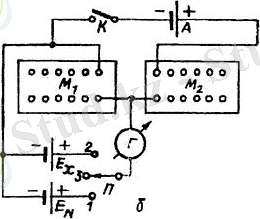
Потенциометрлік өлшеу Потенциометрлік өлшеу қолданылатын әдістердің бәрінде индикаторлық электрод потенциалының анықталатын құрамдас бөліктердің активтігіне, яғни концентрациясына тәуелділігі пайдаланылады. Сонымен қатар бұл әдіспен жалпы электрохимиялық тізбекте ток өтпей тұрғанда, ондағы электр козғаушы күшті өлшейді. Тізбектен ток өтсе, онда электродтар полюстенеді, яғни қайтымсыз ток көзі ретінде жұмыс істеп, ЭҚК мәні тепе-теңдік жайдағыдан төмендейді. Тізбектегі қосымша токтан мүлдем арылу мүмкін емес, сондықтан оны мейлінше 10−7 А шамасында азайтуға тырысады. Сол жақтағы схема бойынша құрастырылған қарапайым құрылғы қолданылады. Ондағы ВС кедергісі бар, ұзындығы 1м реохорд, A- ЭҚК артық және тұракты болатын аккумулятор. Тізбектегі К кілті қосулы тұрганда реохордтың D- жылжымасын қозғалта отырып, реохордтағы кернеудің кемуін өлшейді.
1. 3. Вольтоамперметрия
Вольтоамперметрия талдау әдісін полярографиялық деп те атайды. Осы талдау әдісін 1922 жылы Я. Гейровский ашқан. Бұл әдіс токпотенциалын өлшеуге, әрі олардың арасындағы тәуелділік қисықтарын шешуге, талдауға негізделген. Алынған деректерге суйеніп, талданатын қосылыс сапалық, әрі сандық тұрғыдан сипатталады. Ол анықталатын заттын концентрациясына тәуелді өзгеріп отыратын шекті диффузиялық токты анықтауға негізделген. Полярографиялық прибор қондырғысының схемасы сол жақта көрсетілген. Ондағы блоктар электролиттік ұяшық пен жұмысшы электодты поляризациялайтын құрылғы.
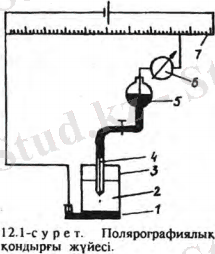
Ондағы 1-индикаторлы электрод, 2-қосымша электрод, 3-электролит, 4-гальванометр, 6-жылжымалы түйіскіш, 7-тұрақты ток көзі, 8-реостат, 9-вольтметр. Электродтың (1, 2) поляризациалану кернеуі реохордқа 5 жылжымалы түйіскіш 6 арқылы беріледі. Осында жылжымалы түйістіргішті оңға қарай жылжытса поляризациялаушы кернеу өседі де, катодтағы потенциал мәні кемиді. Бір сәтте катодтағы кернеу мәні анықталатын зат ерітіндісіндегілердің қайта қалпынакелуі басталады, Е- і қисығы өзіне тән сипатта болады.
Е-і(полярограмма) диффузиялық шекті тоқтың кернеулік тоғы, анықталатын зат концентрациясын пропорционал шамамен анықталады.
Полярографиядағы басты шарттың бірі - электродтардағы ток тығыздықтарының үлкен айырмашылықта болуы. Бұл электро-химиялық реакция жүретін электродтағы жұмысшы беттің аз, әрі оған сәйкес ток тығыздыгының жоғары болуынан. Ал, екінші қосымша электродтың беткі ауданы үлкен болуы керек, ондай электродқа электролизер түбіндегі сынап, каломельді электрод және т. б. жатады.
Әдетте, сынап электродынын тамшысын жұмысшы электрод ретінде қолданады. Сұйық сынаптың қатты металдан көп артықшылығы бар. Электролиз кезінде қайта қалпына келген металдар сынап тамшысымен әрекеттесе келіп, амальгама түзеді. Сонымен қатар сынап мөлшері ерітіндімен, онын құрамындағы талдалылатын қосылыспен салыстырғанда тым аз болатындықтан өлшеу кезінде оның концентрациясы өзгеріссіз қалады. Сынап электродының кернеуі шамадан тыс жоғары болғандықтан, сутегі бөлінбейді, ал бұл жай мырыш, марганец сияқты активті металдарды анықтауға мүмкіндік береді.
Электролиттік ұяшықтағы электродқа түсірген кернеу катод пен анодтагы поляризациялануды тудырып, токтың электролит арқылы өтуіне жүмсалады:
Е = Еа - Ек + I R.
мұндағы Ея мен Ек- анод пен катодтың потенциалдары, R- электролиттік ұяшықтың кедергісі, I- одан өткен ток күші. Егер ерітіндіде бейтарапты злектролит болса, онда кедергі шамасы өте кіші болып, оның ток күшіне кебейтіндісін ескермеуге болады.
Қалдық ток
Анықталатын зат тотықсыздана бастайтын потенциал кезінде ток шамалы, әрі потенциалдың өсуімен баяу әседі. Бүкіл электролиз уақыты ішінде байқалатын мұндай токты і0 не I0 қалдық ток деп атайды. Ол сыйымдылық (4) іс тогы мен Фарадейлік (іF) токтың қосындысы: і0 = іс + іғ-
Қалдық токтың кұрамды бөлігі - фарадейлік ток. Ол ерітіндідегі болмашы қоспалардың электродтарда тотықсыздану процесінен пайда болып, өте аз мәнге ие болады. Мұндай токтың пайда болуы электродтағы тотығу не тотықсыздану құбылыстарымен байланысты, эсіресе оған ерітіндіде еріген оттегінің ықпалы баршылық. Демек, оны болдырмау үшін алдын ала тиісті шаралар қолдану қажет.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz