Темір электродтарын пайдаланып электролиз арқылы темір(III) сульфатын алу және темір-аммонийлі ашудасын синтездеу: электрохимиялық параметрлер мен поляризациялық қисықтарды зерттеу


2. Тәжірибелік бөлім
2. 1 Жұмыстың орындалу әдістемесі:
Тәжірибе сыйымдылығы 200 мл электролизерде, ерітіндіні араластырусыз бөлме температурасында жүргізілді. Эксперименттік жұмысқа кіріспес бұрын, электролиз әдісін жүргізуге қажеттіконцентрациясы 0, 05 - 2, 0 моль/л H 2 SO 4 күкірт қышқылы электролит ерітіндісін дайындап алдық. Электролиз процесіне қолданылатын темір электродтарының электролитке батырылатын бөлігінің ауданын өлшеп ( 5 x 2, 5 см) алып, арнайы жуғыш заттың көмегімен бөгде заттардан тазартып жуып, 70%этил спиртімен тазартып, дистильденген сумен шайып, фильтр қағазымен сүртіп, кептіріп алдық. Тазартылған темірэлектродтарының массасын аналитикалық таразыда өлшеп алдық : m (A + ) = 5, 547г, m (K - ) = 5, 572 г . Ток тығыздығын есептейміз. Электролиз процесін жүргізуге Б5 - 44M ток көзін қолдандым. Дайын темір электродтарын сымдарға жалғаймыз. Белгілі әдіс бойынша[ ] темір (ІІІ) сульфатын алудың химиялық әдісін іске асыру үшін темір (ІІІ) нитратын аммоний гидроксидімен әрекеттестіреді және түзілген темір (ІІІ) гидроксидіне күкіртқышқылын қосады немесе темір (ІІ) сульфатын азот қышқылымен өндейді. Бұл әдістерді жүргізгенде алынған препараттың тазалығына қол жеткізу оңай емес және қосымша қоршаған ортаға зиянды азот диоксиді бөлінеді. Осыған орай, темір (ІІІ) сульфатын электрохимиялық әдіспен алу тиімді болып көрінеді. Біздің жұмысымыздың мақсаты қол жетімді темір электродтарын пайдаланып, электролиз әдісімен темір (ІІІ) сульфатын алу болып табылады. Әдісті іске асыру үшін катодтық және анодтық кеңістіктерімембрана арқылы бөлінген шыны электрлизерде күкірт қышқылы ерітіндісінде темір электродын анодтық поляризациялауға ұшыраттық. Осы кезде темір электроды еріп, ерітіндіде темір (ІІІ) иондары түзіледі және олар, өз кезегінде, сульфат иондарымен әрекеттеседі.
2. 2 Электролиз әдісімен темір(III) сульфатын алу
Электролиз әдісімен темір(III) сульфатын алу мақсатында, қол жетімді темір электродтарын пайдаланып, шыны электролизерде күкірт қышқылы ерітіндісінде темір электродтарын анодтық поляризациялауға ұшыраттық.
Реакция кезінде катодтық және анодтық кеңістікте келесі реакциялар жүреді:
анодта: 2H 2 O -4e → O 2 + 4H +
катодта: 2 H 2 O + 2e → H 2 + 2OH -
Темір электроды анодта өз иондарын түзе ериді:
Fe - 3e →Fe 3+
Зерттеу жұмыстарының нәтижелері анодтта темір электродтарының бетінде негізінен үш валентті темір иондарының, ал катодтта сутегі газының түзілу реакциялары жүретіндігін көрсетіп отыр [1] .
Темір(III) сульфатының түзілуіне электрохимиялық параметрлердің әсерін жан-жақты зерттедік. Алынған нәтижелер негізінде бейорганикалық қосылыстарды синтездеудің принципиальды технологиялық сызбанұсқалары ұсынылды. Жүргізілген эксперименттік жұмыстардың нәтижесінде темір сульфатын жоғары ток бойынша шығыммен синтездеуге қажетті оптимальды электролиз жағдайы анықталды: і =400-1200 А/м 2 , CН 2 SO 4 =150 г/л. Электролиз кезінде тұз және күкірт қышқылы ерітіндідерінде темір (IІІ) иондарының түзілуіне және оның түзілу жылдамдығына электродтардағы ток тығыздығының әсерін 400-1200 А/м 2 аралығында зерттедік.
Темір электродынының еруінің ток бойынша шығымына әртүрлі параметрлердің әсерін зерттедік. Ең алдымен 2. 1 кестеде көрсетілгендей Fe 3+ -иондарының түзілуінің ток бойынша шығымына электролит концентрациясының әсері зерттелді.
C(H 2 SO 4 ) = 150г/л; t = 25 0 С
Кесте- 2. 1
Концентрациясы
г/л
Ток бойынша шығым
%
Күкірт қышқылының концентрациясы 70 - 150 г/л арасында өзгертілді. Ток бойынша шығым 149, 2% деін артты. Нәтижені графикке түрінде көрсеттік:
GRAFK
Осыдан кейін, темір электродынының Fe 3+ - иондарының түзілуінің ток бойынша шығымына электролиз ұзақтығының әсері
C(H 2 SO 4 ) = 150г/л; t = 25 ; ток тығыздығы 1200 А/м 2
Кесте- 2. 2
Электролиз ұзақтығы,
сағат
Ток бойынша шығым
%
Электролиз ұзақтығы 0, 5-4, 0сағат аралығында зерттелді, нәтижесінде ток бойынша шығым 148, 1% дейін артты. Алған нәтижелерімізді графикке салдық:
GRAFK
Келесі зерттеуді, темір электродынының Fe 3+ - иондарының түзілуінің ток бойынша шығымына ток тығыздығының әсерін зерттеуге жүргіздік.
C(H 2 SO 4 ) = 150г/л; t = 25 0 С
Кесте-2. 3
Ток тығыздығы
А/м 2
Ток бойынша шығым
%
Ток тығыздығы 400-1200 А/м 2 аралығында жүргіздік. Ток бойынша шығым 150, 6% дейін артты. Нәтижелерді графикке салдық:
ГРАФК
Ток бойынша шығымның 100% артық болу себебі темір электроды ең басында электрохимилық жолмен ериді, ал біраздан кейін химиялық жүреді. Ток бойынша шығымды есертегенде тек электрохимиялық еру ескерілді. Практикалық массаны өлшегенде әрі электрохимиялық еріген әрі химиялық еріген масса қатысады. Сол себептен практикалық масса көп болады.
2. 3 Темір аммонийлі ашудас синтезі
NH4Fe(SO4) 2·12H2O
Электролизден кейін ерітіндіде Fe 3+ - иондары және сульфат иондары бар. Сол себептен біз ерітіндіні темір-аммоний ашудасын алуға пайдаландық. Ол үшін келесі реакцияны негіз етіп алдық:
Fe 2 (SO 4 ) 3 + (NH 4 ) 2 SO 4 + 24H 2 O = 2NH 4 Fe(SO 4 ) 2 * 12H 2 O
Ол үшін, фарфор ыдыста электролизден кейінгі ерітіндіні буландырып алып, оған суда еріген аммоний сульфатының 10гр ерітіндісін қостық, шыны таяқшамен араластырдық. Ерітіндіні 0 0 -қа дейін суытқан кезде түзілген кристалдарды бөліп алып кептірдік.
2. 4 Темір электродының қасиеттерін поляризациялық қисықтар түсіру арқылы зерттеу.
Темір электроды өте көп зерттелген, дегенмен барлық уақытта бір-біріне сәйкес келетін нәтижелелер алу мүмкін бола бермейді. Жүргізілген зерттеу жұмыстарының нәтижелеріне шолу [84] еңбекте толық қамтылған.
рН мәндері әртүрлі ерітінділерде жүргізілген зерттеулер бірдей потенциал мәндерінде темірдің еру жылдамдығы аОН - мәнінің артуымен өсетіндігін болжауға мүмкіндік береді. [85] және [87] жұмыстарының нәтижелерін салыстыру арқылы мынадай қорытындыға келуге болады: бірдей ϕ мәндерінде (поляризациялық қисықтардың экстраполяциясынан табылған) еру жылдамдығы 2, 0 н. NaOH ерітіндісінде өлшенір отырған жағдайда анодты ток 1, 0 н. НСІ ерітіндісімен салыстырғанда 10 4 есе жоғары. жұмыста темірдің анодтық кернеуі қышқыл ерітінділерде де рН мәнінің өсуіне тәуелді артады. Ерітіндінің рН мәнінің әсері және Тафель сызығынан анықталған бұрыштық коэффициенті b туралы алынған эксперименттік мәліметтерді түсіндіруде ОН - иондары темірдің еру реакциясына белсенді қатысады деп болжауға болады. Бұл болжаммен келісу қиын, өйткені қышқыл ерітінділерде аОН - мәні өте төмен. Сондықтан аОН - мәнінің электродқа жақындығы ерітінді көлемімен салыстырғанда жоғары деп қабылдау қажет, өйткені ол темірдің бетінде судың диссоциациялануы нәтижесінде пайда болады.
Темірдің анодты еруін [88] зерттеу негізінде мынадай кинетикалық схема ұсынылған:
І-саты: Ғе + ОН - = Ғе(ОН) адс + е
ІІ-саты: Ғе(ОН) адс + Ғе = ҒеҒе(ОН) адс
ІІІ-саты: ҒеҒе(ОН) адс + ОН - = Ғе(ОН) адс + ҒеОН + + 2е
ІV-саты: ҒеОН + + Н + = Ғе 2+ + Н 2 О
2. 4. 1 Темір электродының анодтық поляризациялық қисығы.
Темір электродының анодтық поляризациялық қисығында оттек бөліну потенциалына дейін толқын түрінде бір ток максимумы байқалады. Ол максимум темірдің қышқылды ортада Fe 3+ ионына дейін тотығатынын көрсетеді.
Fe 0 - 3e →Fe 3+
Сонымен қатар, анодта оттек бөлінеді:
2H 2 O -4e → O 2 + 4H +
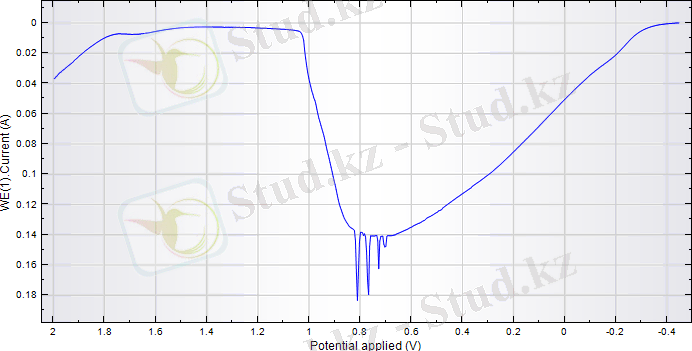
V=100мВ/с, t=25 0 С; С= 0, 05М H 2 SO 4 +0, 5М FeSO 4 ;
2. 1-сурет - Темір электродының анодты потенциодинамикалық поляризациялық қисығы
2. 4. 2Темір электродының катодтық поляризациялық қисығында
Темір электродының катодтық поляризациялық қисығында 2. 2 -сурет тек сутек бөліну байқалады.
2Н + + 2е →Н 2
2H 2 O → H 2 + 2OH -
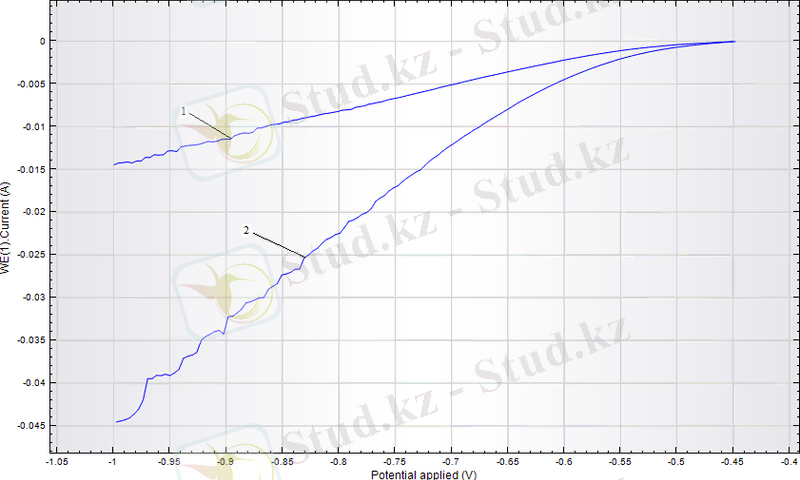
V=100мВ/с, t=25 0 С; 1) С= 0, 05М H 2 SO 4 ; 2) С= 0, 05М H 2 SO 4 +1М FeSO 4 ;
2. 2-сурет - Темір электродының катодты потенциодинамикалық поляризациялық қисығы
2. 4. 3 Темір электродының циклді поляризациялық қисықтары
Циклді потенциодинамикалық анод-катод және катод-анод бағытында поляризациялық қисықтар түсіру арқылы темір электродының күкірт қышқылы ерітіндісінде электрохимиялық күйі зерттелінді. Темірдің анодта еруі -491мB потенциалында орын алады және бұл жерде екі валентті темір иондары түзіледі. 2. 3-сурет. Электрод потенциалының катодқа қарай жылжуы кезінде екі вадентті темірдің үш валенттіге дейін тотығу тоғы байқалмады. Минус 600мВ потенциалынан бастап сутегі иондарының тотықсыздану тоғы поляграммада тіркеледі.
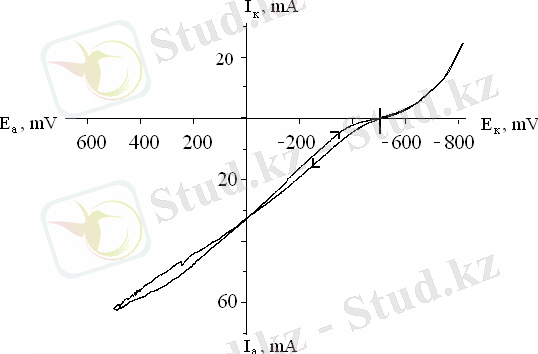
t - 25 0 С, V - 25 mV/s, H 2 SO 4 - 0, 5моль/л
Сурет 2. 3- Темір электродының циклді анодты - катодты поляризациялық қисықтары
Потенциалдың жылжуы катодқа қарай бағытталған кезде де қисықтың жүру жолы қайталанылады, «минус» 490 мВ потенциалында сутегі иондарының тотықсыздануы нәтижесінде катодтық ток пайда болады. 2. 4- суреттегі катодты - анодты поляризациялық қисықтың сипаттамасы жоғарыда айтылған қисықтан айырмашылығы жоқ.
Айта кету керек, Fe - 2е ↔︎ Fe 2+ реакциясы үшін стандарттық потенциал «минус» 440 мВ-қа тең болса, ал Fe- 3е ↔︎ Fe 3+ реакциясы үшін «минус» 360 мВ-қа тең болу керек. Бірақ, іс - жүзінде өлшеген потенциал тепе - теңдік потенциалынан едәуір айырмашылығы болады. Оның себебі, оттегінің немесе басқа да тотықтырғыштардың қатысында темір металы пассивацияға ұшырайды және потенциалдың мәніне де өз әсерін тигізіп, стационарлы потенциал «плюс» аймағына жылжиды. Минералды қышқыл ерітінділерінен басқа, көптеген ерітінді орталарда темірдің коррозиясы кезінде ерімейтін өнім тат пайда болады. Темірдің анодты процесі кезінде Fe 2+ ионы түзілсе, ал нейтралды ортада Fe(OH) 2 түзіледі. Ерітіндінің құрамында О 2 болған жағдайда темірдің үш валентті гидроксиді - Fe(OH) 3 түзіле алады.
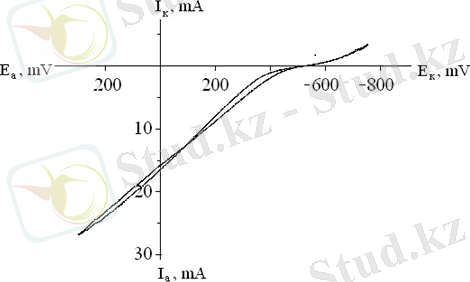
t - 25 0 С, V - 25 mV/s, H 2 SO 4 - 0, 5моль/л
Сурет 2. 4 -темір электродының циклді катодты - анодты поляризациялық қисығы
Темірдің пассивтілік қабілеті туралы Ломоносов және Фарадей еңбектерінде жазылған. Ерітіндінің концентрациясы жоғарылаған сайын коррозия жылдамдығы күрт төмендейді, соның салдарынан темір металы пассивтеледі. Бірақ, металдық жылтырын жоғалтпайды және пассивтелген темірде анодты оттегінің бөлінуі мүмкін.
Металдың пассивті жағдайын түсіндіретін екі теория бар. Пассивтіліктің бірінші теориясы, оттегінің адсорбциясымен байланысты, адсорбцияланған оттегі атомдары металдың беткі қабатында жаппай мономолекулярлы қабат түзеді немесе металдың ең активті беткі қабатын жауып металды пассивтейді [89-90] .
Металдың анодта еруінде адсорбция процесі маңызды роль атқарады. Металл атомының ерітіндіге ион түрінде өтуі тотығу процесінің бір ізді стадиялардан тұруын қарастыруға болады. Бұл жерде адсорбция процесі қатысады. Иондардың адсорбциясы еру процесін жеделдетеді. Сонымен қатар, адсорбция қос қабаттың құрылысын өзгертеді, соның салдарынан электродтағы реакция жылдамдығына әсер етуі мүмкін.
Темірдің анодты еру процесіне ОН - иондарының адсорбциясы үлкен роль атқарады [91] .
Су молекуласының және ОН - иондарының адсорбциясы металдың беткі қабатында хемсорбциялық оттегі және металдың пассивациясын тудыруы мүмкін.
Көптеген зерттеуші ғалымдар металдың пассивтілігін фазалық оксидтік қабаттың пайда болуымен түсіндіреді. Осыдан сулы ерітіндідегі пассивті металдар оттегінің мономолекулярлы қабаты, яғни оксидтік қабатпен қапталатындығы туралы болжайды. Кейбір жағдайларда алғашқы мономолекулярлы қабат пайда болғаннан кейін оксидтік қабаттың түзілетіндігін болжам жасайды.
Темір электроды оңай поляризацияланады және басқа қатты металдар сияқты электродтың беткі қабатында түрлі металл қосылыстарының потенциалдарының үлкен өзгерісіне әкелуі мүмкін кернеу туғызады.
Металдың пассивтелуі көпшілік жағдайда металдың табиғатына және ерітінді құрамындағы аниондардың концентрациясына байланысты болып келеді.
Темірдің қышқыл ерітінділерде анодты поляризациялық қисығын көптеген зерттеу жұмыстары жүргізілген және көп жағдайда электролит ретінде 1Н күкірт қышқылы қолданылады [92-94] .
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz