Негіздер (бейорганикалық гидроксидтер): Бронстед пен Льюистің теориялары, физико-химиялық қасиеттері, алынуы және қолданылуы


Мазмұны.
Кіріспе.
1 тарау. Негіздер туралы түсінік бейорганикалық қосылыстар класы ретінде. Дж. Бронстед пен Г. Льюис теорияларындағы негіздер.
2 тарау. Негіздердің физикалық қасиеттері.
- Негіздердің физикалық қасиеттері.
- Судағы ерігіштік, ерігіштік өнімі.
- Еритін негіздердің диссоциация константасы.
3-тарау. Негіздерді алудың негізгі әдістері.
- Негіздерді алудың зертханалық әдістері.
- Негіздер алудың өндірістік әдістері.
4 тарау. Химиялық қасиеттері.
- Қышқылдармен әрекеттесу. Бейтараптандыру реакциясы.
- Қышқыл оксидтермен әрекеттесу.
- Амфотерлі гидроксидтер, сілтілік металдар гидроксидтерімен әрекеттесу.
- Суда ерімейтін негіздердің термиялық ыдырауы.
5-тарау. Химия мен өндірісте негіздерді қолдану.
Қорытынды.
Пайдаланылған әдебиеттер тізімі
Кіріспе
Химия біздің өмірімізге жаңа материалдармен, өнімдермен, дәрі-дәрмектермен, синтетикалық талшықтармен, пластмассалармен бірге мықты кірді. Әлемде жаңа заттар мен химия теориялары, заттардың процестері мен қасиеттері туралы ақпарат көбірек. Сондықтан басты міндет - ақпарат пен білімді жүйелеу және жіктеу.
Бұл жұмыста негіздердің құрылымын және олардың қасиеттерін сипаттайтын теорияларды, олардың негізгі физикалық-химиялық қасиеттерін, өндірісі мен күнделікті өмірде және өндірісте қолданылуын қарастырамыз. Эссенің міндеті осы заттар тобы туралы білімдер мен материалдарды жүйелейді, бұл логикалық ойлауды дамытуға ықпал етеді, заттардың қасиеттері мен қолдану салалары арасындағы себеп-салдарлық байланыстарды көру дағдылары мен дағдыларын дамытады.
Негіздер - ұқсас химиялық құрылымымен сипатталатын және химиялық қасиеттері ұқсас бейорганикалық қосылыстардың үлкен класы. Олардың молекулаларында бірнеше гидроксил топтары бар, сол себепті бұл заттар гидроксидтер деп аталады. Гидроксидтерді зерттеу көрсеткендей, бұл бейорганикалық заттар класы біздің өмірімізде кеңінен қолданылады, біз оларды және олардың негізінде жасалған өнімдерді күн сайын жиі қолданамыз және бұл туралы білмейміз.
1 тарау. Негіздер туралы түсінік бейорганикалық қосылыстар класы ретінде. Дж. Бронстед пен Г. Льюис теорияларындағы негіздер.
«Негіз» термині бастапқыда қышқылдармен реакциялар кезінде тұз түзетін заттарға тағайындалды. Негіздеріне көптеген металдардың гидроксидтері (Ca (OH) 2,
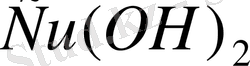 ,
,
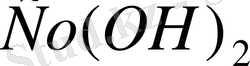 ,
,
 ,
,
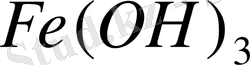 ) .
) .
NaOH, KOH, LiOH сияқты негіздердің сулы ерітінділері қатты сілтілі қасиетке ие, сондықтан бұл заттар және басқалары сілтілер деп аталады.
Негіздемелер [1, ст. 40 - 41], электролиттік диссоциация теориясы тұрғысынан олар аниондардың бір түрі - гидроксид - иондарының түзілуімен ерітіндіде диссоциацияланатын заттарды атайды
 . . .
. . .
Жалпы жағдайда негіздің электролиттік диссоциациясының теңдеуі:
Диссоциацияның мысалы келесі теңдеулер бола алады:
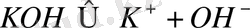
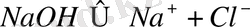
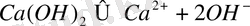
Кейбір сілтілер еріген кезде ұқсас диссоциацияланады:
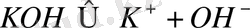
Гидроксидтердің атаулары «гидроксид» сөзінен және элементтің генетикалық жағдайдағы орысша атауынан тұрады, қажет болған жағдайда элементтің тотығу дәрежесін көрсетеді (жақшаға римдік сандармен) . Мысалы, LiOH - литий гидроксиді,
 - темір (II) гидроксиді,
- темір (II) гидроксиді,
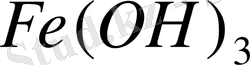 - темір гидроксиді (III) .
- темір гидроксиді (III) .
Бірақ металды гидроксидтер ғана емес, сонымен қатар гидроксидтер қатарына жатқызуға болмайтын басқа да заттардың негізгі қасиеттеріне ие, мысалы, NH3, BF3. Сонымен қатар, көптеген химиялық процестер сулы ортада емес, электролиттік диссоциация теориясы мүлдем қолданылмайтын сулы емес еріткіштер ортасында (бензол, пиридин) жүруі мүмкін. Қышқылдар мен негіздер бір-бірімен иондарға бөлінбей реакция жасай алады. Сонымен, тек молекулалардан тұратын хлорсутек сутегі сусыз негіздермен оңай әрекеттеседі. Бұл фактілер жоғарыда келтірілген фактілерді түсіндіре алатын қышқылдар мен негіздер теориясының қажеттілігін көрсетті.
Протонның бос күйінде болмайтындығының дәлелі «қышқыл» ұғымын қайта қарауды қажет етті, сонымен қатар ерітіндідегі еріткіштің рөлін анықтау қажет болды.
1923 жылы қышқылдар мен негіздердің екі жаңа теориясы пайда болды: дат химигі Дж. Бронстед, оны ағылшын химигі Лаури мен Г. Льюис толықтырды.
Бронстедтің теориясы протон деп аталады. Теория протон деп аталады, өйткені қышқыл мен негіз ұғымдарын анықтаудағы негізгі рөл онда қарапайым протеин түріндегі сутегі катионы - қарапайым химиялық бөлшек Н + - ге бөлінеді.
Протондық теорияға сәйкес:
Қышқыл - құрамында сутегі бар бөлшектер (молекулалар немесе иондар) протондарын бере алатын зат.
Негіз - бұл бөлшектер (молекулалар, иондар) қышқылдардан протондарды қабылдауға қабілетті зат.
Осылайша, қышқыл протон доноры болып табылады:
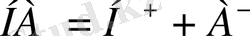 , ал негізі протон акцепторы болып табылады:
, ал негізі протон акцепторы болып табылады:
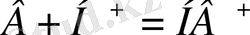 , мұндағы HA - қышқылдың жалпы формуласы, B - негіздің жалпы формуласы.
, мұндағы HA - қышқылдың жалпы формуласы, B - негіздің жалпы формуласы.
Протон алмасу арқылы байланысқан қышқыл мен негізді конъюгацияланған қышқыл-негіз жұбы деп атайды. Заттың қышқылдық қасиеті тек протон акцепторының қатысуымен, ал басты қасиеті - протон донорының қатысуымен көрінеді. Протондарды бере алатын немесе ала алатын заттарды бір ұғым - протолиттер біріктіреді. Кез-келген қышқылдың негізбен әрекеттесуі кезінде Дж. Бронстедтің пікірінше [8, ст. 51 - 55], протолитикалық тепе-теңдік күйімен сипатталатын протолитикалық реакция байқалады. Бұл тепе-теңдік термодинамика заңдарына сәйкес әрдайым әлсіз протолиттерді өндіруге қарай ауысады.
Кейбір жағдайларда протондардан бас тарта алатын, ал басқаларында протондарды алатын протолиттерді амфолиттер деп атайды. Сонымен, амфолиттер бір уақытта протондардың доноры және акцепторы бола алады.
Протондық теорияға сәйкес су өзіне қатысты амфолитке жатады:
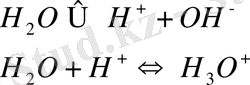
бұл судың автопротолиз ағымын түсіндіреді:
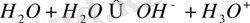 . . . Судың автопротолизі сандық тұрғыдан судың иондық өнімімен сипатталады:
. . . Судың автопротолизі сандық тұрғыдан судың иондық өнімімен сипатталады:
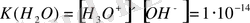 25 ° C температурада K мәні аз және судың автопротолизінің төмен дәрежесін көрсетеді.
25 ° C температурада K мәні аз және судың автопротолизінің төмен дәрежесін көрсетеді.
Су ерітіндісіндегі протолиттер әртүрлі дәрежеде протолизден өтеді. Осыған байланысты күшті және әлсіз протолиттер ажыратылады (күшті және әлсіз тотықтырғыштар мен сулы ерітіндідегі ұқсас) .
Күшті протолиттер (қышқылдар, негіздер) үлкен дәрежеде протолизден өтеді.
Әлсіз протолиттер (қышқылдар, негіздер) аз мөлшерде протолизден өтеді.
Протолиттердің абсолютті беріктігін олардың протонға жақындығын анықтау негізінен мүмкін, бірақ іс жүзінде оны жүзеге асыру қиын және күрделі өлшеу жабдықтарын қажет етеді. Протолиттердің салыстырмалы күшін білу жеткілікті (белгілі бір стандартқа қатысты) . Протолиттердің сулы ерітінділері үшін қышқылдылық пен негіздіктің осындай нормасы еріткіш - су болып табылады.
Су ерітіндісіндегі протолиттердің салыстырмалы беріктігінің өлшемі pKk мәні болып табылады. PKk анықтамасына сәйкес:
- әлсіз қышқыл - протолит неғұрлым күшті болса, сәйкес коньюгацияланған жұптың pKk мәні неғұрлым төмен болса;
- әлсіз негіз протолит неғұрлым күшті болса, сәйкес коньюгацияланған жұптың pKk мәні соғұрлым жоғары болады.
А13 + • Н2О + Н2О = А1ОН2 + + Н3О-
Бронстед бойынша әлсіз негіздер - бұл әлсіз қышқылдармен біріктірілген және құрамында өз протондары жоқ аниондар:
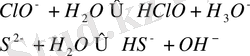
Сияқты көптеген гидробиондар
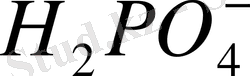 ,
,
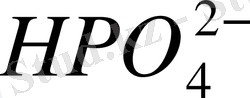 ,
,
 ,
,
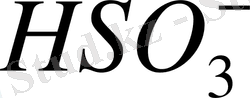 сулы ерітіндіде амфолиттер болады. Олардың протолизі шамалы дәрежеде жүреді және екі реакциядан тұрады, оның бірінде реактив әлсіз қышқыл, ал екіншісінде негіз рөлін атқарады.
сулы ерітіндіде амфолиттер болады. Олардың протолизі шамалы дәрежеде жүреді және екі реакциядан тұрады, оның бірінде реактив әлсіз қышқыл, ал екіншісінде негіз рөлін атқарады.
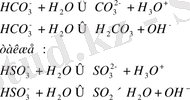
Be (OH) 2, Zn (OH) 2, A1 (OH) 3 және Cr (OH) 3 сияқты амфотерлі гидроксидтер де суға қатысты амфолиттер болып табылады. Олар суда аз ериді; олардың ерітіндіге түсетін бөлігі тез гидратталады (шартты түрде бір су молекуласымен, мысалы, A1 (OH) 3 × H2O) және екі қатар жүретін протолиз реакцияларына кіреді (қышқыл және негіз ретінде) :
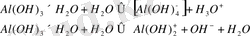
Қышқылдар мен негіздерді Бронстед бойынша анықтау көптеген химиялық реакцияларды жүйелеуге мүмкіндік береді. Ең алдымен, бұл Аррениустың пікірінше тұздардың бейтараптандырылуы және гидролизі ретінде қарастырылатын реакцияларға қатысты (1, 146 - 161 б. ) . Бронстедті бейтараптандыру реакциясы - бұл судың автопротолизіне кері әсерін тигізеді, ал соңғысы аз дәрежеде жүретін болғандықтан, бейтараптандыру реакциясы соңына дейін іс жүзінде қайтымсыз болып шығады.
Су ерітіндісіндегі эквимолярлы HC1 мен NaOH арасындағы бейтараптандыру реакциясын қарастырайық, ол келесі процестермен сипатталады:
протолиз
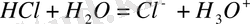
электролиттік диссоциация
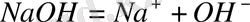
бейтараптандыру
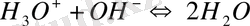
Бронстедтің айтуы бойынша NaOH негіз емес (Аррениус теориясындағыдай), тек су ерітіндісіндегі OH- иондарының көзі ретінде қызмет етеді (иондардың өзі ең мықты негіз) .
Г. Льюис теориясында қышқылдар мен негіздердің табиғаты және олардың диссоциациясы туралы неғұрлым жалпы түсінік бар. Ол қышқылды жұп электронның акцепторы, ал негізді электрон жұбының доноры ретінде тағайындады. Г. Льюистің теориясы бойынша қышқыл-негіз реакциялары - бұл негіз молекуласының электрондардың бөлінбеген жұбы қышқыл молекуласына қосылатын өзара әрекеттесу, нәтижесінде ковалентті байланыс пайда болады. Қышқылдың өзара әрекеттесуі (
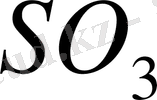 ) және Н2SO4 алу үшін негізді (Н2О) 1-суретте көрсетілген схемамен ұсынуға болады.
) және Н2SO4 алу үшін негізді (Н2О) 1-суретте көрсетілген схемамен ұсынуға болады.
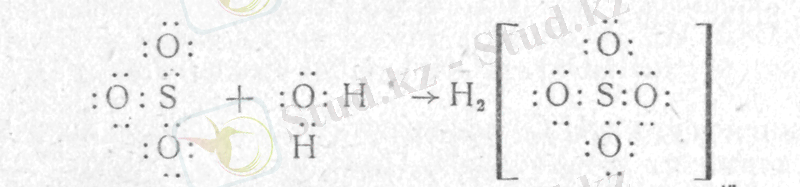
Сурет: 1.
Г. Льюис теориясы органикалық реакциялардың жүру механизмін түсіндіру үшін өте ыңғайлы. Бірақ қышқыл мен негіздің өзара әрекеттесуінің табиғатын түсіндіру үшін Бронстедтің теориясын қолданған жөн.
Бронстедтің теориясын Н. А. Измайлов, сонымен қатар оның шәкірттері В. В. Александров, В. Д. Безугли дамытты және толықтырды. М. И. Усанович ұсынған қышқылдар мен негіздер теориясы әмбебап.
2 тарау. Негіздердің физикалық қасиеттері.
Негіздердің жалпыланған физикалық қасиеттерін, олардың агрегаттық күйін, суда және басқа еріткіштерде ерігіштігін, түсін, электр өткізгіштігін, тығыздығын және басқа параметрлерін қарастырайық. Бұл параметрлер гидроксидтердің өндірісте қолданылуын одан әрі болжауға, олардың физикалық және химиялық қасиеттерін байланыстыруға мүмкіндік береді.
- Негіздердің физикалық қасиеттері.
Сілтілер (натрий, калий, литий гидроксидтері) қатты, ақ, өте гигроскопиялық кристалдар түзеді. Балқу температурасы
 322 ° C, KOH 405 ° C, а
322 ° C, KOH 405 ° C, а
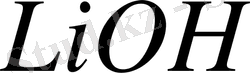 473 ° C. Калий гидроксиді кристалдық торы кубты, мысалы NaCl, ал калий гидроксиді тетрагональды.
473 ° C. Калий гидроксиді кристалдық торы кубты, мысалы NaCl, ал калий гидроксиді тетрагональды.
Кальций, магний, берилий, барий гидроксиді ақ ұнтақтарды құрайды, сонымен қатар гигроскопиялық, бірақ сілтілікіндей көп емес. Олар алты бұрышты кристалды тор құрайды, олардың балқу температуралары оксидке және суға ыдырауға байланысты жоғары емес.
Басқа металдардың гидроксидтері (алюминий, мыс, мырыш және т. б. ) әр түрлі түсті, көбінесе ақ түсті тұнба түзеді. Түсті гидроксидтер эмаль мен жылтыр өндірісінде пигменттер ретінде қолданылады.
- Судағы ерігіштік, ерігіштік өнімі.
Тек сілтілер суда жақсы ериді, екінші топтағы металдардың негізінен (негізгі топшаға) қарағанда әлдеқайда аз, ал қалғандары іс жүзінде суда ерімейді.
1 литрдегі қалыпты жағдай үшін. су 494 г КОНды ерітеді. Литий гидроксиді суда сілтілік металдардың басқа гидроксидтеріне қарағанда әлдеқайда нашар ериді. 0 ° C температурада 1 литрде. су 109 г ериді
 . . .
. . .
Суда еритін электролиттердің ерігіштігін сипаттау үшін PR-дің ерігіштік өнімі туралы түсінік енгізілген. Ол қаныққан сулы ерітіндідегі осы заттың катиондары мен аниондарының тепе-теңдік молярлық концентрациясының көбейтіндісіне тең. Мысал ретінде марганец гидроксидін пайдаланып ерігіштік өнімін қарастырайық.
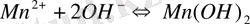 , PR = 2, 3 × 10-13
, PR = 2, 3 × 10-13
заттың ерігіштігі:
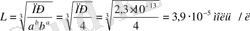
Ерігіштік өнімін пайдаланып, ерітіндідегі иондардың концентрациясының мәндерін есептеуге болады. Көптеген суда еритін негіздердің ерігіштік өнімдерінің мәндері 1-кестеде келтірілген (мұндағы pPR = -lg PR) .
Кесте 1. Негізде еритін өнімдердің мәндері.
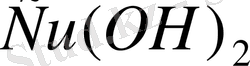
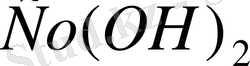
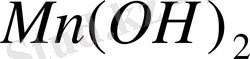


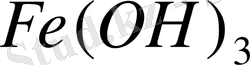

Ерігіштік өнімдерінің мәні аналитикалық химия мен токсикологиядағы химиялық есептеулерде кеңінен қолданылады.
- Еритін негіздердің диссоциация константасы.
Алдыңғы бөлімнен гидроксидтердің көпшілігі қалыпты жағдайда суда ерімейтіндігін көруге болады. Д. И. Менделеевтің химиялық элементтерінің периодтық жүйесінің негізгі топшасы, екінші топтағы сілтілер мен гидроксидтер ғана суда немесе басқа дәрежеде ериді.
Сулы ерітінділерде гидроксидтер иондарға диссоциацияланады. Натрий гидроксидінің диссоциациялануын қарастырыңыз:
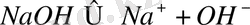 , басқа гидроксидтер де диссоциацияланады:
, басқа гидроксидтер де диссоциацияланады:
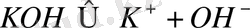
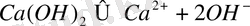
Судағы ерітінділерде сілтілер толығымен диссоциацияланады, ал барий, кальций, магний гидроксидтері белгілі дәрежеде ғана диссоциацияланады.
Электролиттің диссоциациялану өлшемін білдіру үшін диссоциациялану дәрежесі туралы түсінік [1, ст. 228 - 232] . Электролиттің диссоциациялану дәрежесі деп оның белгілі бір ерітіндідегі иондарға айналған молекулаларының санының ерітіндідегі оның молекулаларының жалпы санына қатынасын айтады. Ерітіндідегі әлсіз электролиттер ішінара диссоциацияланып, диссоциацияланбаған молекулалар мен иондар арасында динамикалық тепе-теңдік орнайды. Осы тепе-теңдікке химиялық кинетика заңдарын қолдануға болады және диссоциация константасын жазуға болады:
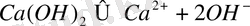
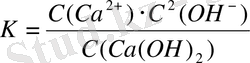
Диссоциация тұрақтылығы әртүрлі электролиттердің күштерін бір-бірімен салыстыра отырып, ерітіндінің рН-ын есептеуге мүмкіндік береді. Кейбір негіздердің диссоциация тұрақтыларының мәндері 2-кестеде көрсетілген.
Кесте 2. Негіздердің диссоциация тұрақтыларының мәндері.
Химиядағы ортаның қышқылдығы немесе сілтілігінің өлшемін білдіру үшін рН ұғымы қолданылады.
Күшті электролиттер үшін ол мыналарға тең:
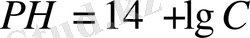 , мұндағы C - базаның молярлық концентрациясы. Әлсіз негіздер үшін келесі формула қабылданады:
, мұндағы C - базаның молярлық концентрациясы. Әлсіз негіздер үшін келесі формула қабылданады:
 қайда
қайда
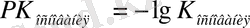 , содан кейін ортаның рН мәні келесідей болады:
, содан кейін ортаның рН мәні келесідей болады:
 . . .
. . .
РН мәні, басқа химиялық заттар сияқты, көбінесе қоршаған ортаның температурасына байланысты.
3-тарау. Негіздерді алудың негізгі әдістері.
Негіздер химия мен өндірісте әр түрлі мақсаттарда қолданылады (5 тарауды қараңыз) . Сондықтан, оларды алу әдістерін білуіңіз керек. Негіздерді алудың барлық әдістері бір-бірінен тек алынған өнімнің массасымен ерекшеленетін өндірістік және зертханалық әдістерге бөлінеді. Зертханалық жағдайда аз мөлшерде заттар алынады, ал өнеркәсіптік масштабта олар жүздеген тоннада алынады. Сондықтан бұл әдістер бір-бірінен қолданылған реактивтер мен жабдықта, реакция температурасында және кірістілікте ерекшеленеді. Осы әдістерді толығырақ қарастырайық.
- Негіздерді алудың зертханалық әдістері.
Зертханалық жағдайда негіздер аз мөлшерде, жүзден екі жүз грамға дейінгі мөлшерде алынады. Кейде белгілі бір зертхананың затқа деген қажеттілігіне байланысты. Бірақ бұл шамалар шамалы. Химиялық-технологиялық зертханалардағы негіздерді тек өнеркәсіп үшін осы затты алу әдісі әзірленіп жатқан жағдайларда ғана өндіруге болады.
Зертханалық жағдайда гидроксидтерді алудың негізгі әдістерін қарастырайық.
Зертханада сілтілік метал гидроксидтерін алудың екі әдісі қолданылады. Біріншісі және ең қымбаты сілтілі металдардың сумен тікелей әрекеттесуі, нәтижесінде сілтілер пайда болады. Бұл әдісті NaOH, KOH, LiOH, Ca (OH) 2 алу үшін қолдануға болады.
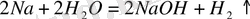
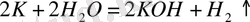
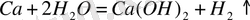
Бұл реакциялар белсенді металдарды: натрий, калий, литийді қолдануға байланысты өте қауіпті. Бұл реакцияларда сілтілік металдардың көп мөлшерін пайдалану мүмкін емес, олар өртеніп, тіпті жарылып кетуі мүмкін.
Натрий гидроксидін өндірудің оңайлатылған өнеркәсіптік әдістері зертханалық жағдайда қолданылуын тапты. Неліктен натрий гидроксиді? өйткені ол барлық гидроксидтердің ішінде химия мен өнеркәсіпте кеңінен қолданылады. Оны алу үшін электролиз әдісі қолданылады. Ағынды электролиз қондырғысының сызбасы 2-суретте көрсетілген.
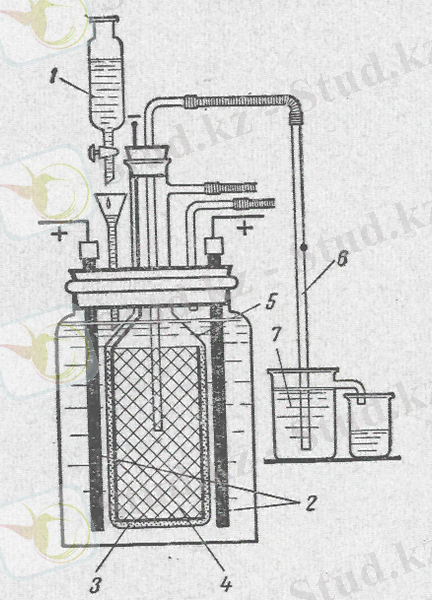 1 - шұңқырды натрий хлориді ерітіндісімен бөлу;
1 - шұңқырды натрий хлориді ерітіндісімен бөлу;
2018-04-21 121 2 - графитті анодтар;
3 - асбест картоннан жасалған диафрагма;
4 - түбі темірден немесе болат тордан жасалған цилиндр түріндегі катод;
5 - шыны қоңырау;
6 - катод кеңістігінен ерітіндіні ығыстыруға арналған сифон;
7 - сілтіні қабылдауға арналған стакан.
Сурет: 2018-04-21 121 2.
Ерітіндінің үстінен шығып тұрған графит анодтарының ұштарын электролит капиллярлар арқылы көтеріліп, мыспен жанасуды жоймас үшін балқытылған парафинмен сіңдіру керек. Мыс сымның графиттік анодпен жанасуы анодқа мықтап орнатылған мыс қақпағын қолдану арқылы немесе электродтың соңына жалаңашталған мыс сымды мықтап орау арқылы жүзеге асырылады. Темір немесе болат тор тор катод қызметін атқарады. Оның жоғарғы бөлігі сутегі анод кеңістігіне енбеуі үшін шыны қоңырауға мықтап енуі керек. Бұрын сумен суланған, өте аз мөлшерде силикат желімін қосатын асбест темір тордың сыртқы жағына шлам түрінде қойылады (қабат қалыңдығы 5-10мм) . Асбест құрғағаннан кейін диафрагманы электролитте берік ұстау үшін оны жеңіл күйдіруге болады.
Синтетикалық тұз қышқылын жасау үшін хлор мен сутекті қолдануға болады. Осы мақсатта олар оттыққа жіберіледі, ол силикагельмен толтырылған шыны тисса.
Электролизатордан ағып жатқан ерітінді фарфор ыдыста буланған. Кейде тұзды шөгіндіден сұйық бөлігін ағызып, булану аяқталғанға дейін температура 500 ° С-қа дейін жеткізіледі. Содан кейін сілтілі балқыманы салқындатады, ұсақтайды және тығыздалған шыны ыдыста сақтайды. Техникалық натрий гидроксидінің 35% ерітіндісін 5 ° C дейін салқындату арқылы керемет таза сілтілік алынады, бұл NaOH × 2H2O және NaOH × 4H2O кристалдарын ерітіндіден бөліп, күйдіреді.
Сол қондырғының көмегімен калий гидроксиді мен литий гидроксидін алуға болады. Осы қондырғыда сілтілерді алу кезінде ерекше сақ болу керек, өйткені электролиз өнімдерінің бірі хлор болады.
Натрий гидроксидін алу үшін кейде бұрынғы әдіс қолданылады - сода ерітіндісін сөндірілген әкпен қайнату:
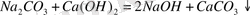
Реакция аяқталғаннан кейін ерітінді кальций карбонаты тұнбасынан құйылады және суды буландыру арқылы алынған натрий гидроксиді балқытылады.
Зертханаларда химиялық реакцияларды жүргізу үшін суда, ерімейтін гидроксидтерді, мысалы, мыс, мырыш, кобальт, кадмий, никель гидроксидтерін алу қажет. Оларды алу үшін осы металдардың еритін тұздарының натрий гидроксидімен әрекеттесу реакциясы қолданылады. Өзара әсер ету сипаты бойынша бұл реакция алмасу реакцияларына жатады.
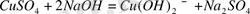
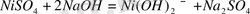
Мыс гидроксиді (көк) және никель гидроксиді (жасыл-көк) тұнбаға түседі. Ерітіндіні сүзіп, тұнбаны жуғаннан кейін оны химиялық процестерде қолдануға болады. Сонымен, мыс (II), мырыш, кобальт, кадмий, сынап (II), қалайы, қорғасын, марганец, титан, хром және басқа металдардың гидроксидтері алынады.
- Негіздер алудың өндірістік әдістері.
Жай негіздерді ғана емес, кез-келген химиялық өнімді алудың өндірістік әдістері көптеген әр түрлі факторларды ескереді, олардың ішінде реактивтердің болуы, тасымалдау кезінде олардың уыттылығы мен агрессивтілігі, өндіріс процесінің температурасы, катализаторларды қолдану қажеттілігі және қоспадан бөлінудің жеңілдігі. Сондықтан, негіздер алу үшін реагенттер қол жетімді және арзан болуы керек, улы емес, өндіріс процесінің температурасы қымбат емес ыстыққа төзімді және қышқылға төзімді резеңкелерді, төсемдерді қолданбай жасау үшін өте жоғары болмауы керек.
Өндірістік масштабта тек бірнеше гидроксидтер шығарылады: NaOH, ROH, LiOH. Олардың ішінде ең көп тарағаны - NaOH. Химия өндірісінде NaOH натрий гидроксиді алу әдістерін қарастырайық.
Химия өндірісінде натрий гидроксиді алу үшін электролиз қолданылады. Электролит - натрий хлориді (ас тұзы) ерітіндісі. Электролиз кезінде электролит ерітіндісі арқылы тұрақты электр тогы өтеді және электродтарда тотығу және тотықсыздану процестері жүреді.
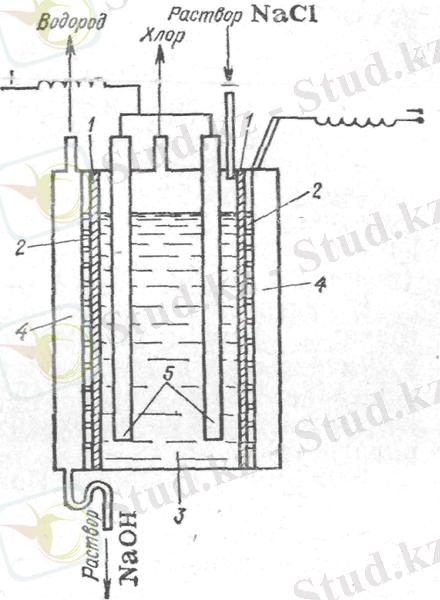 Натрий гидроксиді алу үшін натрий хлориді ерітіндісін электролиздеу екі жолмен жүзеге асырылады: темір катодында және сынап катодында. Жасанды графит екі жағдайда да анод қызметін атқарады. Натрий мен калий гидроксидтерін өнеркәсіптік өндіруге арналған қондырғы 3-суретте көрсетілген. Электролиз кезінде бірінші әдіс бойынша сутек катодта бөлініп шығады, ал сілтілік катод кеңістігінде жиналады. Анодта хлор және ішінара оттегі бөлінеді. Электродтардың реакция теңдеулері:
Натрий гидроксиді алу үшін натрий хлориді ерітіндісін электролиздеу екі жолмен жүзеге асырылады: темір катодында және сынап катодында. Жасанды графит екі жағдайда да анод қызметін атқарады. Натрий мен калий гидроксидтерін өнеркәсіптік өндіруге арналған қондырғы 3-суретте көрсетілген. Электролиз кезінде бірінші әдіс бойынша сутек катодта бөлініп шығады, ал сілтілік катод кеңістігінде жиналады. Анодта хлор және ішінара оттегі бөлінеді. Электродтардың реакция теңдеулері:
катодта:

Сурет: 3. Анодта:
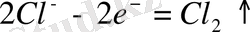
Жалпы электролиз теңдеуі:
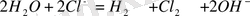
Екінші әдіс бойынша электролиз кезінде натрий сынап катодында азаяды. Натрийдің азаюы сутегі иондарының сынапқа түсуінің жоғары асқын кернеуі мен натрийдің металлургиялық қосылысының сынаппен түзілуіне байланысты мүмкін болады (металдардың сынаптағы ерітінділері әдетте амалгамалар деп аталады) . Сонымен қатар, натрийдің сынаптағы тотықсыздану әлеуеті қарсы - 1, 8 В дейін төмендейді
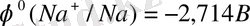 натрий туралы.
натрий туралы.
Электродтарда келесі реакциялар жүреді:
катодта:

анодта:
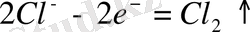
Сонда электролиз процесінің жалпы реакциясы:
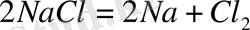
Содан кейін натрий амальгамасы сумен ыдырайды. Натрий сумен әрекеттесіп, сілтілік және сутекті түзеді, ал натрий гидроксиді жоғары тазалықта болады.
Электролиз үшін таза ас тұзы қолданылады. Ол сода әсерінен Ca2 + иондарынан және натрий гидроксиді әсерінен Mg2 + иондарынан алдын-ала тазартылады; кальций карбонаты мен магний гидроксидінің тұнбасы сүзіледі. Натрий хлоридінің қаныққан ерітіндісі (300 - 310 г / л тұз) электролизге 70 - 90 ° C әсер етеді. Мұндай концентрация мен температурада ерітіндінің электр өткізгіштігі жоғары, ал хлордың ерігіштігі аз (0, 25 г / л-ден көп емес), хлор иондарының разрядталуының шамадан тыс кернеуі, ал оттегі максималды болады. РН = 7 болғанда
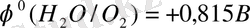 ,
,
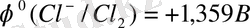 . . . Сондықтан анодты реакцияны электродта жүргізу керек, онда оттегінің асқын кернеуі хлорға қарағанда жоғары болады. Графит бұл талапқа сай келеді.
. . . Сондықтан анодты реакцияны электродта жүргізу керек, онда оттегінің асқын кернеуі хлорға қарағанда жоғары болады. Графит бұл талапқа сай келеді.
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz