10-сынып химиясы: атом құрылысы, квант сандары, изотоптар, радиоактивтік және периодтық заңдар - өзіндік жұмыс жоспары


Химия пәнінен қоғамдық- гуманитарлық бағыттағы 10 сынып оқушысы өзіндік жұмыс жоспары. I тоқсан
Қолданылатын оқулық . М. Қ. Оспанова; Қ. С. Аухадиева; Т. Г. Белоусова, Алматы:. Мектеп, 2019.
10 сынып. 1-бөлім
Сабақтың нөмірі: 1
Сабақтың тақырыбы: Атом құрылысының заманауи теориясы. Атомдағы электрон күйі және қозғалысы. Көрсетілім №1 «Атом құрылысы моделі»
1. Оқу мақсаты:
10. 1. 2. 1 атом құрылысының заманауи теориясын білу
10. 1. 2. 2 s, p, d, f орбитальдарының пішінін ажырату;
2. Конспект
 XIX ғасырдың соңына дейін атом жай заттардың ең кішкене бөлшегі және ол ары қарай бөлінбейді деп келді. ХІХ ғасырдың соңы мен ХХ ғасырдың басында атомдардың күрделі бөлшек және ары қарай бөліне алатындығын дәлелдейтін көптеген жаңалықтар ашылды:
XIX ғасырдың соңына дейін атом жай заттардың ең кішкене бөлшегі және ол ары қарай бөлінбейді деп келді. ХІХ ғасырдың соңы мен ХХ ғасырдың басында атомдардың күрделі бөлшек және ары қарай бөліне алатындығын дәлелдейтін көптеген жаңалықтар ашылды:
- Катодтық сәулелер; 2. Табиғи радиоактивтілік; 3. Ядро құрылысы
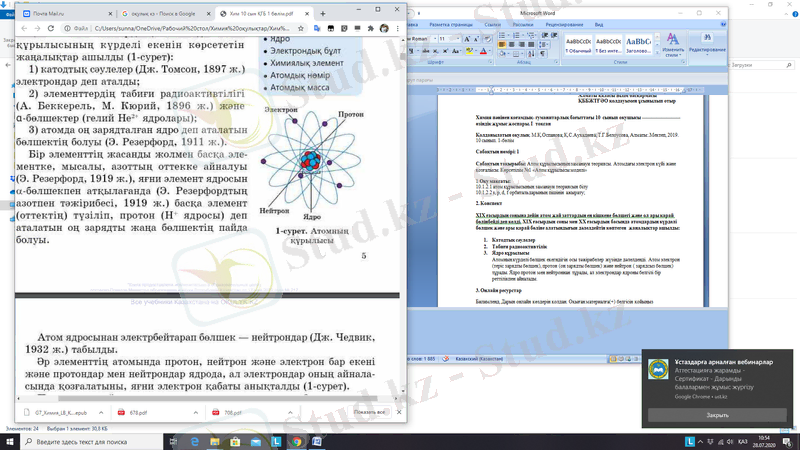
Атомның күрделі бөлшек екендігін осы тәжірибелер жүзінде дәлелденді. Атом электрон (теріс зарядты бөлшек), протон (оң зарядты бөлшек) және нейтрон ( зарядсыз бөлшек) тұрады. Ядро протон мен нейтроннан тұрады, ал электрондар ядроны белгілі бір реттілікпен айналады. Протон, электрон, нейтрон элементар бөлшек деп аталады, және олардың көлемдері мен массалары өте кішкентай болғандықтан, атомның көп бөлігі бос кеңістік болып табылады. Элементар бөлшектердің қасиеттерін оқулықтың 6 бетіндегі 1 кестеден көруге болады. Атом электробейтарап бөлшек, себебі ядрода қанша оң зарядты протон болса, ядроны сонша теріс зарядты электрон айналады. Атомдағы протондар Z, нейтрондар N, атомдық масса (нуклондық сан) А деп белгіленеді. A=N+Z Мысалы, көміртектің атомдық массасы 12, реттік номері 6, ол атомдағы электрондар мен протондар санын көрсетеді. Ал, енді нейтрондарды есептейік: N=A-Z=12-6=6. Осылайша нейтрондарды есептеуге болады. Электрондардың қозғалысы өте күрделі болып келеді. Ядро маңындағы электрон қозғалатын кеңістік электрондық бұлт, ал электронның болу аймағы атомдық орбиталь деп аталады. Атомның электрондық қауызы қабаттардан тұрады. Әр орбитальға электрондық бұлт сәйкес келеді және қозбаған күйде 4 түрлі типі бар: s, p, d, f. Бір орбитальда спиндері әртүрлі электрондар орналасады. Бір орбитальда тек 2 электрон сияды. Әр бір электрон бұлты өзіне тән пішіндерге ие. Мысалы: s шар тәрізді болса, p гантель тәрізді, ал қалған екеуі өте күрделі пішінге ие. Оқулықтың 8 бетіндегі 2 суретке қараңыз. Атомдар электрондарын беріп жіберіп оң ионға, ал электрондарын қосып алып, теріс зарядқа айналады. Бейтарап атомның зарядты бөлшекке айналуын иондану үдерісі деп аталады. Изотоп дегеніміз электрондар мен протондар саны бірдей, ал нейтрондар саны әртүрлі болатын элементтер. Мысалы көміртектің 12 ( ) және 13 ( ) деген изотоптары белгілі.
3. Онлайн ресурстар
1. https://www. youtube. com/watch?v=K-jNgq16jEY (нажмите CTRL и щелкните ссылку) осы сілтеме арқылы электрон бұлттарының 3D көрінісімен танысыңдар.
2. https://bilimland. kz/ немесе https://daryn. online/ сайтындағы видеоларды көріп, өзіңе қажетті материалдарды дәптеріңе көшіріп жаз.
4. Тапсырмалар
1. Атом электрон бергенде оң зарядқа, ал қосып алғанда теріс зарядқа айналады. Неліктен? Себебін түсіндіріңіз және жауабыңызды схемалар күйінде дәлелдеңіз.
2. Табиғи изотоптарға мысал келтіріңіз және олардың қолдану аймақтарын көрсетіңіз.
3. Алғашқы 10 элемент үшін реттік номерінің (х осіне) нейтрон санына (у осіне) тәуелділік графигін тұрғызыңдар. Бұл графиктен қандай қорытындығы келуге болады.
5. Кері байланыс:
тапсырманы орындап, жауабын Whats App, электронды почта арқылы жіберіңіз. Бұл тақырып бойынша сізге берілген мақсаттың қайсысы қиындық туғызды
Химия пәнінен қоғамдық- гуманитарлық бағыттағы 10 сынып оқушысы өзіндік жұмыс жоспары. I тоқсан
Қолданылатын оқулық . М. Қ. Оспанова; Қ. С. Аухадиева; Т. Г. Белоусова, Алматы:. Мектеп, 2019.
10 сынып. 1-бөлім
Сабақтың нөмірі: 2
Сабақтың тақырыбы: Квант саны. Паули принципі, Хунд ережесі, Клечковский ережесі.
1. Оқу мақсаты: 10. 1. 3. 1 квант сандарының сипаттамасы мен мәндерін білу;
2. Конспект
Белгілі бір электроннің кеңістікте орналасқандығы туралы ақпараттар жиынтығы атомдағы электронның күйін сипаттайды. Электронның атом кеңістігінде ең көп болуының аймағы атомдық орбиталь деп аталады. Атомдағы әр электронның күйін 4 квант санымен (бас квант саны (n), орбиталь квант саны (l), магниттік квант саны (m), спиндік квант саны (s) ) сипаттайды. Бас квант саны электронның энергетикалық деңгейін және атомдық орбиталдың мөлшерін анықтайды, оның мәні бүтін сандарға ие (бас квант саны периодтар санымен анықталды, мысалы екінші периодтың бас квант саны 2 ге тең) . Атомдағы энергетикалық деңгейлер саны элемент орналасқан периодд нөміріне тең. Бірдей бас квант санына ие болған электрондардың жиынтығы энергетикалық деңгей деп аталады, сол энергетикалық деңгейдегі электрондардың максималды саны N=2n 2 формуласымен анықталады. N- берілген энергетикалық деңгейдегі электрондар саны, n- период нөмері. Орбиталь квант саны (l) атомдық орбитальдың пішінін сипаттайды. Мысалы, n=2 тең болса, l=0, 1 деген мәндерді қабылдайды. l саны деңгейшені сипаттайды, және l сипатталатын электрондардың жиынтығы энергетикалық деңгейше деп аталады. l=0 болса, деңгейше s, l=1 болса, ол p, l=2 болса, ол d, l=3 болса, ол f деп белгіленеді. Деңгейдегі энергетикалық деңгейшелер саны бас квант санынан артық болмайды. Кітаптың 12 бетіндегі 3-10 суреттерге, 2-5 кестелерге назар аударыңыз. Деңгейшедегі орбитальдар саны магниттік квант санымен анықталады. Магниттік квант саны ядроның магнит өрісіндегі орбитальдардың таралуын сипаттайды. m=2l+1 формуласымен анықталады. l=0 болса m=0 деген мән қабылдайды, ал l=1 болса, ол -1, 0, 1 деген мәндерді қабылдайды. Спиндік квант саны электронның өз осінен сағат тілімен бірдей (+1/2) немесе оған қарсы (-1/2) бағытта айналуын көрсетеді. 4 квант саны бірдей 2 электрон болуы мүмкін емес, кем дегенде бір квант саны бойынша айырмашылық болады. Электрондардың қабаттар мен орбитальдарда таралып орналасу сызбанұсқасы атомның электрондық конфигурациясы деп аталады.
3. Онлайн ресурстар
1. https://www. youtube. com/watch?v=hiSU3AeXV3I (нажмите CTRL и щелкните ссылку) осы сілтеме арқылы квант сандары туралы кейбір мәліметтермен танысыңдар.
2. https://bilimland. kz/ немесе https://daryn. online/ сайтындағы видеоларды көріп, өзіңе қажетті материалдарды дәптеріңе көшіріп жаз.
4. Тапсырмалар
1. Бас квант саны нені сипаттайды және қандай мәндерге ие болады? Қандай әріптермен белгіленеді?
2. Орбиталь квант саны нені сипаттайды? Орбитальдық квант саны қандай мәндерге ие және олардың пішіндері қандай?
3. Магниттік квант мен спиндік квант саны нені сипаттайды және қандай мәндерге ие? Орбиталдардың шартты түрде белгіленуін көрсетіңіз?
4. Не себепті 4 квант саны бірдей 2 электрон кездеспейді? Себебін түсіндіріңіз?
5. Кері байланыс:
тапсырманы орындап, жауабын Whats App, электронды почта арқылы жіберіңіз. Бұл тақырып бойынша сізге берілген мақсаттың қайсысы қиындық туғызды
Химия пәнінен қоғамдық- гуманитарлық бағыттағы 10 сынып оқушысы өзіндік жұмыс жоспары. I тоқсан
Қолданылатын оқулық . М. Қ. Оспанова; Қ. С. Аухадиева; Т. Г. Белоусова, Алматы:. Мектеп, 2019.
10 сынып. 1-бөлім
Сабақтың нөмірі: 3
Сабақтың тақырыбы: Квант саны. Паули принципі, Хунд ережесі, Клечковский ережесі.
1. Оқу мақсаты: 10. 1. 3. 2 электрон орбитальдарын толтыру ережелерін: минимальді энергия принципі, Паули принципі, Хунд ережесін қолдану;
10. 1. 3. 3 алғашқы 36 химиялық элементтің электрондық конфигурациясын жазу;
2. Конспект. Атомның негізгі күйіндегі энергетикалық деңгейлер мен деңгейшелердің электрондармен толуы белгілі бір принциптер мен ережелерге бағынады . Паули принципі бойынша бір электрондық ұяшыққа спиндері қарама қарсы екі электрон ғана орналасады. Паули принципі белгілі бас квант санындағы электрондардың максималды саны N=2n 2 формуласымен анықталады және бастапқы 4 деңгейдегі электрондар саны 2, 8, 18, 32 ден артық болмауы керек. Гунд ережесі бойынша деңгейшелерде электрондар, алдымен бос орбитальдарды бір-бірден толтырады, содан кейін электрондар жұптасады. Клечковский ережесі:
1. Атомның негізгі күйінде электрондар орбитальдарды энергиялық деңгейінің өсу ретімен толтырады.
2. Алдымен энергиясы төмен орбитальдар толады. Орбитальдардың энергиясы мына қатарда артады: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7 p….
s- бір ұяшық болады, максималды 2 электрон сияды.
p- 3 ұяшық болады, максималды 6 электрон сияды.
d - 5 ұяшық болады, максимальды 10 электрон сияды.
f- 7 ұяшық болады, максимальды 14 электрон сияды.
Алғашқы 36 химиялық элементтың электрондарының орналасуы:
1s 1
1s 2
3. Онлайн ресурстар
1. https://www. youtube. com/watch?v=hiSU3AeXV3I (нажмите CTRL и щелкните ссылку) осы сілтеме арқылы ұяшықтарға электрондарды толтырудың графикалық түрімен танысыңдар.
2. https://bilimland. kz/ немесе https://daryn. online/ сайтындағы видеоларды көріп, өзіңе қажетті материалдарды дәптеріңе көшіріп жаз.
4. Тапсырмалар
1. Клечковский ережесін қолданып № 27, 30, 35, 38, 50 элемент атомдарының құрылысын жазыңыз.
2. 24 элементте байқалатын құбылыс тағы басқа қандай элементтерде байқалады? Бұл құбылыс не үшін байқалады физикалық және химиялық көхқарастармен түсіндіріп, жауабыңызды дәлелдеңіз.
5. Кері байланыс: тапсырманы орындап, жауабын Whats App, электронды почта арқылы жіберіңіз. Бұл тақырып бойынша сізге берілген мақсаттың қайсысы қиындық туғызды
Химия пәнінен қоғамдық- гуманитарлық бағыттағы 10 сынып оқушысы өзіндік жұмыс жоспары. I тоқсан
Қолданылатын оқулық . М. Қ. Оспанова; Қ. С. Аухадиева; Т. Г. Белоусова, Алматы:. Мектеп, 2019.
10 сынып. 1-бөлім
Сабақтың нөмірі: 4
Сабақтың тақырыбы: Изотоптар. Есеп шығару: «Құрамындағы химиялық элемент атомының массалық үлесі бойынша қосылыстың химиялық формуласын табу»
1. Оқу мақсаты: 10. 1. 2. 3 радиоактивтілік табиғатын және радиоактивті изотоптардың қолданылуын түсіндіру;
10. 1. 1. 1 құрамындағы химиялық элемент атомының массалық үлесі бойынша қосылыстың химиялық формуласын шығару
2. Конспект. Ядро зарядтары бірдей, ал массалары әртүрлі бір элемент атомының түрлері изотоптар деп аталады. Изотоптар бір-бірінен ядродағы нейтрондар саны бойынша айырмашылық болады. Табиғатта көптеген элементтер изотоптардың қоспасы түрінде кездеседі. Сутектердің изотоптарының атаулары ғана бар: протий ( ), дейтерий ( , тритий ( . 18 бетте 6 кестеде кейбір элементтердің изотоптары берілген. Химиялық элемент - бұл ядро зарядтары бірдей атомдардың жиынтығы.
1 есеп. Құрамы 88, 89 % оттек пен 11, 11 % сутектен тұратын заттың молекулалық формуласын табыңдар. Заттың гелий бойынша салыстырмалы тығыздығы 4, 5-ге тең.
Шешуі: 1. Салыстырмалы тығыздық бойынша заттың салыстырмалы молекулалық массасын Mr(H x O y ) есептейміз. : Mr=D He *Mr(He) = 4. 5*4=18
2. х және у қатынасын формуласы бойынша табамыз:
х:у = = = 11, 11: 5, 56= 2:1 (Ішіндегі ең кішісіне екеуінде бөлеміз - 5, 56 ға)
3. Қосылыстың формуласы Н 2 О
2 есеп. Бейорганикалық заттың құрамында 40 % кальций, 12 % көміртек және 48 % оттек кіреді, заттың формуласын табыңдар.
Шешуі: Эмпирикалық формуладағы кальций, көміртек және оттектің индекстерін x, y, z әріптерімен белгілейміз. Ca x C y O z . x, y, z мәндерінің қатынастарын табамыз:
x:y:z= =1:1:3 формуласы: СаСО 3
3 есеп. Бейорганикалық заттың құрамына 43, 4 % натрий, 11, 3 % көміртек және 45, 3 % оттек кіреді, заттың формуласын табыңдар.
Шешуі: Қосылыстың формуласын NaxCyOz деп белгілеуге болады. x, y, z мәндерінің қатынастарын табамыз:
x : y : z = = 1, 88 : 0, 94 : 2, 82. Алынған шамаларды бүтін санға айналдыру үшін олардың барлығын ең кішісіне бөлеміз:
x : y : z = = 2:1:3 Жауабы: Na 2 CO 3
3. Онлайн ресурстар
1. https://www. youtube. com/watch?v=4f37FlJd6YI (нажмите CTRL и щелкните ссылку) осы сілтеме арқылы химияда процент не үшін керектігін, сонымен қатар қосылыс құрамындағы элементтердің массалық үлестерін қалай табу керектігін және қосылыс құрамына кіретін элементтердің массалық үлестері берілген кезде, қосылыстың формуласын қалай құрастыруға болады, сол туралы кең көлемде мәлімет берілген.
2. https://bilimland. kz/ немесе https://daryn. online/ сайтындағы видеоларды көріп, өзіңе қажетті материалдарды дәптеріңе көшіріп жаз.
4. Тапсырмалар
1. Құрамында 14, 29 % сутек бар, көмірсутектің формуласын табыңдар. Заттың азот бойынша салыстырмалы тығыздығы 2-ге тең.
2. Көмірсутекте көміртектің массалық үлесі 87, 5 %, ал ауа бойынша салыстырмалы тығыздығы 3, 31-ге тең. Заттың формуласын табыңдар.
3. Көміртектің массалық үлесі 26, 67 %, сутек 2, 22 %, ал оттек 71, 11 %-ға тең, заттың молекулалық массасын табыңдар. Заттың қалыпты жағдайда салыстырмалы тығыздығы 4, 02-ге тең.
4. Табиғи және жасанды изотоптардың қолдану саласын анықтаңыздар.
5. Кері байланыс: тапсырманы орындап, жауабын Whats App, электронды почта арқылы жіберіңіз. Бұл тақырып бойынша сізге берілген мақсаттың қайсысы қиындық туғызды
Химия пәнінен қоғамдық- гуманитарлық бағыттағы 10 сынып оқушысы өзіндік жұмыс жоспары. I тоқсан
Қолданылатын оқулық . М. Қ. Оспанова; Қ. С. Аухадиева; Т. Г. Белоусова, Алматы:. Мектеп, 2019.
10 сынып. 1-бөлім
Сабақтың нөмірі: 5
Сабақтың тақырыбы: Радиоактивті заттар туралы түсінік. Ядролық реакциялар және олардың Қазақстанның энергетикалық потенциалындағы маңызы
1. Оқу мақсаты: 10. 2. 1. 8 радиоактивті заттар ұғымын білу;
10. 2. 1. 9 радиоактивті ыдырау типін білу және қарапайым ядролық реакциялар теңдеуін құра алу (α, β - , β + , γ ыдырау) ;
10. 2. 1. 10 Қазақстан энергетикалық потенциалында ядролық реакциялар мәнін түсіну;
2. Конспект
Радиоактивтілік - атом ядроларының өздігінен ыдырауы нәтижесінде бөлшектер ( ядролары), - бөлшектер (электрондардың), сондай-ақ электромагниттік сәулелердің (γ -кванттардың) бөліну құбылысы. Бір элемент атом ядросының екінші элементтің атом ядросына айналуы ядролық реакция деп аталады. Радиоактивті құбылыстар мен ядролық реакциялардң теңдеулерін жазғанда 2 ережеге сүйену керек.
- реакцияға түскен бөлшектердің массалық сандарының қосындысы алынған бөлшектердің массалық сандарының қосындысына тең.
- Бастапқы бөлшектердің зарядтарының қосындысы түзілген бөлшектердің зарядтарының қосындысына тең.
бөлшектер ( ядролары) ыдыраған кезде массалық сан 4 ке, ал заряды 2 ге кемиді:
- бөлшектер ыдырауда нейтрондардың біреуі протонға айналады, сондықтан ядро заряды 1-ге артады, ал массалық сан өзгеріссіз қалады:
γ кванттар - α- және β- ыдырау кезінде байқалады. Олар бөлініп шыққанда ядро заряды мен массалық сан өзгермейді.
3. Онлайн ресурстар
1. https://bilimland. kz/ немесе https://daryn. online/ сайтындағы видеоларды көріп, өзіңе қажетті материалдарды дәптеріңе көшіріп жаз.
4. Тапсырмалар
1. Ядролық реакциялардың Қазақстанның энергетикалық потенциалындағы маңызы
2. Табиғаттағы ядролық реакциялар
3. Жасанды ядролық реакциялардың маңызы мен қолданылуы.
4. Астатты 1940 жылы изотопын албфа бөлшектермен сәулелендіру арқылы алынды. Егер қозған висмут атомының ядросы екі нейтронды бөлсе, ядролық реакция барысында астаттың қандай изотопы түзіледі. Бұл ядролық реакциялардың теңдеуін жазыңдар.
5. Кері байланыс:
тапсырманы орындап, жауабын Whats App, электронды почта арқылы жіберіңіз. Бұл тақырып бойынша сізге берілген мақсаттың қайсысы қиындық туғызды
Химия пәнінен қоғамдық- гуманитарлық бағыттағы 10 сынып оқушысы өзіндік жұмыс жоспары. I тоқсан
Қолданылатын оқулық . М. Қ. Оспанова; Қ. С. Аухадиева; Т. Г. Белоусова, Алматы:. Мектеп, 2019.
10 сынып. 1-бөлім
Сабақтың нөмірі: 6
Сабақтың тақырыбы: Периодтық заң және периодтық жүйе атом құрылысы тұрғысынан. Атом валенттілігі және валенттілік мүмкіндігі. Атомның тотығу дәрежесі.
Негізгі топшада және периодта элемент қасиеттерінің периодты өзгеруі
1. Оқу мақсаты: 10. 2. 1. 1 периодтық заңның физикалық мәнін түсіндіру
10. 2. 1. 2 валенттілік және атомның тотығу дәрежесі ұғымдарының физикалық мәнін түсіндіру
2. Конспект
Элементтер мен олар түзетін жай және күрделі заттардың қасиеттері сол элементтердің атомдық массасына тәуелді болады.
Химиялық жлементтердің периодтық заңының қазіргі тұжырымдамасы: Химиялық элементтер мен олар түзетін жай және күрделі заттардың қасиеттері олардың атом ядроларының зарядтарына периодты түрде тәуелді болады. Периодтық кесте (ПС) периодтарға, қатарларға, топ пен топшаларға бөлінеді. Кез келген атомның атомдық нөмері, атомдық массасы, атауы, химиялық таңбасы болады. Периодтық жүйеде әр период сыртқы деңгейде 1 электроны бар сілтілік металдардан басталып, сыртқы деңгейінде 8 электроны бар инертті газдармен аяқталады. Жаңа энергетикалық деңгей жаңа периодтан басталады. Периодтық кестеде 14 s-элемент, 36 p-элемент, 40 d-элемент және 28 f-элемент бар. Бір топтың элементтеріне тән ортақ химиялық қасиеттер бар. Топтар негізгі және қосымша топтарға бөлінеді. Негізгі топшаларда s-және p-элементтер орналасса, ал қосымша топшада қалған элементтер орналасқан. Негізгі топшалардың нөмерлеріне сыртқы энергетикалық деңгейдегі электрондар саны сәйкес келеді. Ережеге сай элементтердің жоғары тотығу дәрежелері де топ нөміріне тең. Фтор ғана ерекше, оның тотығу дәрежесі -1 ге тең.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz