Су: молекулалық құрылымы, физика-химиялық қасиеттері, таралуы және тазарту әдістері


ҚАЗАҚСТАН РЕСПУБЛИКАСЫНЫҢ БІЛІМ ЖӘНЕ ҒЫЛЫМ МИНИСТРЛІГІ
СӘТБАЕВ УНИВЕРСИТЕТІ
Тау кен металлургия институты
“Металлургиялық процестер, жылутехникасы және арнайы материалдар технологиясы” кафедрасы

РЕФЕРАТ
Тақырыбы: Су
Орындалған
%
Оқытушы:Шаутенов Мэлс
Студент: Сейіжан Зарина
Мамандығы:Металлургия
Мазмұны
Кіріспе . . . 3
1. Жер планетасында судың таралуы . . 4
2. Судың құрамы. Судың изотоптық құрамы . 5
3. Су молекуласының құрылымы . . . 6
4. Су. Жалпы сипаттама. 6
5. Судың физикалық қасиеттері, олардың ауытқулары . . 8
6. Химиялық қасиет 12
7. Судың құрылымы 13
8. Су жағдайының диаграммасы . . 16
9. Тазарту әдістері . . 19
10. Суды қолдану . 21
Дистилденген су алу.
Суды тоқтатылған қатты заттардан және микроорганизмдерден тазарту
Қорытынды 22
Кіріспе
Біздің өміріміздегі су - ең көп таралған және кең таралған зат. Алайда, ғылыми тұрғыдан алғанда, бұл ең ерекше, жұмбақ сұйықтық. Онымен тек сұйық гелий ғана бәсекеге түсуі мүмкін. Бірақ сұйық гелийдің ерекше қасиеттері (мысалы, асқын сұйықтық) өте төмен температурада (абсолюттік нөлге жақын) пайда болады және нақты кванттық заңдарға байланысты. Сондықтан сұйық гелий экзотикалық зат болып табылады. Біздің ойымыздағы су - бұл барлық сұйықтықтардың прототипі және біз оны ең ерекше деп атаған кезде таңқаларлық. Бірақ судың ерекшелігі неде? Шындығында, оның кез-келген аномальды болмайтын қасиеттерін атауға қиын, яғни оның мінез-құлқы (температураның, қысымның және басқа факторлардың өзгеруіне байланысты) басқа сұйықтықтардың басым көпшілігімен айтарлықтай ерекшеленеді, онда бұл мінез-құлық ұқсас және оны жалпы физикалық принциптермен түсіндіруге болады. Бұл қарапайым, қалыпты сұйықтықтарға, мысалы, балқытылған металдар, сұйытылған асыл газдар (гелийден басқа), органикалық сұйықтықтар (олардың қоспасы болып табылатын бензин немесе спирттер) жатады. Көптеген химиялық реакцияларда, атап айтқанда биохимиялық реакцияларда судың маңызы зор. Алхимиктердің ежелгі ұстанымы - «денелер ерігенше жұмыс істемейді» - негізінен шындық. Адам мен жануарлар денелерінде бастапқы («жасөспірім») суды синтездей алады, оны тамақ өнімдері мен ұлпаларының өздері жану кезінде түзе алады. Мысалы, түйеде өркештің құрамындағы май тотығу арқылы 40 литр су шығара алады. Су мен тіршіліктің арасындағы байланыс соншалықты зор, тіпті В. И. Вернадскийге «өмірді қарастыруға, ерекше коллоидтық су жүйесі ретінде . . . табиғи сулардың ерекше патшалығы ретінде ». Су - бізге таныс және ерекше зат. Атақты кеңес ғалымы академик И. В. Петрянов өзінің су туралы ғылыми-көпшілік кітабын «Әлемдегі ең ерекше зат» деп атады. Ал биология ғылымдарының докторы Б. Ф. Сергеев өзінің «Көңіл көтеретін физиология» кітабын су туралы «Біздің планетаны құрған субстанция» деген тараудан бастады. Ғалымдар дұрыс айтады: жер бетінде біз үшін кәдімгі судан маңызды зат жоқ, сонымен бірге сол типтегі басқа зат жоқ, олардың қасиеттерінде көптеген қайшылықтар мен ауытқулар болады оның қасиеттері. Ал биология ғылымдарының докторы Б. Ф. Сергеев өзінің «Көңіл көтеретін физиология» кітабын су туралы «Біздің планетаны құрған субстанция» деген тараудан бастады. Ғалымдар дұрыс айтады: жер бетінде біз үшін кәдімгі судан маңызды зат жоқ, сонымен бірге сол типтегі басқа зат жоқ, олардың қасиеттерінде көптеген қайшылықтар мен ауытқулар болады оның қасиеттері. Ал биология ғылымдарының докторы Б. Ф. Сергеев өзінің «Көңіл көтеретін физиология» кітабын су туралы «Біздің планетаны құрған субстанция» деген тараудан бастады. Ғалымдар дұрыс айтады: жер бетінде біз үшін кәдімгі судан маңызды зат жоқ, сонымен бірге сол типтегі басқа зат жоқ, олардың қасиеттерінде көптеген қайшылықтар мен ауытқулар болады оның қасиеттері.
- Судың Жер планетасында таралуы
Табиғатта болу.
Су - жер бетіндегі ең көп таралған зат. Біздің планетаның беті 71% сумен жабылған. Бірақ бұл үлкен ресурстарды ішуге болмайды: Жердегі сулардың 97% -ы тұзды; тек 1% таза су; 2% - мұздықтар.
Су - барлық тіршілік иелері үшін ең маңызды тіршілік көзі. Су жануарлар мен өсімдіктерде кездеседі. Адам 70% судан тұрады (ал қияр қазірдің өзінде 97% құрайды) . Біздің планетамыздың ¾ дерлік бетін мұхиттар мен теңіздер алып жатыр. Қатты су - қар мен мұз - жердің 20% алып жатыр. 1 миллиард 386 миллион текше шақырымға тең Жердегі жалпы су көлемінің 1 миллиард 338 миллион текше шақырымы Дүниежүзілік мұхиттың тұзды суларына, ал тек 35 миллион текше шақырымы таза суларға келеді. Мұхиттық судың жалпы мөлшері жерді 2, 5 шақырымнан астам қабатпен жабуға жеткілікті болар еді. Жердің әрбір тұрғынына шамамен 0, 33 текше шақырым теңіз суы және 0, 008 текше шақырым таза су келеді. Бірақ қиындығы мынада: Жердегі тұщы судың басым көпшілігі осындай күйде, бұл адамдарға қол жетімділікті қиындатады. Тұщы судың шамамен 70% -ы полярлық елдердегі мұз қабаттарында және таулы мұздықтарда, 30% -ы жер асты сулы қабаттарында және барлық өзен арналарында бір уақытта тек 0, 006% таза су бар.
Су молекулалары жұлдызаралық кеңістіктен табылды. Су - бұл кометалардың бөлігі, Күн жүйесіндегі планеталардың көп бөлігі және олардың серіктері.
2. Судың құрамы.
1783 жылы 24 маусымда А. Лавуазье мен П. Лаплас өздерінің бір топ ғалымдарының қатысуымен суды оттек пен сутектен «жасады». Олар суды сутегі жануының өнімі ретінде алды (және оттегінің жану процесіне қатысуы - «отты AIR» сәл ертерек белгілі болды) . Бұл жағдайда түзілген судың салмағы жану реакциясына қатысатын сутегі мен оттегінің салмағына тең болды.
Міне, бір күні судың бекершіліктің элементі емес, күрделі зат екендігі, бірақ ұзақ және қиын жолдың осы айтулы күнге әкелгені, табиғат зерттеушілері қаншалықты қайғы-қасірет, көңілсіздіктер, қателіктер мен жеке трагедияларға тап болғандығы айқын болды. су ақыры өзінің табиғатын ашты.
Судың изотоптық құрамы
Суды немесе сутек оксидін түзетін сутек пен оттегінің атомдары әр түрлі массалық сандарға ие бола алады және бір-бірінен физикалық-химиялық қасиеттерімен ерекшеленеді, бірақ сонымен бірге атом ядроларының электр заряды бірдей, сондықтан олар бірдей орынды алады. элементтердің периодтық жүйесі . . . Бірдей химиялық элемент атомдарының бұл түрлері изотоптар деп аталады. Бес гидроген және бес оттегі белгілі. Рас, олардың екеуі (4H, 5H, 14O және 15O) радиоактивті және өте қысқа өмір сүреді. Мысалы, сутектің болу ұзақтығы -4-4 * 10-11 сек. Сутектің ең танымал изотоптары: проти 1Н (салыстырмалы атомдық массасы 1), дейтерий 2Н немесе D (салыстырмалы атомдық массасы 2) және тритий 3Н, немесе Т (салыстырмалы атомдық массасы 3), ең ауыр, бірақ әлсіз радиоактивті сутегі (оның жартылай шығарылу кезеңі 12, 3 жыл), ал оттегі изотоптары: 16O, 17O және 18O. Осы алты изотоп судың 18 изотоптық түрін құра алады: 1Н216О; 1НD16О; D216O; 1НT16О; DT16O; T2O16; 1H217O; 1HD17O; D217O; 1HT17O; DT17O; T217O; 1H218O; 1НD18О; D218O; 1HT18O; DT18O; T218O.
Жерде әрбір 6800 протиум атомына бір дейтерий атомы, ал жұлдызаралық кеңістікте 200 протий атомына бір дейтерий атомы келеді.
3. Су молекуласының құрылымы
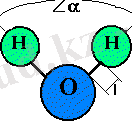
α = 104o27 '
l = 0, 96 ангстрема
A r (O) = 16 аму. жеу.
A r (H) = 1 a. жеу.
4. Су. Жалпы сипаттамасы.
Су молекуласы екі сутек атомынан (H) және бір оттегі атомынан (O) тұрады. Судың барлық алуан түрлі қасиеттері және олардың көрінуінің ерекше болуы, сайып келгенде, осы атомдардың физикалық табиғатымен және олардың молекулаға бірігуімен анықталады. Бөлек су молекуласында сутегі мен оттегі ядролары бір-біріне қатысты орналасады, олар жоғарыда оттегі ядросы салыстырмалы түрде үлкен, ал негізінде екі кішкентай сутек ядросы бар теңбүйірлі үшбұрыш жасайды. Су молекуласында зарядтардың төрт полюсі бар: электрондардың оттегі жұптарында электрон тығыздығының артық болуынан екі теріс және сутек ядролары - протондарда электрон тығыздығының жетіспеуінен екі оң. Суда электр зарядтарының таралуындағы бұл асимметрия айқын полярлық қасиеттерге ие болды;
Осыған байланысты су молекулалары электр өрісін бейтараптандыруға бейім. Оған батырылған заттардың бетіне су дипольдарының әсерінен атомаралық және молекулааралық күштер 80 есе әлсірейді. Барлық белгілі заттардың осындай жоғары диэлектрлік өтімділігі тек суға тән. Бұл оның әмбебап еріткіш болу мүмкіндігін түсіндіреді. Онымен байланысқан молекулалардың иондарға (мысалы, қышқыл тұздарына) ыдырауына көмектесу, судың өзі үлкен тұрақтылықты көрсетеді. 1 миллиард су молекуласының тек екеуі қарапайым температурада диссоциацияланады, ал протон бос күйде сақталмайды. , бірақ, мүмкін, гидроний ионының құрамына енеді. ( Гидроксоний (H3O +) - гидратталған сутек ионы; қышқылдардың сулы ерітінділерінде болады) .
Су еритін қосылыстардың көпшілігінің әсерінен химиялық өзгермейді және оларды өзгертпейді. Бұл оны инертті еріткіш ретінде сипаттайды, ол біздің планетамыздағы тірі организмдер үшін маңызды, өйткені олардың тіндеріне қажетті қоректік заттар сулы ерітінділермен салыстырмалы түрде тұрақты түрде жеткізіледі. Еріткіш ретінде су бірнеше рет қолданылады, оның құрылымында бұрын еріген заттардың жады сақталады. Су көлеміндегі молекулалар қарама-қарсы зарядтармен бірігеді, сутегі ядролары мен оттегінің жалғыз электрондары арасында молекулааралық сутектік байланыстар пайда болып, бір су молекуласының сутегінің электронды жетіспеушілігін қанықтырады және оны басқа молекуланың оттегіне қатысты бекітеді. Сутегі бұлтының тетраэдрлік бағыты әр су молекуласы үшін төрт сутектік байланыс түзуге мүмкіндік береді, соның арқасында төрт көршісімен байланыса алады. Бұл модельде центрді (О атомын) шыңдармен байланыстыратын әр жұп сызықтар арасындағы бұрыштар 109, 5 С құрайды.
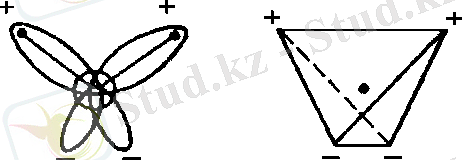
Сутегі байланыстары оттегі мен сутек атомдарын біріктіретін ковалентті байланыстарға қарағанда бірнеше есе әлсіз. Судың қуысы көп микромолекулалық құрылымы, сутегі байланыстарын үзу арқылы, олардың еруін жеңілдете отырып, басқа заттардың молекулаларын немесе молекулаларының бөліктерін бекітуге мүмкіндік береді. Суды - оттегі гидридін сол топшаға кіретін элементтердің гидридтерімен салыстыру. DI кезеңдік жүйесі Менделеев, су - 70 ° C-та қайнап, - 90 ° C-та қатуы керек деп күтуге болады. Бірақ қалыпты жағдайда су қатып қалады Белгіленген қалыптан осындай күрт ауытқу судың байланысты сұйықтық екендігіне байланысты. Оның ассоциациясы буланудың өте жоғары жылуына да әсер етеді. Сонымен, 100 г дейін қыздырылған 1 г суды буландыру үшін алты есе көп жылу қажет, судың бірдей мөлшерін 0-ден 80 o С-қа дейін жылытуға қарағанда, соның арқасында су біздің планетамыздағы ең қуатты энергия көзі болып табылады. Басқа заттармен салыстырғанда, ол айтарлықтай қыздырусыз жылуды әлдеқайда көп қабылдай алады. Су температураның реттегіші ретінде жұмыс істейді, оның жоғары жылу сыйымдылығына байланысты температураның күрт ауытқуын тегістейді. 0-ден 37 ° C-қа дейінгі аралықта оның жылу сыйымдылығы төмендейді және тек 37 ° C-тан кейін арта бастайды. Судың минималды жылу сыйымдылығы 36 - 39 ° C температураға сәйкес келеді - адам денесінің қалыпты температурасы. Осының арқасында жылы қанды жануарлардың, оның ішінде адамдардың өмірі мүмкін. 0 o C және 100 o C-та қайнайды. ол жылуды айтарлықтай қыздырмай қабылдауға қабілетті. Су температураның реттегіші ретінде жұмыс істейді, оның жоғары жылу сыйымдылығына байланысты температураның күрт ауытқуын тегістейді. 0-ден 37 ° C-қа дейінгі аралықта оның жылу сыйымдылығы төмендейді және тек 37 ° C-тан кейін арта бастайды. Судың минималды жылу сыйымдылығы 36 - 39 ° C температураға сәйкес келеді - адам денесінің қалыпты температурасы. Осының арқасында жылы қанды жануарлардың, оның ішінде адамдардың өмірі мүмкін. 0 o C және 100 o C-та қайнайды. ол жылуды айтарлықтай қыздырмай қабылдауға қабілетті. Су температураның реттегіші ретінде жұмыс істейді, оның жоғары жылу сыйымдылығына байланысты температураның күрт ауытқуын тегістейді. 0-ден 37 ° C-қа дейінгі аралықта оның жылу сыйымдылығы төмендейді және тек 37 ° C-тан кейін арта бастайды. Судың минималды жылу сыйымдылығы 36 - 39 ° C температураға сәйкес келеді - адам денесінің қалыпты температурасы. Осының арқасында жылы қанды жануарлардың, оның ішінде адамдардың өмірі мүмкін. 0 o C және 100 o C-та қайнайды. Судың минималды жылу сыйымдылығы 36 - 39 ° C температураға сәйкес келеді - адам денесінің қалыпты температурасы. Осының арқасында жылы қанды жануарлардың, оның ішінде адамдардың өмірі мүмкін. 0 o C және 100 o C-та қайнайды. Судың минималды жылу сыйымдылығы 36 - 39 ° C температураға сәйкес келеді - адам денесінің қалыпты температурасы. Осының арқасында жылы қанды жануарлардың, оның ішінде адамдардың өмірі мүмкін. 0 o C және 100 o C-та қайнайды.
5. Судың физикалық қасиеттері, олардың аномалиясы
Таза су бұл түссіз, иіссіз, мөлдір сұйықтық. Судың тығыз күйден сұйыққа ауысу кезіндегі тығыздығы, барлық басқа заттар сияқты азая бермейді, керісінше артады.
Белгілі болғандай, су барлық басқа заттар үшін стандартты өлшем ретінде алынады. Физикалық тұрақтылықтың стандартын ең қалыпты, әдеттегідей жүретін затты таңдау керек сияқты. Бірақ бұл керісінше болып шықты.
Судың қалыптан тыс қасиеттерін ғалымдар ұзақ және қажырлы зерттеулердің нәтижесінде анықтады, бұл қасиеттер біздің күнделікті өмірімізде соншалықты таныс және табиғи болғандықтан, қарапайым адам олардың бар екеніне тіпті күмәнданбайды. сонымен бірге су, жер бетіндегі тіршіліктің мәңгілік серігі шынымен де ерекше және ерекше.
қалай қарама-қарсы болып шыққаны белгілі, су өлшем моделі ретінде алынады - барлық басқа заттарға арналған стандарт, физикалық тұрақтылық үшін стандарт үшін ең жақсы жүретін затты таңдау керек сияқты қалыпты, әдеттегі әдіс. Және судың бірінші, ең таңқаларлық қасиеті - су біздің планетамыздағы жалғыз затқа жатады, ол температура мен қысымның қалыпты жағдайында үш фазада немесе үш біріктіру күйінде болуы мүмкін: қатты (мұз), сұйық және газ тәрізді (көзге көрінбейтін бу) .
Судың негізгі ауытқулары:
1. Температураның 0-ден 100 ° C-ге дейін жоғарылауымен тазартылған судың тығыздығы максимумға (4 ° C температурада) ие, ал басқа сұйықтықтарда ол үнемі азаяды. 0-ден 4 ° C-қа дейінгі температурадағы тығыздыққа сәйкес су көлемі азаяды, содан кейін температура жоғарылаған сайын ол артады. Мұздаған кезде су барлық сұйықтықтар сияқты жиырылудың орнына кеңейеді. 0 ° C температурасындағы мұздың тығыздығы осы температурадағы судың тығыздығынан шамамен 10% -ға аз.
Ескерту. Егер температура төмендегенде және сұйық күйден қатты күйге өткенде судың тығыздығы заттардың көп бөлігі үшін өзгергендей өзгерген болса, онда қыс жақындағанда табиғи сулардың беткі қабаттары 0 ° C дейін салқындатып, түбіне дейін батып, жылы қабаттарға жол ашыңыз, және бұл су қоймасының бүкіл массасы 0 ° C температураға жеткенше жалғасады. Әрі қарай су қатып бастайды, қалыптасқан мұздар түбіне дейін батып, су қоймасы бүкіл тереңдікке дейін қатып қалады. Алайда суда тіршілік етудің көптеген формалары мүмкін емес еді. Бірақ су ең жоғары тығыздыққа 4 ° С жететіндіктен, оның салқындауынан туындаған қабаттарының қозғалысы осы температураға жеткенде аяқталады. Температураның одан әрі төмендеуімен тығыздығы төмен салқындатылған қабат бетінде қалады,
2. Судың қату температурасы қысымның жоғарылауымен азаяды және күткендей көтерілмейді.
Ескерту. Бұл ауытқу теңіздерде сұйықтықтың үлкен тереңдікте 0 ° C-тан төмен температурада болуын түсіндіре алады.
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz