Ферменттердің физико-химиялық факторларға тәуелдігі және кинетикасы


Қазақстан Республикасы Білім және Ғылым Министрлігі
«Казак Ұлттық Аграрлық Университеті»

РЕФЕРАТ
Тақырыбы:Ферменттердің физикалық химиялық факторларға қатысы.
Тексерген:САЛХАНОВА С
Орындаған:ҚАЛДЫБАЙ МИРҒАЛЫМ
ВМ-207
Алматы 2021 жыл
ЖОСПАРЫ
КІРІСПЕ
- ФЕРМЕНТТЕР, ҚАСИЕТТЕРІ
- ХИМИЯЛЫҚ ҚҰРАМЫ
- ФЕРМЕНТТЕРДІҢ ӘСЕР ЕТУ МЕХАНИЗМІ ЖӘНЕ КИНЕТИКАСЫ
- ҚОРЫТЫНДЫ
- ПАЙДАЛАНҒАН ӘДЕБИЕТТЕР
КІРІСПЕ
Ферменттер (лат. fermentum - «ашу») немесе энзимдер (гр. ζύμη - «ішінде», гр. ἔνζυμον «ашытқы») - барлық тірі организмдер құрамына кіретін арнайы ақуыздар. Химиялық реакцияларды жеделдетеді. [1]
Ферменттер жасушаларда синтезделіп, биохимиялық реакцияларға қатысатын ақуыздық табиғаттағы биокатализатор болып табылады. Фермент немесе энзим 19 ғ. Ван Гельмонт ұсынған) алғашқыда ашыту үдерістерінде анықталған зат.
Энзимология, ферментология - ферменттерді зерттейтін ғылым саласы. Ол басқа ғылымдармен: биология, генетика, фармакология, химиямен тығыз байланысты. Ферменттердің қызметі туралы алғашқы ғылыми еңбекті Кирхгофф (1814) жариялады. Кейін ашу үдерісі ашытқы жасушаларында ғана өтеді деген ұйғарым жасаған Л. Пастерге (1871), Либих ферменттер жасушалардың өмір сүруіндегі пайда болған өнім, ол жасушада да, олардан бөлек те қызмет атқарады деген қарсы пікір білдірді. Либихтің ғылыми көзқарасы М. Манассеина (1871), Бухнер (1897) зерттеулерінде эксперимент жүзінде дәлелденді. Жасушаларда синтезделген ферменттер өзіне тән арнайы қызметтерін организмнің барлық мүшелерінде атқарады. Ферменттік қасиет, негізінен глобулалық құрылымдағы ақуыздарға тән екені белгілі. Бірақ, қазіргі кезде кейбір фибриллалық ақуыздар да (актин, миозин) катализдік белсенділік көрсететіні анықталды.
Ферменттердің қасиеттері
Ферменттер өз әсерін өте аз мөлшерде катализаторға ұқсас жүргізеді. Фермент өзінің әсер етуші заты - субстратпен (S) ферменттік реакция жүргенде фермент-субстраттық кешен (аралық зат) түзеді. Бұл кешеннің қызметі өте күрделі, ол субстрат пен фермент молекулалары конформациясы мен энергиясын және химиялық байланыстарын өзгертеді. Реакция өткен соң фермент-субстраттық кешен жаңа қалыпқа ауысып, фермент-реакция өнімі кешеніне айналады. Содан кейін ол фермент және реакция өніміне (Р) жекеленіп бөлінеді:
S + E → S·E → EP → E + P
Ферменттердің катализдік ерекшелігіне келесі қасиеттері жатқызылады:
Барлық ферменттер глобулярлы нәруыз болып табылады.
Ферменттер жайында ақпарат, басқа да нәруыздар секілді ДНҚ-да сақталған.
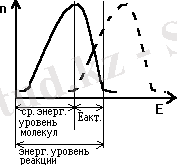
Фермент өздігінен жаңа реакция жүргізбейді. Ол тек термодинамикалық мүмкін реакцияны ғана жүргізеді. Реакция барысында активтендіру энергиясы төмендейді. Реакцияның үлкен кедергі энергиясын сатылап бөліп, төмендету және активтендіру энергиясын жоғарлату арқылы реакция жылдамдығын жоғарлатады.
Фермент басталған реакцияның бағытын өз бетінше өзгерте алмайды. Ол бір ғана реакция өнімі түзілуі бағытында жұмыс істейді. Мысалы, глюкокиназа глюкозадан тек глюкоза-6-фосфат түзілуін жүргізеді.
Фермент қатысатын реакция қайтымды болса, ол реакцияны екі бағытта да жүргізе алады. Мысалы, көмірсулардың гликолиздік ыдырауына қатысатын фосфогексо-изомераза, альдолаза, фосфоглицерат-киназа, фосфоглицератлидаза және т. б.
Ферменттің активтілігі pH ортаға, температураға және субстрактың концентрациясына байланысты өзгереді.
Ферменттер катализдік реакция энергиясының белсенділігін түсіреді.
Фермент молекуласының ферменттік қасиетін анықтайтын бөлігін ферменттің активті орталығы деп атайды. Ферменттің активті орталығы субстратпен байланысуға және ыдыратып өзгертуге міндетті. Активті орталық бүйір радикалында функционалды тобы р амин қышқылдарының қалдықтарынан түзіледі. Күрделі ферменттерде активті орталыққа амин қышқылдарынан басқа металл иондары мен коферменттер кіреді. Олар катализ процесінде маңызды қызмет атқарады.
Фермент - бұл биохимиялық реакциялар кезінде каталитикалық активтігін көрсететін белоктар. Ферменттер химиялық құрамы жағынан - қарапайым белоктар немесе күрделі белоктар. Қарапайым белоктар гидролиз кезінде амин-қышқылдарына ғана ажырап бөлінеді. Мысалы, рибонуклеаза, пепсин, трипсин, химотрипсин деген ферменттер - қарапайым белоктар.
Ферменттердің көбі - күрделі белоктар. Олар екі бөліктен құрылады: белоктық және белоктық емес. Үрделі ферменттің белоктық бөлігі апофермент деп аталады. Апофермент кофакторсыз активті болмайды. Екі бөліктен құрылған фермент - простетикалық топпен байланысқан белок холофермент деп аталады. Мысалы, каталаза сутектің асқын тотығының ыдырауын катализдейді, бұл фермент екі бөліктен құрылған: апофермент (белоктық бөлігі) және феррипротопорфирин деген кофактор.
Ферменттердің кофакторлары ретінде металл иондары немесе органикалық заттар болуы мүмкін. Кейбір ферменттер активті болу үшін екі түрлі кофактор - металл ионы мен органикалық қосылыстар (кофермент) құрамында болу керек. Кофактор температураның әсеріне төзімді келеді, ал ферменттің белоктық бөлігінің молекуласы температураның әсерінен өзгереді.
Кофактор мен белоктық бөлігі әр түрлі байланыс арқылы байланысады. Кейбір ферменттер кофактормен әлсіз байланысады, ондадиализ арқылы кофакторды белоктық бөлігінен бөлуге болады. Кейбір ферменттерде кофактор белоктық бөлігімен өте мықты байланысады. Фермент денатурацияланғанда ғана бөлініп кетеді. Мысалы, супероксиддисмутаза деген ферменттің активті молекуласына екі түрлі металл ионы кіреді: Cu2+ және Zn2+. Ферменттің кеңістік құрылымы бұзылғанда ғана металл иондары белоктық бөлігінен ажырап кетеді.
Химиялық құрамына байланысты кофакторларды 5 топқа бөлуге болады, олардың 4 тобы - коферменттер, 1 тобы - металл иондары.
1. Алифаттық қосылыстар - мысалы, глутатион, липой қышқылы.
2. Ароматты қосылыстар - мысалы, кофермент Q (убихинон) .
3. Витаминдер және олардың туындылары - мысалы, тиаминпирофосфат, пиридоксаль, пиридоксамин.
4. Нуклеотидтер мен нуклеозидтер - мысалы, НАД+, НАДФ+, ФАД, ФМН, АТФ; ГТФ, ЦТФ, УТФ нуклеозиддифосфаттар.
5. Металл иондары - мысалы, Na +, K+, Fe3+, Fe2+, Cu2+, Mo2+, Co2+, Zn2+.
Тірі организмдегі химиялық реакциялардың жүруіне катализатор ретінде қатысатын ерекше заттарды фермент деп атайды.
Олардың қасиетін, құрылысын, қызметін зерттейтін ғылымды энзимология деп атайды.
(Каталитикалық қызмет РНК-ларда да кездеседі, мыс. тРНК-ын процессингіне қатысатын РНКаза Р) . Оларды рибозимдер деп атайды.
Белгілі бір клеткада болатын ферменттердің тобы және олардың активтілігі бүкіл организмде жүретін зат алмасу реакцияларының бағытымен тығыз байланысты және осы процестерге тәуелді болады.
Ферменттердің жалпы қасиеттері
1. Табиғаты белок ферменттердің хим. реакциялардың жылдамдығын арттыруы, белоктың күйі, құрылысы сақталғанға дейін болады.
2. Ферменттердің «термолабильдігі», яғни белгілі бір температурада ғана оптималды активтілік көрсете алады. Мысалы: 37-45 С, одан жоғары температурада денатурацияға ұшырайды.
3. Ферменттердің реакция ортасының рН-на тәуелділігі. Көптеген ферменттердің рН-оптимумы 7 тең. Кейбір фемренттердің оптимумы күшті қышқылдық немесе күшті сілтілік ортада жатады (пепсин - 1, 5-2, 5; амилаза - 6, 8-7)
4. Көптеген ферменттер қайтымды түрде әсер етеді, яғни тура жүретін реакцияны да, кері жүретін реакцияны да катализдеуге қатысады
5. Өте жоғары талғамдылығы, ферменттердің субстратқа деген талғамын негізгі ә топқа бөлуге болады: абсолютті және топтық
Абсолютті т. бар ферменттер тек қана бір затқа, бір субстратқа ғана әсер етеді
Топтық т. бар ферменттер химиялық байланыстың белгілі бір түріне әсер етеді
6. Ферменттердің әсеріне активаторлар және ингибиторлар деп аталатын ерекше заттардың көмегімен реттеліп отырады. Ингибиторлар ферменттердің әсерін тежеуге қатысса, активаторлар ферменттердің әсерін күшейтіп отырады.
Ферменттердің құрылысы
Аққуыздармен қатар ферменттердің тобында аққуызға жатпайтын компоненттер - кофакторлар болады. Аққуыздық бөлігін апофермент деп атайды, ол өз бетінше катализдік активтілік көрсетпейді. Кофакторлар да өз бетінше активтілік көрсетпейді. Апоферменттер мен кофактордан тұратын ферменттік қасиеті бар комплексті холофермент деп атайды.
Кофакторладың атқаратын қызметі:
1. белоктың құрылысын өзгертіп, субстрат пен ферменттің әрекеттесуіне жағдай жасайды;
2. коферменттер атомдардың, топтардың, протондар мен электрондардың тасымалдануына қатысады.
Ферменттердің молекуласында бірнеше центрлер бар: активтік, аллостерлік.
Активті
центр деп полюсты радикалдары бар амин қышқылдарынан тұратын /сер, цис, лиз, асп т. б. / п-п тізбектің бөлімін атайды. Түзу тізбек бойынша амин қышқылдары бірінен-бірі алыс тұралады, бірақ аққуыздың кеңістікте үшінші реттік құрылысы түзілген кезіңде жақындасып, айрықша бір құрылым, активті центр құрып, субстратпен әрекеттесуге мүмкіндік алады.
Аллостерлік центр
/грек тіл. - бөтен/ активтік центрден белгілі бір қашықтықта орналасқан бөлігі. Аллостерлік центрмен байланысқан заттарды аллостерлік эффекторлар деп атайды.
ФИЗИКАЛЫҚ
Ферменттердің әсер ету механизмі және кинетикасы
1913 жылы эксперименттік жұмыстардың нәтижесіне сүйене отырып Михаэлис пен Ментен ферменттердің жұмыс істеуінің қарапайым моделін ұсынды. Катализаторлардың химиялық реакцияларды жылдамдатуы активтендіру энергиясын төмендету арқылы жүретіндігі белгілі.
Фермент қалай осы активтендіру энергиясын төмендете алады?
1. байланыстардың полярлығын арттыратын бұл комплексте электрон тығыздығында өзгерістер пайда болады;
2. ферменттердің активтік центрінде және субстратта геометриялық өзгерістер пайда болады
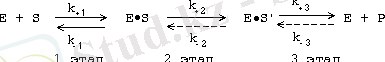
1. Ферменттің субстратпен байланысы қайтымды, субстратпен катализдік центрде фермент-субстрат деп аталатын комплекстүзе жүреді.
2. Әрі қарай фермент-субстраттық комплекс ыдырап, реакция нәтижесінде түзілетін жаңа зат және фермент қайтадан бөлініп шығады.
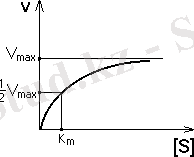
Михаэлис және Ментен ферменттік реакцияның жылдамдығының белгілі бір уақыт өткенге дейін субстраттың концентрациясына түзу сызықты тәуелділігін анықтады. Әрі қарай ферменттің активті центрі фермент-субстрат комплексімен қаныққан болады да, ферменттік реакцияның жылдамдығы өзінің максималды шегіне жетеді.
Математика жолымен ферменттік реакцияның кинетикасы
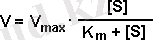 мына тендеумен жазуға болады:
мына тендеумен жазуға болады:
Михаэлис-Ментен теңдеуі деп аталып, оған анализ жасап, Км - физикалық мәнін табуға болады. Км - Михаэлис константасы. Егерде ферменттік реакцияның жылдамдығы ½ болса, Км субстрат концентрациясына тең.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz