Термодинамиканың үшінші заңы мен Нернст теоремасы: химиялық үрдістерге және болат қорытуға қолданылуы


ҚАЗАҚСТАН РЕСПУБЛИКАСЫ ҒЫЛЫМ ЖӘНЕ БІЛІМ МИНИСТРЛІГІ АЛМАТЫ ТЕХНОЛОГИЯЛЫҚ УНИВЕРСИТЕТІ
СОӨЖ №2
Тақырыбы: Термодинамиканың үшінші заңы. Нернст теоремасы. Химиялық үрдістерге термодинамиканың заңдарын қолдану
(реферат)
Орындаған: Бөленбай А. М.
Тексерген: Абилкасова С. О.
Алматы 2021
Термодинамиканың заңдары
Заңдардың негіздері
Термодинамика деп аталатын ғылым саласы жылу энергиясын ең аз дегенде бір энергия түріне (механикалық, электрлік және т. б. ) немесе жұмысқа ауыстыруға қабілетті жүйелермен айналысады. Термодинамиканың заңдары жылдар бойы термодинамикалық жүйе қандай да бір энергетикалық өзгерістерге ұшыраған кезде орындалатын негізгі қағидалардың бірі ретінде дамыды.
Термодинамиканың тарихы
Термодинамиканың тарихы 1650 жылы әлемдегі алғашқы вакуум сорғыны салған және оның Магдебург жарты шарлары арқылы вакумды көрсеткен Отто фон Гюрикпен басталады.
Герике Аристотельдің «табиғат вакуумды қорлайтынын» көптен күткен болжамды жоққа шығару үшін вакуум жасауды мақсат етті. Герикке ағылшынша физик және химик Роберт Бойль Guericke дизайнымен танысып, 1656 жылы ағылшынша ғалым Роберт Хоукпен үйлестіре отырып, ауа сорғышын жасады. Бұл сорғыны пайдалану арқылы Boyle және Hooke қысым, температура мен көлем арасындағы корреляцияны байқады. Уақыт өте келе, Бойл заңы қалыптастырылды, ол қысым мен көлемнің кері пропорционал екенін айтады.
Термодинамиканың заңдылықтары
Термодинамиканың заңдары өздеріне тигізетін әсерін бағаламау үшін өте оңай және түсінікті . . . Басқа нәрселермен қатар, олар энергияны әлемде қаншалықты пайдалануға болатынын шектейді. Бұл тұжырымның қаншалықты маңызды екеніне баса назар аудару өте қиын еді. Термодинамика заңдарының салдары қандай да бір жолмен ғылыми ізденістің барлық аспектілеріне әсер етеді.
Термодинамиканың заңдарын түсінудің негізгі ұғымдары
Термодинамиканың заңдарын түсіну үшін оларға қатысты басқа термодинамикалық түсініктерді түсіну қажет.
- Термодинамика шолу - термодинамиканың негізгі принциптерін шолу
- Heat Energy - жылу энергиясының негізгі анықтамасы
- Температура - температураның негізгі анықтамасы
- Жылумен тасымалдауға кіріспе - жылу берудің әр түрлі әдістерін түсіндіру.
- Термодинамикалық процестер - термодинамиканың заңдары көбінесе термодинамикалық процестерге қолданылады, термодинамикалық жүйе қандай да бір энергетикалық трансферден өтеді.
Термодинамиканың заңдылықтарын дамыту
Энергияның айқын нысаны ретінде жылуды зерттеу 1798 жылы британдық әскери инженер Сэр Бенджамин Томпсон (The Rumford деп те аталады) кезде, бұл жылу жасалатын жұмыстардың көлеміне пропорционалды болатындығын байқады . . . іргелі бұл термодинамиканың бірінші заңының салдары болып табылады.
Француз физигі Сади Карнот 1824 жылы термодинамиканың негізгі қағидасын тұжырымдады. Карнот өзінің
Carnot циклдік жылу қозғалтқышын анықтайтын қағидалары, неміс физигі Рудольф Клаузиус термодинамиканың екінші заңына айналады, ол да жиі тұжырымдалған термодинамиканың бірінші заңы.
Тоғызыншы ғасырдағы термодинамиканың қарқынды дамуы үшін өнеркәсіптік революция кезінде тиімді бу қозғалтқыштарын жасау қажеттілігі туындады.
Кинетикалық теория және Термодинамиканың заңдары
Термодинамика заңдары атом теориясы толығымен қабылданғанға дейін қалыптасқан заңдарға мағынасы бар жылу берудің қалай және неліктен нақты екендігіне ерекше көңіл аудармайды. Олар жүйе ішіндегі энергия мен жылудың жалпы өтулерімен айналысады және атомдық немесе молекулярлық деңгейде жылу алмасудың ерекше сипатын ескермейді.
Термодинамиканың нөлдік заңы
Термодинамиканың нөлдік заңы: Үшінші жүйемен термиялық тепе-теңдіктегі екі жүйе бір-біріне жылу тепе-теңдігі болып табылады.
Бұл нөлдік заң - жылу тепе-теңдігінің өтпелі қасиеті. Математиканың өтпелі қасиеті, егер A = B және B = C болса, онда A = C. Термиялық тепе-теңдікке келетін термодинамикалық жүйелерге де қатысты.
Нөлдік заңның салдары - бұл температураны өлшеудің кез-келген мағынасы бар деген идея. Температураны өлшеу үшін жылу тепе-теңдігі термометрдің тұтастай алғанда, термометрдің ішіндегі сынап пен өлшенетін зат арасында жетеді. Бұл, өз кезегінде, заттың температурасы қандай екенін анықтауға мүмкіндік береді.
Бұл заң термодинамиканы зерттеу тарихының көп бөлігі арқылы анық айтылмай түсінді және тек 20-шы ғасырдың басында бұл заңның өзі екенін түсінді. Британдық физик Ральф Хо Фоулер алғаш рет «заңның нөлдері» деген терминді басқа заңдарға қарағанда неғұрлым іргелі деп санайтынына негізделген.
Термодинамиканың бірінші заңы
Термодинамиканың бірінші заңы: Жүйенің ішкі энергиясының өзгеруі жүйеге қоршаған ортаға қосылатын жылу мен оның қоршаған ортаға жасаған жұмысы арасындағы айырмашылыққа тең.
Бұл күрделі болса да, бұл өте қарапайым идея. Егер сіз жүйеге жылу қоссаңыз, тек екі нәрсе жасалуы мүмкін - жүйенің ішкі энергиясын өзгерту немесе жүйенің жұмыс істеуіне себеп болуы (немесе, әрине, осы екі комбинация) . Барлық жылу энергиясы осы заттарды жасау керек.
Бірінші заңның математикалық көрінісі
Физиктер көбінесе термодинамиканың бірінші заңындағы мөлшерді көрсету үшін бірдей конвенцияларды пайдаланады. Олар:
- U1 (немесеUi) = процестің басында бастапқы ішкі энергия
- U2 (немесеUf) = процестің соңында соңғы ішкі энергия
- delta -U=U2 -U1 = ішкі энергияның өзгеруі (ішкі энергияның басталу және аяқталу ерекшелігі жарамсыз болған жағдайларда пайдаланылады)
- Q= жүйеге жылу (Q> 0) немесе жүйеден (Q<0) ауысады
- W= жүйе бойынша орындалатын жұмыс (W> 0) немесе жүйеде (W<0) .
Бұл бірінші заңның математикалық көрінісін береді, ол өте пайдалы және бірнеше пайдалы жолмен қайта жазылуы мүмкін:
U 2 - U 1 = delta - U = Q - W
Q = delta- U + W
Термодинамикалық процесті талдау, кем дегенде, физикалық сыныптың жағдайында, әдетте, осы сандардың бірі 0-ден немесе кем дегенде ақылға қонымды түрде басқарылатын жағдайды талдауды қамтиды. Мысалы, адиабатикалық процесте жылу ( Q ) 0 тең, изохорлық процесте жұмыс ( W ) 0 тең.
Бірінші заң және энергияны сақтау
Термодинамиканың алғашқы заңы энергияны сақтау тұжырымдамасының негізі ретінде көптеген адамдарға көрінеді. Негізінде бұл жүйеге түсетін энергия жол бойында жоғалмауы мүмкін, бірақ бірдеңе істеу үшін пайдаланылуы керек . . . бұл жағдайда ішкі энергияны өзгерту немесе жұмыс істеу.
Осы тұрғыдан алғанда, термодинамиканың алғашқы заңы - ашылған ең кең ғылыми ұғымдардың бірі.
Термодинамиканың екінші заңы
Термодинамиканың екінші заңы: процестің бірден-бір нәтижесі ретінде жылуды салқын денеден ыстыққа ауыстыру мүмкін емес.
Термодинамиканың екінші заңы көптеген тәсілдермен тұжырымдалады, ол қысқа мерзім ішінде қарастырылады, бірақ негізінен заң - физикадағы басқа заңдардың көпшілігінен айырмашылығы - бірдемені қалай жасауға болатындығына емес, сонымен қатар толықтай шектелетін нәрсеге шектеу қоюмен айналысады. жасалсын.
Табиғат бізге табиғаттың көптеген түрлеріне қол жеткізбестен белгілі бір түрлерін алуға кедергі жасайтын заң болып табылады және бұл термодинамиканың алғашқы заңы сияқты энергияны сақтау тұжырымдамасымен тығыз байланысты.
Практикалық қолданыста, бұл заң термодинамиканың принциптеріне негізделген кез келген жылу қозғалтқышы немесе ұқсас құрылғы, тіпті теорияда, 100% тиімді болмайды дегенді білдіреді.
Бұл принцип алғаш рет 1824 жылы Карнот циклінің қозғалтқышын әзірлеген француз физигі және инженері Сади Карнотпен жарыққа шықты, ал кейін неміс физик Рудольф Клаузиустың термодинамикалық заңы ретінде ресімделді.
Энтропия және Термодинамиканың екінші заңы
Термодинамиканың екінші заңы, мүмкін, энтропия немесе термодинамикалық процесте туындаған бұзылу тұжырымдамасымен тығыз байланысты болғандықтан физика саласынан тыс ең танымал. Енгізу туралы мәлімдеме ретінде қайта құрылған, екінші заңда былай делінген:
Кез келген тұйық жүйеде жүйенің бойымыздағы ендігі немесе тұрақты болып қалады.
Басқаша айтқанда, жүйе термодинамикалық процестен өткен сайын, жүйе бұрынғыдай дәл сол күйге ешқашан толықтай оралмайды. Бұл
уақыттың көрсеткісі үшін қолданылған бір анықтама, өйткені ғаламның энтропиясы термодинамиканың екінші заңына сәйкес уақыт бойынша әрдайым артады.
Екінші Екінші Құқықтық Формула
Циклдік трансформация, тек қана соңғы нәтижесі бірдей температурада жұмыс істейтін көзден алынатын жылуды айналдыруға болмайды. - Шотландиялық физик Уильям Томпсон ( Лорд Кельвин )
Циклдік трансформация, тек қана соңғы нәтижесі дене температурасынан дене температурасын жоғары температурада беру үшін мүмкін емес. - Неміс физикі Рудольф Клаузиус
Термодинамиканың екінші заңының жоғарыдағы тұжырымдамалары бірдей іргелі принциптің баламалы мәлімдемесі болып табылады.
Термодинамиканың үшінші заңы
Термодинамиканың үшінші заңы негізінен абсолютті температура шкаласын жасау мүмкіндігі туралы мәлімдеме болып табылады, ол үшін абсолютті нөл нүкте - қатты заттың ішкі энергиясы дәлме-дәл болып табылады.
Түрлі көздер термодинамиканың үшінші заңының үш ықтимал тұжырымдамасын көрсетеді:
- Соңғы операциялық жүйеде кез келген жүйені абсолютті нөлге дейін азайту мүмкін емес.
- Элементтің мінсіз кристалының энтропиясы оның ең тұрақты түрінде температура абсолютті нөлге жақындағанда нөлге ұмтылады.
- Температура абсолюттік нөлге жақындай отырып, жүйенің энтропиясы тұрақты болып келеді
Үшінші нені білдіреді?
Үшінші заң бірнеше нәрсені білдіреді және тағы да осы тұжырымдардың бәрі бірдей нәтижеге әкеледі: сіз қаншалықты ескересіз:
3 формуласы ең аз шектеулерді қамтиды, тек бұл энтропия үнемі өзгеріп отырады. Шын мәнінде, бұл тұрақты нольдік энтропия (2 формулада көрсетілгендей) . Дегенмен, кез-келген физикалық жүйедегі кванттық шектеулерге байланысты ол өзінің ең төменгі кванттық күйіне дейін құлдырап, бірақ ешқашан ешқашан 0 бойымызға дейін азайта алмайды, сондықтан физикалық жүйені соңғы сандарда абсолютті нөлге дейін азайту мүмкін емес (ол бізге тұжырымдамасын береді 1) .
Нернст теоремасы
Термодинамиканың басталуы
Термодинамиканың үшінші заңы (Нернст теоремасы) - абсолютті нөлдік температурада энтропияның әрекетін анықтайтын физикалық принцип. Бұл термодинамиканың постулаттарының бірі.
Термодинамиканың үшінші заңын былай тұжырымдауға болады:
«Абсолютті нөлдік температурада энтропияның өсуі соңғы шекке дейін жетеді, бұл жүйенің тепе -теңдік күйіне тәуелді емес».
![\lim\limits_{T \to \, 0\, K} \left[S(T,x_2) - S(T,x_1) \right] = 0](https://kz-rkd-img.s3.studkz.pro/106312/image1.webp)
немесе
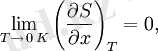
мұндағы x - кез келген термодинамикалық параметр.
Термодинамиканың үшінші заңы тек тепе -теңдік күйлерге қатысты екенін ескеріңіз.
Термодинамиканың екінші заңы негізінде энтропияны ерікті қоспа тұрақтысына дейін ғана анықтауға болады (яғни энтропияның өзі анықталмайды, тек оның өзгеруі) :
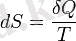
энтропияны дәл анықтау үшін термодинамиканың үшінші заңын қолдануға болады. Бұл жағдайда абсолютті нөлдік температурадағы тепе -теңдік жүйесінің энтропиясы нөлге тең деп есептеледі.
Термодинамиканың үшінші заңы энтропияның абсолюттік мәнін табуға мүмкіндік береді, оны классикалық термодинамика шеңберінде жасауға болмайды (термодинамиканың бірінші және екінші принциптеріне негізделген) . Классикалық термодинамикада энтропияны тек термодинамикалық зерттеулердің көпшілігіне еш кедергі жасамайтын ерікті S0 тұрақты қосындысының дәлдігімен ғана анықтауға болады, өйткені әр күйдегі энтропияның айырмашылығы (S0) іс жүзінде өлшенеді. Термодинамиканың үшінші заңына сәйкес,
 -ге дейін
-ге дейін
 -ге тең.
-ге тең.
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz