Атом құрылысы: тарихи негіздер, ядро мен электрондық құрылым, периодтық заң және изотоптар


ҚАЗАҚСТАН РЕСПУБЛИКАСЫНЫҢ БІЛІМ ЖӘНЕ ҒЫЛЫМ МИНИСТРЛІГІ
ОҢТҮСТІК ҚАЗАҚСТАН МЕМЛЕКЕТТІК ПЕДОГОГИКАЛЫҚ УНИВЕРСИТЕТІ

РЕФЕРАТ
Тақырыбы: Атом құрылысы
Орындаған: Шадияр Арайлым
1 курс студентті
Тобы:1507-31
Қабылдаған: доцент-Керімбаева К. З
Кез келген күрделі заттың құрамы мен қасиетін сақтайтын ең кіші бөлшегі - оның молекуласы болса, осы молекуланың өзі атомдардың байланысуынан түзіледі. «Атом» грек тілінде «бөлінбейтін» деген мағынаны білдіреді. Былайша айтқанда, атом - заттың химиялық жолмен бөлінбейтін ең ұсақ бөлшегі. Жасанды атомдарды есептемегенде, бүгінгі күні табиғатта әр түрлі 92 атом кездеседі. Бір қызығы, әлемдегі түрлі денелер мен заттардың кез-келгені осы 92 химиялық элементтің атомдарынан тұрады. Ертедегі грек ғалымдарының бірі Демокрит кезкелген зат бөлінбейтін өте ұсақ бөлшектерден тұратынын жорамалдап, ондай бөлшектерді «атомдар» деп атаған. Тіпті олар үнемі қозғалыста болады деп есептеді. Атомдардың бір-бірімен өздігінен әрекеттесу қабілеті туралы ойды Эпикур да айтты. Дегенмен бұл ойшылдардың айтқаны ғылыми тәжірибеге сүйенбегендіктен, көп ғасыр бұл мәселе жабық қалып, тиісінше зерттелмеді.
Соңғы ғасырларда ғана физика, химия ғылымдарының дамуымен заттың құрамына қатысты түрлі тәжірибелік зерттеулер қолға алынды. Атап айтқанда, ХIХ ғасырдың басында (1803 ж. ) Джон Дальтон атомистикалық теорияны жандандырып, белгілі химиялық элементтің атомдары бірдей
Қасиет көрсететінін, ал әртүрлі элементтерге әртүрлі атомдар сәйкес келетінін дәлелдеді. Ол қатты заттар мен сұйықтықтар тәрізді газдардың да ұсақ бөлшектерден тұратынын анықтады. Атомның маңызды сипаттамасы ретінде «атомдық масса» ұғымы қабылданды. Алайда атом әлі де бөлінбейтін бөлшек деп есептелді. 1897 жылы ағылшын ғалымы Дж. Томсон жүргізген тәжірибесі бірқатар электр құбылыстарын түсiндiруге мүмкiндiк берді. Атом құрылысын күрделі деп қабылдаған Дж. Томсонның бейнелеп түсіндіруінше, атом радиусы шамамен 10 м болатын шар тәрізді. Бұл шардың бүкiл көлемi оң зарядталған, ал терiс зарядталған электрондар оның iшiнде су тамшысының iшiндегі түйiршiктер іспетті қозғалып жүредi. Ол атомнан зарядталған бөлшектер шығатынын, яғни атомның алғашқы элементар бөлшегі, «электрондарды» дәлелдеді. Атомның құпиясына одан да тереңiрек ашқан ғалым ағылшын оқымыстысы Эрнест Резерфорд болды. Резерфордтың тәжірибесінше (1911 ж. ) Атомдағы оң зарядтар оның орталығына барып жиналады. «Атом ядросы» деген осы. Резерфордтың түсіндіруінше, атомының құрылысы Күн жүйесiне ұқсайды. Күн жүйесiнде планеталардың оған тартылып айналғаны сияқты, электрондар да ядроға тартылып оны айнала қозғалуда. Осы себепті Резерфорд ұсынған үлгі «планетарлық үлгі» деп аталып кетті. Осындай ғылыми тәжірибелер нәтижесінде заттың ең ұсақ бөлшегі атом болса, атомның да электрон, протон және нейтрон деп аталатын түрлі элементар бөлшектердің жиынынан тұратыны анықталды. Протондар мен нейтрондар атомның ішкі ядросында орналасқан, ал электрондар ядроны айнала қозғалуда. Атомның электрондық қабатшалары түзілуде.
Атом бүтіндей алғанда зарядсыз, бейтарап бөлшек. Ол ортасында өзінен радиусы 104 -105 есе кіші көлемді алып жатқан оң зарядты ядродан және оны айнала қозғалып жүрген теріс зарядты электрондардан тұрады. Атом өзінің сыртқы бір немесе бірнеше электрондарын жоғалтқанда оң, ал сырттан электрон қосып алғанда теріс ионға айналады. Атомның сызықтық өлшемдері ~ 10-8 см, көлденең қимасының ауданы ~10-16 см2, көлемі ~10-24 см3. Барлық атом теориясында ең қарапайым атом - сутегі атомы. Оның радиусының дәл белгілі бір мәні бар және ол мүмкін болатын ең кіші айналу орбитасының радиусы шамасына тең: a=0. 53 * 10−8 см (дәлірек, 0. 52917*10-8 см) . Атомның массасы, негізінен оның ядросының массасына тең және ол массалық санға (А), яғни протондар мен нейтрондардың жалпы санына (нуклондардың жалпы санына) пропорционал болып ұлғаяды.
Атом ядродан және осы ядроны айналып тұратын электрондардан құралған. Атом құрылысы
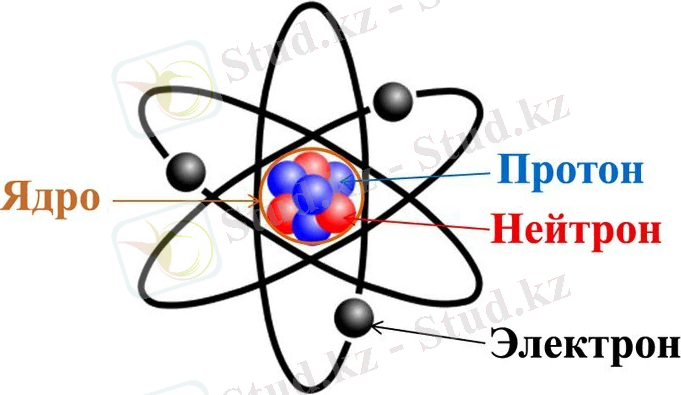
Ядро протондар мен нейтрондардан құралған. Протон оң заряды бар бөлшек, ал нейтронның заряды жоқ бөлшек. Осы екі бөлшектің массалары шамалас, ал электрон болса нейтроннан 1838 есе жеңіл. Электронның заряды теріс. Электронның заряды табиғатта бар электр зарядтардың ең кішісі, протонның заряды электрондікіне тең, тек таңбасы оң.
Атомның құрамында неше электрон бар болса, сонша протон бар болады. Мысалы сутегінің атомында бір электрон және бір протон бар. Сутегі атомының қорытқы заряды +1 - 1 = 0. Яғни осы атом бейтарап болады. Бұл қағида барлық атомдарға орынды.
Атом ядросының құрамы
Жоғарыда атомның ішінде электрондар, протондар және электрондар бар дедік. Протонды p, нейтронлы n ал электрондарды
 деп белгілейді.
деп белгілейді.
Протондар мен нейтрондар электронмен салыстырғанда өте ауыр болғандықтан, атом массасының 99, 95% атом ядросында шоғырланған. Атом ядросының құрамы осындай!
Химиялық элементтің A r салыстырмалы атомдық массасы оның Z - атомдық нөміріне және N - нейтрондар санының қосындысына тең:
A r = Z + N
Мысалы оттегінің протондар, электрондар және нейтрондар саның аңықтайық. Оттегінің атомдық нөмірі Z = 8 ал салыстырмалы атомдық массасы A r = 16, жоғарыдағы формуланы пайдаланып нейтрондар саның аңықтайық:
16 = 8 + N
N = 16 - 8
N = 8.
Сөйтіп оттегінің нейтрондар саны 8 тең, ал осы атомның қысқа түрдегі құрылысы былай жазылады:
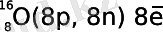
Атомның элементар бөлшектері:
1. Элемент атомының массасы протон мен нейтрон массасының қосындысына тең.
2. Ядродағы протон саны элементтің реттік нөміріне тең.
А = Z + N; A - атомдық масса; Z - протон; N - нейтрон;
Табиғатта атомдық массасында айырмашылығы болатын бірдей элементтер атомы болады. Мысалы, хлор элементінің массасы 35 және 37 болатын екі түрі кездеседі. Бұл атомдардың ядросында протондар саны бірдей, ал нейтрондар саны әр түрлі. Олар изо- топтар. Изотоптар - ядро зарядтары бірдей, атомдық массалары әртүрлі атомдардың түр өзгерістері. Изотоп - бірдей орында деген мағнаны білдіреді.
Изотоптарда протон мен электрон саны бірдей, нейтрон сандары әртүрлі. Әрбір изотоп екі түрлі шамамен өлшенеді: массасы және элементтің рет нөмірі. Мысалы:
1.
 - атомдарының ядро зарядтары бірдей - оттегі изотоптары.
- атомдарының ядро зарядтары бірдей - оттегі изотоптары.
2.
 - сутегінің изотоптары, аттары: протий, дейтрий, тритий .
- сутегінің изотоптары, аттары: протий, дейтрий, тритий .
Элементтердің атомдық массалары бөлшек сандармен өрнектеледі. Мысалы, хлор эле- ментінің с. а. м. 35, 5. Бұл ұғымдардың айырмашылығын түсіндіру үшін мынадай мысал- дар келтіріледі. Табиғатта
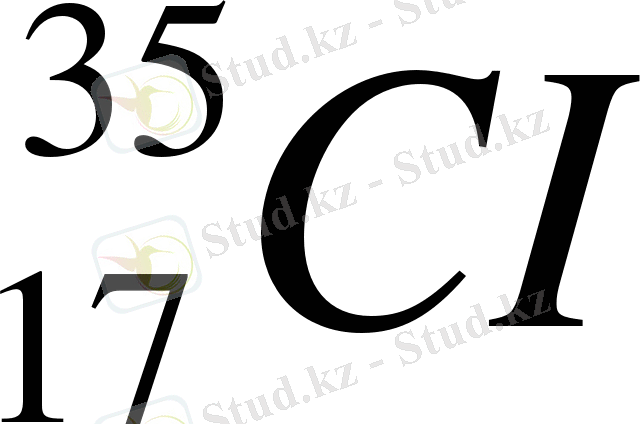 изотобы 75%, ал
изотобы 75%, ал
 изотобы 25% таралған. Осыдан хлор элементінің орташа с. а. массасы шығады: А
r
(CI) = 35∙0, 75+37∙0, 25 = 35, 5
изотобы 25% таралған. Осыдан хлор элементінің орташа с. а. массасы шығады: А
r
(CI) = 35∙0, 75+37∙0, 25 = 35, 5
Периодтық жүйеде келтірілген элементтердің атомдық массалары изотоптардың табиғи қоспаларының орташа массалық саны. Изотоптар туралы мәліметтерді ескере отырып, оқушыларға химиялық элемент ұғымының нақты анықтамасын беру қажет. Химиялық элемент дегеніміз - ядро заряды бірдей атомдар түрі.
Атом құрылысы тұрғысынан периодтық заңды түсіндіру
Периодтық жүйе периодтық заңның құрылымдық кескіні. Ол 7 периодтан 8 топтан тұратын кесте. Периодтар үлкен және кіші болып бөлінеді. Алғашқы үш период кіші периодтар, олар бір қатардан ғана тұрады, ал үлкен периодтар екі қатардан тұрады. Бір периодта орналасқан элементтердің энергетикалық деңгейлерінің саны бірдей болғанымен, олардың ядро
зарядтарының артуына байланысты ядроның электронды тарту күші артады, сондықтан атом радиустары солдан оңға карай кемиді. Периодтарда солдан оңға қарай сыртқы қабаттағы электрондар саны біртіндеп артады, бұл металдық қасиеттің біртіндеп әлсіреп, бейметалдық қасиеттің артуына әкеп соғады.
Металдардың сыртқы қабаттарында электрондар саны аз болады, сондықтан олар электрондарын беруге бейім келеді. Ал бейметалдардың сыртқы энергетикалық деңгейлері аяқталуға жақын, сондықтан олар аяқталуға жетпеген электрондарды қосып алуға бейім келеді.
Олардың сутекті қосылыстарындағы валенттіліктері қанша электрон қосып алғандығымен анықталады.
Бір топта орналасқан элементтердің валенттілік электрондарының саны бірдей болады. Негізгі топша элементтерінің валенттілік электрондары сыртқы энергетикалық деңгейде орналасса, қосымша топша элементтерінікі сыртқы және одан кейінгі деңгейлерде орналасады.
Бір топтың элементтерінің қосылыстарындағы жоғары валенттіліктері бірдей болады . Қосымша топша элементтерінің барлығы металдар, олардың көпшілігінің сыртқы қабаттарында екі электрондары бар, сол себепті олардың төменгі валенттіліктері екі, ал жоғарғы валенттілігі топтың нөміріне сәйкес келетін айнымалы валенттілік көрсететін элементтер.
Топ бойынша негізгі топшада жоғарыдан төмен қарай атом радиусы өседі, себебі энергетикалық деңгейлер саны артады. Сондықтан соңғы деңгейдегі электрондарды бөліп алуға жұмсалатын энергияның шамасы азаяды, бұл металдық қасиеттің артуына әкеліп соғады. Элементтердің, олардың жай және күрделі қосылыстарының қасиеттерінің өзгеруі элемент атомдарының электрондық құрылысының периодты өзгеруіне байланысты болады.
Атомдағы электрондардың күйі
Атом өте ұсақ бөлшек болғандықтан, ондағы электронның қозғалысы микродүниенің қозғалу заңдылықтарына бағынады. Электрондар ядро сыртындағы кеңістікті біртіндеп толтырады, электрондардың орналасу заңдылықтарын білу элементтің физикалық және химиялық қасиеттерін анықтау үшін қажет. Электрон ядроны одан белгілі бір қашықтықта (энергия қорының шамасына қарай) айналып жүру мүмкіндігі ең жоғары кеңістіктің бөлігі орбиталь - электрондық бұлт деп аталады. Қозғалыстағы электрон бұлтының пішіні әр түрлі болады: шар тәрізді, олар s әрпімен белгіленеді. Р-электрондар гантель тәрізді, олардан басқа d - деңгейшелері де болады.
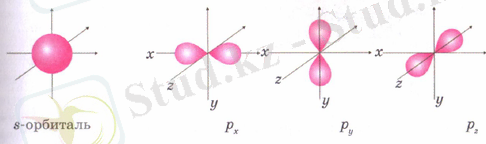
Химиялық әдебиеттерде s-орбитальді s-деңгейше, р-орбитальді р-деңгейше деп те атайды. S-орбиталь кеңістікте бір түрде ғана орналасады, оны бір кванттық ұяшықпен , ал р-орбиталь кеңістікте үш түрлі (х, у, z бағыттарында) орналаса алатындықтан оны үш кванттық ұяшықпен белгілейді.
Енді элементтердің электрондарының орналасуын көрсететін формулаларына көшейік. Сутек атомында бір ғана электрон бар, ол бірінші энергетикалық деңгейде s-деңгейшеде орналасқан, олай болса сутек атомының электрондық формуласы 1s 1 болады, ал гелий атомыныкі - ls 2 .
Атомда электрондар ядроны айнала қозғалуынан басқа өз білігінен де айнала алады, Жердің Күнді айналуымен бірге өз білігінен де айналатыны сияқты.
Электронның өз білігінен айналуын спин деп атайды, электрон сағат тілінің қозғалыс бағытымен немесе оған қарама-карсы бағытта қозғалады, ол формулада бір кванттық ұяшыкта екі электронды орналастырғанда бағдаршаларды қарама-қарсы жазу арқылы көрсетіледі. Мысалы: H 1s 1 дара бір электрон болса, ал гелий атомында 1 s 2 . Осындай формулалар атомның электронды-құрылымдық формуласы деп аталады. [1]
Изотоптар - ядроларында протондар саны бірдей, бірақ массалары әртүрлі белгілі бір элементті құрайтын атомдар түрі.
Бір ғана элементтің әртүрлі изотоптарына тән атомдар өздерінің ядросына кіретін нейтрондар саны жағынан, ядролық қасиеттері тұрғысынан бір-бірінен анық өзгешеленеді, алайда олар, электронды қабаттары құрылысының бірдей болуына байланысты, бір-біріне өте ұқсас химиялық қасиеттерді иемденеді. Химиялық элементтердің көпшілігі атомдық салмақтары әр түрлі изотоп қоспасынан тұрады. Изотоптардың өмір сүру кезеңі секундтың мыңнан бір бөлігінен бірнеше миллион жылдарға дейін созылады. Бүгінгі танда 264 тұрақты изотоптар, 50 шамалы табиғи радиоактивті изотоптар және 1000-нан астам жасанды радиоактивті изотоптар белгілі. [1]
Радиоактивтiк құбылысты зерттеу атом ядроларының табиғатына қатысты маңызды жаңалықтардың ашылуына себепшi болды. Көптеген радиоактивтiк түрленулердi бақылау нәтижесінде радиоактивтiк қасиеттерi мүлдем әр түрлi (яғни түрлiше тәсiлдермен ыдырайтын), бiрақ өздерiнiң химиялық қасиеттерi жөнiнен барабар заттар бар екенi анықталды. Белгiлi химиялық тәсiлдердiң бәрiмен де оларды ажырату ешбiр мүмкiн болмады. Осының негiзiнде 1911 ж. Содди хямиялық қасиеттері бiрдей, басқа жағынан, мәселен өзiнiң радиоактивтiгiмен ұксамайтын элементтер бар екенi жөнiнде болжам айтты. Мұндай элементтердi Менделеевтiң периодты жүйесiнің бiр тор көзiне орналастыру керек. Сондықтан Содди оларды изотоптар (яғни периодтық жүйеде бiрдей орын алатындар) деп атады.
Бiр жылдан соң Дж. Дж. Томсон электр және магнит өрiсiндегi ауытқу тәсiлiмен неон иондарының массасына дәл өлшеулер жүргiзген кезде Соддидiң болжамы ойдағыдай дәлелденiп, оған терең түсiнiктеме берiлдi. Томсон неон атомдардың екi түрiнiң қоспасы екенiн байқады. Олардың басым көпшiлiгiнiң салыстырмалы атомдық массасы 20-ға тең. Бiрақ салыстырмалы атомдық массасы 22-ге тең аздаған атомдар қоспасы да бар. Осының нәтижесiнде қоспаның салыстырмалы атомдық массасы 20, 2-ге тең. Бiрдей химиялық қасиеттерi бар атомдардың массаларында айырмашылық байқалады. Неонның екi түрiнiң де Менделеев кестесiнде бiрдей орын алатындығы анық, ендеше, олар изотоптар болып табылады. Сонымен, изотоптардың тек өздерiнiң радиоактивтiк қасиеттерi жағынан ғана емес, массасы жағынан да айырмашылығы болады екен. Сонымен бiрге соңғы жағдай басымырақ рөл атқарады. Изотоптарда атом ядроларының зарядтары бiрдей болады. Сондықтан атом қабықшаларындағы электрондар саны, демек, изотоптардың химиялық қасиеттерi бiрдей. Бiрақ ядроның массалары әр түрлi. Сонымен қатар, ядролар радиоактивтi де, тұрақты да бола алады. Радиоактивтi изотоптар қасиеттерiнiң түрлiше болуы олардың ядроларының массалары әр түрлi болуына байланысты.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz