Сутектік байланыс: табиғаты, түрлері және физика-химиялық қасиеттері


Жоспар:
I. Кіріспе
II. Негізгі бөлім
2. 1. Сутектік байланыс
2. 2. Сутектік байланыстың ерекшелігі
ІІІ. Қорытынды
IV. Пайдаланылған әдебиеттер
Кіріспе
Қазіргі химияның негізгі мәселесінің бірі - химиялық байланыс туралы ілім. Зат құрамына кіретін атомдардың бір-біріне әсер ету табиғатын білу, заттардың алуан түрлілігін, олардың қасиеттерін анықтауға мүмкіншілік береді. Химиялық байланысқа қазіргі көзқарас бойынша, электрлік сипат береді. Валенттілік электрондардың қосылыста таралу табиғатына байланысты химиялық байланыстың үш түрі бар: иондық, коваленттік (координациялық, сутектік), металдық байланыс.
Сутектік байланыс табиғатта кең таралған және оның көптеген химиялық және биологиялық процестер үшін маңызы зор. Сутектік байланысты тек молекуласындағы сутек атомы күшті электртерістілікті атомдармен (F, O, Cl, N, S, және т. б. ) байланысқан зат қана түзе алады. Сутектік байланыс тек молекулааралық қана (әртүрлі молекулалар арасында) болмай, ол бір молекуланың ішінде де (бір молекула ішіндегі әртүрлі топтар арасында) бола алады. Сутек атомы - ішкі электрондық кауызы жоқ және өте кіші өлшемде болғандыктан, көрші теріс полюстенген атомның электрондық қауызы ішіне еніп кетуге қабілетті. Мысалы. құмырсқа кышқылындағы Н - О байланысты түзуші электрондар, электртерістілеу оттек атомына ығыскан. Сутек атомының ядросында (протонда) электрондық бұлт мүлдем калмайды. Мұндайда осы сутек атомы ядросы мен теріс зарядталған кышкылдың көрші молекуласындағы оттек атомының арасында электростатикалық тартылу туындайды. Бұл сутектік байланыстың пайда болуына әкеледі. Бұл байланыстың түзілуіне сутек атомындағы «жартылай бос» IS - орбиталімен және электртерістілікті атомның бөлінбеген электрон жұбы орбиталінің донорлы - акцепторлық әрекеттесуі белгілі бір дәрежеде үлес қосады.
Негізгі бөлім
2. 1 Сутектік байланыс
Сутектік байланыс деп сутек атомы мен электртіреістілігі жоғары атомдар арасында болатын химиялық байланыстың түрін айтады. Сутектік байланыстың нәтижесінде заттардың қасиеттері өзгереді.
Байланыстың бұл түрінде молекулалар сутек арқылы байланысады. Байланыстың бұл түрі табиғатта өте кең тараған. Сутектік байланыс әр түрлі зат, бір түрлі зат молекулалары арасында, типті бір молекуланың ішіндегі атомдар арасынды болады. Мысалы, су молекуласының құрылысын қарастырсақ, онда екі атом сутек бір атом оттекпен полюсті ковалентті байланыс арқылы байланысқан. Электрон жұптары электртерістігі жоғары элемент элемент оттек жаққа көбірек ығысқан. Нәтижесінде, су молекуласының сутек атомдары жағында оң заряд пайда болады.
Мұнда сутек акцептор болып табылатныдықтан, судың басқа молекуласындағы оттектің артық электрон жұбын өзінің бос орбитальне қабылдау арқылы химиялық байланыс түзе алады. Сөйтіп судың бірнеше молекуласы бірімен бірі байланысып димер, тример, тетрамерлер түзеді
Сутектік байланыс молекула аралық әсерлесумен валенттілік электрондардың қатысуымен болатын байланыстардың аралығынан орын алады[1] .
Су молекулаларының ассоциацияланған күйде (Н 2 О) n болатынын, оның әлсіз электролит екендігін білеміз, ал осыған себепші болатын сутектік байланысты қарастырайық.
Бір зат молекуласындағы электртеріс элементпен осы заттың екінші молекуласындағы сутек арасындағы байланысты (молекула ішілік) сутектік байланыс деп атайды, ол донорлы-акцепторлы байланыстың бір түр өзгерісі. Сутектік байланыс энергиясы аз 8-80 кДж/моль аралығында жатады. Сутектік байланысты молекулаішілік және молекулааралық деп екіге бөлуге болады.
Енді осы байланысты мысалдар келтіре қарастырайық. Оның екінші типіне су молекуласы мысал бола алады. Су молекуласы бұрыштық, полюсті ковалентті байланысты зат, формуладағы қос нүктемен оттектің жұп электрондары көрсетілген(1-сурет) .
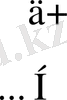
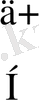
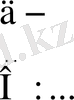

О: . . . 2s 2 2p 4
H: 1s 1
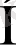
Байланыс полюсті болғандықтан электрон бұлтының тығыздығы оттек атомына ығысуына байланысты сутек атомы - акцептор, ал екінші молекуладағы оттек - донор ролін атқарғандай болады[2] .
Мұзда су молекулалары тетраэдр тәрізді құрылысты, онда оттектің әрбір атомы сутектің төрт атомымен байланысқан: оның екеуімен полярлы ковалентті байланыс ( l H-O =0, 109 нм), ал қалған екеуі молекулааралық сутектік байланыс ( l H…O =0, 176 нм) арқылы. Ал, әрбір сутек атомы екі оттек атомымен байланысқан, оның бірі - полюсті ковалентті болса, екіншісі - сутектік байланыс. Суды еріткенде сутектік байланыстың бір-аз бөлігі бұзылады, сондықтан сұйық су мұзға қарағанда тығызырақ. Су буға айналғанда сутектік байланыстар толығымен ыдырайды(2- сурет) .
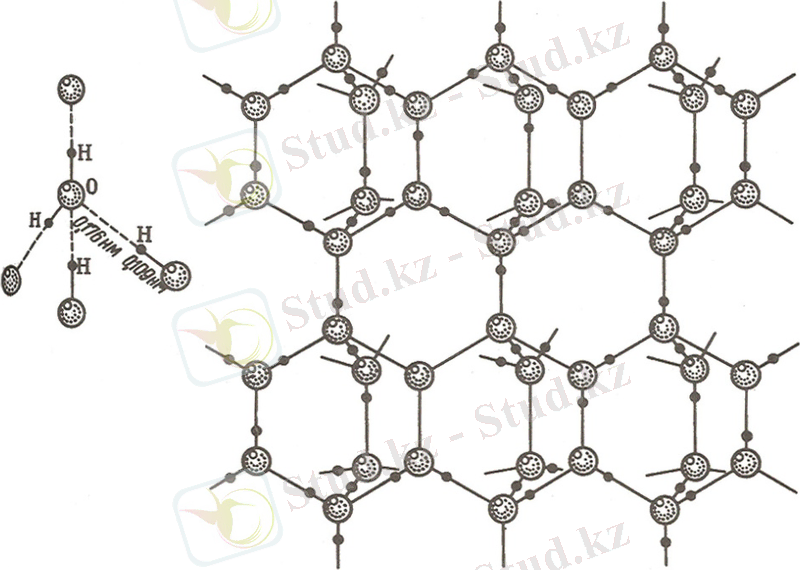
Сурет- 2 Мұздың сутекті байланысты құрылысы
Оттек элементі VI-А топшасында орналасқан элементтерінің ішіндегі ең электртерісі болуына байланысты осы топтағы элементтердің сутектік қосылыстарының агрегаттық күйі қалыпты жағдайда газ болса, су - сұйық, оның қайнау температурасы барлығынан да жоғары болуы да осы сутектік байланыс арқылы түсіндіріледі.
Зат молекулаларының ассоциациялануы сутектік байланыс әсерінен судан басқа да заттарда (аммиак, спирттер, сутегінің пероксиді, фторлы сутек, т. т. ) кездеседі.
Сутектік байланыстың молекула ішілік түріне белок молекулаларындағы пептидтік топтар (3-сурет) (а) және салицил альдегидіндегі (ә) топтар арасындағы сутектік байланысты келтіруге болады:

 а) ә)
а) ә)
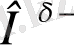
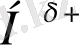
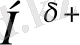
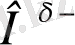


3-сурет.
Сутектік байланыс заттың кейбір физикалық қасиеттеріне: агрегаттық күйіне, балқу, қайнау температураларының көтерілуіне, тұтқырлығының артып, ұшқыштығының кемуіне, диссоциациялану дәрежесінің кемуіне, судағы ерігіштігіне әсер етеді. Мысалы спирттердің судағы ерігіштігі де олардың арасындағы болатын сутектік байланыс арқылы түсіндіріледі.

2. 2. Сутегі байланысының ерекшеліктері
Сутектік байланыстың арнайы желісі салыстырмалы түрде төмен күш болып табылады, оның энергиясы химиялық байланыс энергиясынан 5-10 бір аз. Энергия тұрғысында ол аралық күйді аралық химия байланыстары мен ван-дер-ваальды өзара әрекеттесу арқылы алады, бұл молекулаларды қатаң немесе су фазасында ұстайды. Осыған байланысты қатысушы серіктес - Атомның химиялық байланыс электрондарды кешіктіріп қабілеті - H-облигациялар қалыптастыру атомдарының electronegativity қатысушы шешуші рөл атқарады. Ad - HD +: D +, полярлық берілген химиялық бірлестігін льстивое - Нәтижесінде, өсіп electronegativity атом селективті теріс D- зарядын, және атом серіктес пайда болады. Мақтаулы селективті сутегі атомы нәтижесінде заряд оқыту жетекші үлесі H-облигациялар, электростатикалық өзара іс-қимылды тозады, ол, бұл жолды одан электроотрицательных материал бар басқа молекула тартуға мүмкіндік береді. Термин «сутекті байланыс» және R. Rodebush V. Latimer өте тұжырымдамасы су, спирттер, сулы HF және бір нәрсе кез-келген басқа да қосылыстардың жоғары қайнау жатқызуын мақсатында, бұл үшін, 1920 жылы енгізілді. су - бұл сериясы басқа мүшелерін құрылған бұл заңдарына басшылыққа алады қарағанда бұрқылдап әлдеқайда жоғары қайнау ұқсас қосылыстар H 2 O, H 2 S, N 2 Se және N 2 Te салыстыра отырып, олар осы сериясы бірінші мүшесі фактісі өзі қамқорлық жіберді. Осы заңдылықтан бастап судың нақты мағынадан 200 ° С төменгі қайнатылуы керек екендігі анықталды. NH 3 N 3 P, N 3 As, N 3 Sb: сөзбе, ол аммиак ұқсас қосылыстардың сериясы бар аномалия ғой. Қайнаудың нақты температурасы (-33 ° C) 80 ° C температурасында күтілетін мәннен жоғары қайнаған кезде су тек ван дер Waals өзара, шын мәнінде су фаза молекулаларды ретард сол арқылы жүргізіледі. Қайнау нүктесі кенеттен жоғары болған жағдайда, демек, молекулалар кейбір басқа күштермен қосымша түрде қосылған. Бұл жағдайда, бұл сутегі байланысы[3] .
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz