Химиялық байланыс теориясы: байланыс түрлері, энергиясы, ұзындығы және валенттік бұрышы


Абай атындағы қазақ ұлттық педагогикалық университеті
РЕФЕРАТ
Тақырыбы:Химиялық байланыс теориясы
Орындаған
Тексерген
Жоспар:
- Химиялық байланыс түрлері
- Ковалентті байланыс
- Польюсті/польюссіз байланыс
- Иондыққ байланыс
- Металдық байланыс
- Суттектік байланыс
- Байланыс энергиясы, ұзындығы, валенттілік бұрышы
Химиялық байланыс теориясы
Химиялық байланыстар - химиялық элементтер арасындағы тұрақты тепе-тең күйдегі жүйе жасауға келіп тірелетін (молекула, ион, радикал) электромагниттік әсерлесу жиынтығы. Химиялық байланыс - атомдардың химиялық қосылыс түзіп әрекеттесуі.
Ковалентті байланыс екі бейметалл атом арасында ортақтасқан электрондары болатын байланыс түрі. Химиялық байланыстың түзілуін электртерістілік ұғымын қолданып түсіндіруге болады.
Электртерістіліктері бірдей элемент атомдарының арасында (Н 2 , О 2 , N 2 , С1 2 ) байланыста болатын сутек молекуласының түзілу мысалында қарастырайык. Сутек атомының электрондық формуласы 1s 1 . Сутектің электротерістілігі 2, 1. S-электрондарының электрон бұлттары сфера (шар) тәрізді, олардың өзара әсерлесуін былай көрсетуге болады:
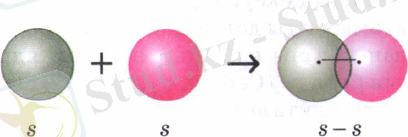
Cонда s электрондарының бұлттары өзара қабысып, екі электрон екі ядроға да ортақ, олардан бірдей қашықтықта орналасады. Бірдей атомдардың арасындағы байланыс полюссіз ковалентті байланыс деп аталады. Электрон бұлттары қабысуы нәтижесінде энергия бөлініп, молекула түзіледі. Бұл энергия шамасы молекуладағы байланыс беріктілігін сипаттайды, олай болса молекула жеке атомдарға қарағанда тұрақты жүйе болғаны.
Полюссіз ковалентті байланыста байланыстырушы электрон жұбының бұлты ядролардан бірдей қашықтықта орналасады.
Молекулалардың құрылымдық формулаларында бір электрон жұбына бір сызықшаға ( - ) сейкес келеді. Сутек атомдарының валенттіліктері I, себебі валенттілік байланыс түзуге жұмсалған электрондар санымен анықталады. Сутегі молекуласындағы элементтердің тотығу дәрежелері нөлге тең, себебі атомдардың электртерістіліктері бірдей, электрондар жұптары екі элемент ядросынан бірдей қашықтықта орналасады.
Енді оттегі молекуласындағы байланыстың түзілуін қарастырайық.
Оттек атомының электрондық формуласы 1s 2 2s 2 2p 4 , валенттілік электрондары 2s 2 2p 4 , электртерістілігі 3, 5.
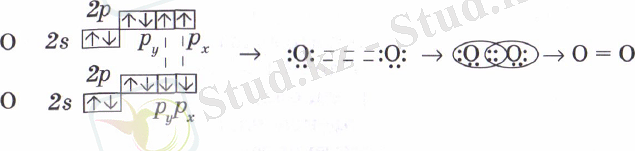
Электронды-графикалық формуласын қарасақ, валенттілік электрондар саны 6, оның екеуі дара күйінде, міне, осы электрондар екінші оттек атомындағы дәл осындай электрондармен екі жұп түзеді, яғни байланыс саны екі. Енді әр атом ядросын 8 электроннан айналатын болады. Сөйтіп, бұл мысалдан да көретініміз молекула түзілгенде аяқталған 8 электронды қабаттың пайда болуы.
Оттек атомдарының тотығу дәрежелері нөлге тең, валенттіліктері ІІ-ге тең болады. Еселі байланыс дара байланысқа қарағанда беріктеу болады.
Электрондардың электрон бұлттарының формаларын қолданып байланыстың түзілуін көрсетсек:
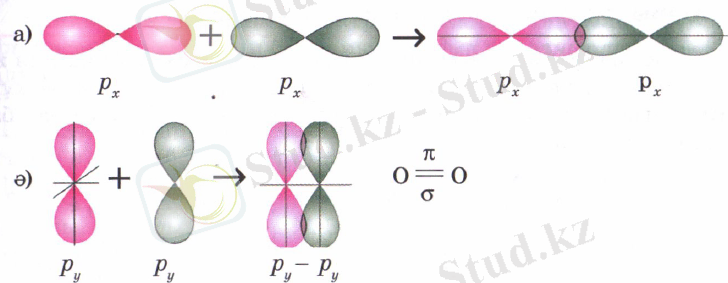
α - байланыс дегеніміз электрон бұлттарының қабысу ауданы ядролардың қосылу сызығының бойында жатқанда түзілетін байланыс (а) . Ал pi-байланыс - электрон бұлттарының қабысу ауданы ядроларды қосатын сызықтың екі жағында орналасқанда түзіледі.
Оттегі молекуласында атомдар бір-бірімен екі байланыспен байланысқан, оның бірі - α болса, екіншісінің - пи -байланыс екендігін байқайсыңдар.
Олай болса пи -байланыс, тек қайталанған байланыстарда болса, α -байланыс дара байланыс кезінде түзіледі.
Полюсті коваленттік байланыс дегеніміз байланыстырушы электрон жұбының бұлты электртерістігі басым элемент атомына қарай ығыса орналасқан байланыс.
Ковалентті Химиялық байланыста - әрекеттесуші атомдарға ортақ электрондар жұбы пайда болып, олардың санына қарай бір немесе бірнеше еселенген байланыстар түзіледі. Мысалы, сутек молекуласы атомдары арасында бір (Н:Н), оттек молекуласында қос (:О::О:), азот молекуласында үш (:N:::N:) еселенген ковалентті Химиялық байланыс бар. Ковалентті Химиялық байланыстар электрон жұбының атомдардың арасында орналасуына қарай полюсті және полюссіз деп екіге бөлінеді.
Полюсті молекулада Химиялық байланыс түзетін ортақ электрондар электр терістілігі күшті атомға ығыса орналасады. Молекуланың полюстілігі диполь моменті арқылы көрсетіледі. Полюстік молекулалардың қайнау және балқу температурасы төмен, полюсті еріткіштерде үйектеліп иондарға ыдырайды.
Полюссіз ковалентті Химиялық байланысты молекулада электрон жұбы атомға ауыспай, симметриялы түрде ортада орналасқан. Полюссіз Химиялық байланыстағы қосылыстардың қайнау және балқу температуралары төмен, полюсті еріткіштерде иондар түзбейді, электр тоғын өткізбейді. Ортақтаспаған электрон қосағынан және электронсыз бос орбитасы бар атомдардан (донар-акцепторлы) түзілетін сутектік және металдық Химиялық байланыстар координациялық байланыс деп аталады. Сутекті Химиялық байланыс - екі не бір молекуладағы атомдар арасында сутек атомының оң заряды арқылы түзіледі.
Иондық байланыс
Иондық байланыс катиондар мен аниондардың арасында электро-статикалық тартылу күшінің нәтижесінде пайда болады. Химиялық әрекеттескен атомдар 8 электронды тұрақты октет қабатқа ие болып, катион мен анионға айналу үшін олар күшті металдар мен бейметалдарға жатуы тиіс.
Иондық байланысқан қатты заттар иондық кристалдық торға ие болады. Сондықтан олар қатты, берік, қиын балқитын заттарға жатады. Иондық байланыс көбіне нағыз типтік металдардың оксидтері мен гидроксидтеріне және барлық тұздарға тән.
Әдетте, бір молекуланың ішінде байланыстың әр түрлі типтері кездеседі. Мысалы, күшті негіздерде (КОН, Са(ОН) 2 , т. б. ) металл катионы мен гидроксотоп арасында иондық, ал оттек пен сутек арасында коваленттік полюсті байланыс түзіледі. Отекті қышқылдардың тұздарында да (K 2 SО 4 , СаСО 3 , т. б. ) металл катионы қышқыл қалдығының анионымен иондық байланыспен байланысса, оттек пен бейметалл (С, S) арасында коваленттік полюсті байланыс түзіледі.
Жалпы алғанда, химиялық байланысты типтерге жіктеу шартты сипатқа ие. Өйткені олардың түпкі негізі бір. Мысалы, иондық байланысты коваленттік байланыстың шекті түрі деп қарау керек. Металдық байланыста коваленттік полюсті байланыстың да, иондық байланыстың да элементтері бар. Көптеген заттарда "таза" бір ғана химиялық байланыс типі бола бермейді. Мысалы, ас тұзы - натрий хлориді иондық байланысты қосылыстарға жатады. Іс жүзінде оның 84% байланысы иондыққа, қалған 16%-і коваленттіге тиесілі. Сондықтан химиялық байланыстың полюстік дәрежесін біліп тұрып, нақты қай типке жататынын сөз еткен дұрыс.
Егер галогенсутектер қатарындағы байланыстың полюстік дәрежесінің өзгеруіне келсек, фторсутектен астатсутекке қарай: HF→HCl→HBr→HI→HAt төмендейді. Себебі галоген мен сутектің электртерістіктерінің айырмашылығы азая түседі де, ақыры астатсутекке жеткенде байланыс полюссіз коваленттіге жуықтайды.
Химиялық байланыстың барлық типтері мен түрлерінің негізі бір болатыны - олардың бәрінің де табиғаты электрондық бұлттардың тығыздығының өзгеруіне тәуелді. Химиялық байланыстың түзілуі кез келген жағдайда электрондық-ядролық әрекеттесудің арқасында, осы кездегі энергия ұтысының (бөлінуінің) нәтижесінде іске асады. Оны барлық химиялық байланыс типтерінің белгілерін өзара салыстырғанда байқаймыз.
Металдық байланыс
Металдың кристалдық торының түйіндерінде атомдар немесе олардың иондары орналасатыны белгілі. Металдық тордағы бостау күйдегі делокальданған электрондар көптеген ядролардың арасында өзара тарту күштерін тудырып, металдық байланыс түзеді. Металдардың сыртқы деңгейіндегі валенттік электрондар саны аз болатындықтан, олардың иондарға айналуы қиын емес: Me - ne - → Ме +n
Мұндай қабілетті металдар бос күйде де, химиялық әрекеттесу кезінде де көрсетеді. Бос күйдегі металдың белгілі физикалық қасиеттері: электр- және жылуөткізгіштігі, қаттылығы, иілімділігі, созылғыштығы, өзіне тән жылтыры, т. б. булардың барлығы металдық байланысқа тәуелді.
Металдардың валенттік электрондары өз ядросымен нашар байланысқан. Сондықтан, бір-бірінен оңай ажырайды және металда теріс иондар қатары қалыптасады. Бұл иондар кристалдық торда орналасқан және электрондардың көбісі бүкіл кристалл бойынша жылжи алады. Металдың электрондары бүкіл металдағы атомдарды байланыстырады.
Металдағы электрондар(валенттік электрондар) газ бен кристалдық торлардағызарядталған иондардың арқаумен бір-бірімен әрекеттесуіне себепші болған - химиялық байланыс. Металдық байланыстың идеалды моделі металдың валенттік электрондармен жарым-жартылай топтастырылған энергетикалық аймағының (өткізу қабілеті бар зонасы) пайда болуына сәйкес келеді. Металдарды құрастыратын атомдардың жақындасуымен валенттік электрондардың атомдық орбиталдары, түйіндес қоспаның делокализдалған p-орбиталдар сияқты, кристалдық торлар бойынша делокализдалған p-орбиталдарға айналады. Металдық байланыстыңсандық сипаттамасы квант механикасымен ғана бола алады. Сапалық сипаттаманы коваленттік байланыстың ұғымымен түсінуге болады.

Металдың екі атомы жақындасқанда, мысалы Li, коваленттік байланыс пайда болады, сонымен валенттік электрондың әр энергетивтік деңгейі екіге бөлінеді. Li атомдардың N саны кристалдық торларды жасаған кезде, көрші атомдардың электрон бұлттарының қайта жабуы валенттік электрондың әр энергетикалық деңгейі N деңгейлерге бөлінеді. Деңгейлердің саны көп болғандықтан, олар бір-біріне жақын орналасқан. Сол үшін оларды энергетикалық деңгейлердің бөлінбейтін, әрі ақырғы ені бар, бір зонасы деп есептеуге болады. Валенттік электронлардың саны бірдей болған екі атомдық молекуламен салыстырғанда, әр атом көп байланыстардың пайда болуына үлес қосып жатады. Сондықтан, жүйенің энергиясының минимумы (немесе байланыстың максимумы) молекуладағы екі центрлік байланысына қарағанда, үлкен қашықтыққа жете алады.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz