Периодтық жүйе I периодындағы бейметал - сутек: изотоптары, қасиеттері және оқыту әдістемесі


Қазақстан Республикасының білім және ғылым министрлігі
“Мирас университеті”
Курстық жұмыс
Тақырыбы: Периодтық жүйедегі бірінші периодта орналасқан бейметалдар қасиеттерін оқыту әдістемесі
Орындаушы: Сман А. Д
Тобы: ХБ-911 К-2
Жетекшісі: Сапарбеков А
Шымкент қаласы 2021 ж
Мазмұны:
Кіріспе . . . 3
I-Бөлім. Изотоп сутегі нейтрон .
- Сутек элементіне қысқаша шолу . . . 4
- Сутегі изотоптары . . . 6
- Изотоптық әсерлер . . . 9
- Сутектің ең жеңіл изотопы . . . 10
- Дәлдік- ең алдымен . . . 11
- Жеңіл су . . . 12
- Қадір-қасиетін протиев суы . . . 13
- Жеңіл су алу . . . 14
II-Бөлім. Сутек элементі жайлы қызықты мәліметтер.
2. 1. Дейтерийдің пайда болуы . . . 15
2. 2. Протия мен дейтерийдің қасиеттеріндегі айырмашылық . . . 17
2. 3. Ядролық зерттеулердегі Дейтерий . . . 18
2. 4. Сутектің аса ауыр изотопы . . . 20
2. 5. Тритийдің радиациялық қауіптілігі . . . 21
2. 6. Трития туралы көбірек . . . 22
2. 7. Термоядролық синтездегі Тритий . . . 23
Қорытынды . . . 25
Пайдаланылған әдебиеттер . . . 26
Кіріспе
Жұмыстың жалпы сипаттамасы. Студенттің ғылыми еңбегі- курстық жұмыс.
Жұмыстың мақсаты. Студенттерге сутел элементінің адам өміріндегі маңызын, түрлерін, пайда болуын түсіндіру. Студенттің берілген материалды қандай деңгейде түсінгенін бақылау және бағалау.
Жұмыстың өзектілігі. Сутек (латынша Hydrogenium; H ) - эле-менттердің периодтық жүйесінің IA тобындағы химиялық элемент, атомдық нөмірі 1, атомдық молекуласы 1, 00797.
Сутекті алғаш Г. Кавендиш зерттеп, оны «жанғыш ауа» деп атаған (1766) . А. Лавуазье сутектің қасиеттерін зерттеп, химиялық элемент-тер тізіміне қосыпты (1787) . «Сутек» терминін орыс химигі- М. Ф. Соловьев ұсынды (өз тілінде, 1824) .
Сутекті алғаш рет мырышпен тұз және күкірт қышқылын- әрекеттестіру аркылы 1776 жылы Г. Кавендиш алған. Ол оған «жанғыш ауа» деген ат берген, себебі ол жай заттардың арасындағы өте жанғыш газ. Ал 1783 жылы А. Лавуазье мен Ж. Менье суды термиялық айырып, ол оттек және сутек элементтерінен тұратынын анықтаған, казіргі колданылып жүрген атауын ( Hydrogenium- су тудырушы ) француз ғалымы А. Штон де Морво берген (1787 жылы) . Оның орысша да, қазақша да аттары осы мағынаны білдіреді.
Жұмыстың орындалу тәртібі:
- Тақырыпты таңдау;
- Әдебиеттерді іріктеу және үйрену;
- Жұмыс жоспарын құрастыру;
- Нақты материалдарды жинау мен жетілдіру;
- Курстық жұмысты жазу;
- Курстық жұмысты рәсімдеу (оформление) ;
- Курстық жұмысты қорғау.
I-Бөлім. Изотоп сутегі нейтрон.
- Сутек элементіне қысқаша шолу.
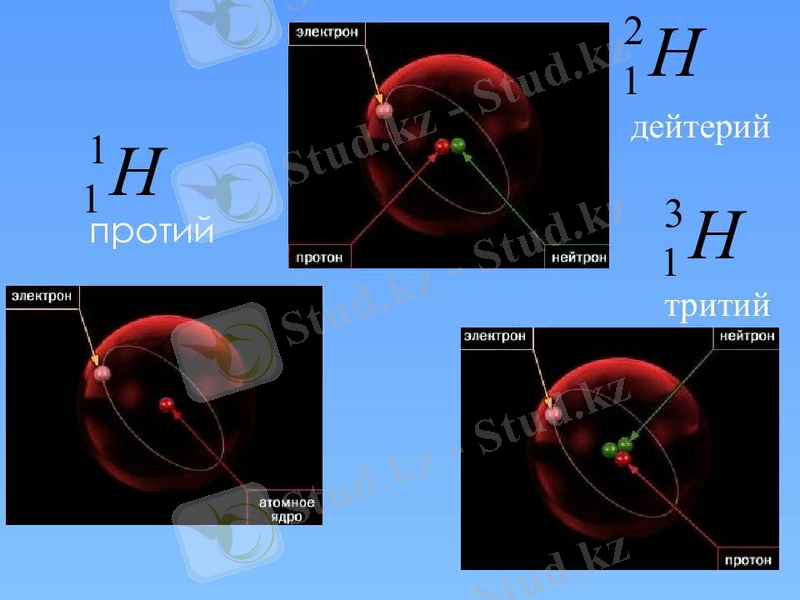
Сутегі үш изотоп түрінде кездеседі, олардың жеке атаулары бар: протий, дейтерий және тритий. Сутегі изотоптарының атомдары ұқсас емес. Протий-бұл ерекше элемент, Өйткені оның ядросында нейтрондар жоқ. Егер ядрода нейтрон пайда болса, онда мұндай сутегі дейтерий деп аталады. Дейтерий қосылыстарын қарапайым сутегі бар затпен аралас-тыру арқылы көптеген реакциялардың жолдарын, табиғатын және меха-низмін зерттеуге болады. Бұл әдіс биологиялық және биохимиялық реакцияларды, мысалы, ас қорыту процестерін зерттеу үшін қолданы-лады. Сондай-ақ, дейтерий атом энергетикасында ядролық реактор-ларда нейтрон модераторы ретінде кеңінен қолданылады; тритиймен немесе литий-6 қосылысымен сутегі бомбаларында термоядролық реакция үшін қолданылады; зертханалық зерттеулер мен техникада таң-баланған тұрақты индикатор ретінде қолданылады. Басқарылатын тер-моядролық синтезді жүзеге асыру үшін қажетті Жоғары температуралы Плазма алу үшін дейтерийді (тритий қосылған қоспада) қолдану да перспективалы болып табылады.
Тұрақты дейтерийден айырмашылығы, тритий радиоактивті және жартылай шығарылу кезеңі 12, 26 жыл. Тритий және металл тритидтері атом энергиясын алу үшін қолданылады; мысалы, сутегі бомбасында термоядролық синтездің келесі реакциясы жүреді:
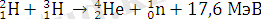
Зерттеудің мақсаты-сутегі изотоптарының планета мен адамдар өміріндегі рөлін қарастыру және талдау. Бұл үшін егжей-тегжейлі түсіну сол немесе өзге мәселе.
Сутегі-әлемнің ең көп таралған элементі. Бұл күннің, жұлдыз-дардың және басқа ғарыштық денелердің негізгі бөлігін құрайды. Жұлдыдардың ішектерінде олардың эволюциясының белгілі бір кезең-інде сутектің қатысуымен әртүрлі термоядролық реакциялар жүреді. Олар жұлдыздардың ғарыш кеңістігіне шығаратын сансыз энергия көзі болып табылады. Жердегі сутектің таралуы айтарлықтай ерекшеленеді. Жер бетіндегі еркін күйде ол салыстырмалы түрде сирек кездеседі-ол мұнай мен жанғыш газдарда кездеседі, кейбір минералдарда қоспалар түрінде болады. Сутектің белгілі бір мөлшері Органикалық заттардың микроорганизмдермен ыдырауы нәтижесінде атмосферада үнемі пайда болады, бірақ содан кейін сутегі жеңілдігіне байланысты стратосфераға тез ауысады. Жер қыртысындағы сутектің негізгі бөлігі басқа элемент-термен химиялық қосылыстар түрінде болады: оның көп бөлігі су, саз және көмірсутектер түрінде болады; соңғысы мұнайдың негізін құрайды және оның құрамдас бөлігі болып табылады.

- Сутек изотоптары
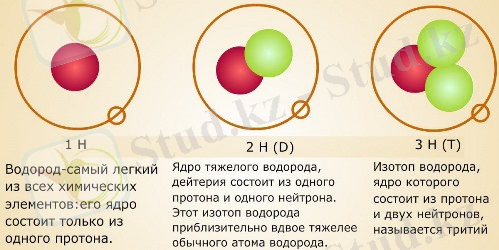
Сутегі изотоптары-ядрода нейтрондардың мөлшері әр түрлі болатын сутектің химиялық элементінің атомдарының (және ядроларының) түрлері.
Кесте-1.
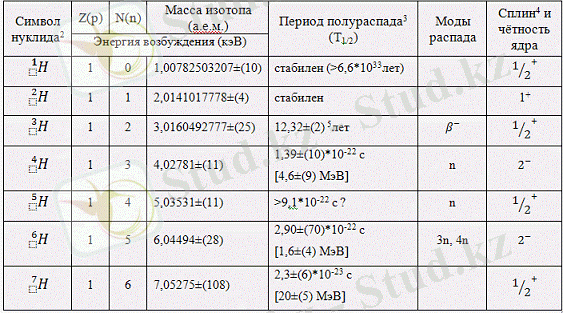
Сутегі жеке атаулары бар үш изотоп түрінде кездеседі:
1) - протий (Н) ;
2) - дейтерий (D) ;
3) - тритий (т; радиоактивті) .
Әдебиетте 4-7 массалық сандары бар сутегі изотоптары және жартылай шығарылу кезеңдері 10-22 - 10-23 с. сутектің екі изотопы жа-санды түрде алынды: және, бірақ олар өте тұрақсыз. Протий және дей-терий ядролары тұрақты. Тритий радиоактивті: электронды шығарып, ол жартылай шығарылу кезеңі 12, 26 жыл болатын жеңіл гелий изотоп-ына айналады. Изотоптардың табиғи қоспасында протий басым (99, 985%), дейтерийдің массалық мөлшері аз (шамамен 0, 015%), тритийдің мөлшері шамалы.
Сутектен басқа барлық элементтердің изотоптарының физикалық жә-не химиялық қасиеттері бірдей: ядролары бірнеше протондар мен ней-трондардан тұратын атомдар үшін онша маңызды емес - бір нейтрон аз немесе бір нейтрон көп. Бірақ сутегі атомының ядросы-бір протон, егер оған нейтрон қосылса, ядро массасы екі есе, ал егер екі нейтрон үш есе артады. Сондықтан жеңіл сутегі (протий) минус 252, 6°C температурада қайнайды, ал оның изотоптарының қайнау температурасы осы мәннен 3, 2° (дейтерий) және 4, 5° (тритий) ерекшеленеді. Изотоптар үшін бұл өте үлкен айырмашылық!
Изотоптық эффект деп аталатын қасиеттердің шамалы айырмашы-лықтары изотоптық атомдар массаларының айырмашылығына байла-нысты, бұл ең алдымен молекулалар мен қатты денелердегі изотоптар-дың тербеліс жиілігіне әсер етеді. Сонымен, тритий мен дейтерий моле-кулаларының тербелмелі энергиясы протийге қарағанда аз. Бұл, өз кезе-гінде, термодинамикалық қасиеттерге әсер етеді: жылу сыйымдылығы, балқу және қайнау температурасы, балқу және булану энтальпиясы, қаныққан бу қысымы және т. б. сонымен, дейтерий қарапайым сутегімен салыстырғанда жылу сыйымдылығы, жылу өткізгіштік және диффузия жылдамдығына ие. Осылайша, изотоптық қосылыстар термодинамика-лық теңсіздікпен сипатталады. Соңғысы химиялық реакциялардағы белсенді кешендердің теңсіздігіне әкеледі, нәтижесінде реакциялар жылдамдығында айырмашылық бар, яғни кинетикалық изотоптық әсер байқалады. Ол әр түрлі изотоптық қосылыстар үшін химиялық реакциялар жылдамдығының тұрақтыларының қатынасы арқылы көрінеді.
Кесте-2.
Балқу Қайнау Үш нүкте Сыни нүкте Cұйық газ
темпера-сы темпера-сы k/kPa K/Pka тығыздығы, кг/м 3
H2 13, 96 20, 39 13, 96/7 32, 98/1, 31 70, 811/1, 316
HD16. 65 22, 13 16, 6/12. 8 35, 91/1, 48 114, 0/1, 802
HT 22, 92 17, 63/17, 7 37, 13/1, 57 158, 62/2, 31
D218. 65 23, 67 18, 73/17, 7 38, 51/1, 67 162, 50/2, 23
DT 24, 38 19, 71/19, 4 39, 42/1, 77 211, 54/2, 694
T2 20, 63 25, 04 20, 62/21, 6 40, 44/1, 85 260, 17/3, 136
Дейтерий мен тритийдің де орто - және парамодификациясы бар: p-D2, o-D2, p-T2, o-T2. Гетероизотоптық сутектің (HD, HT, DT) орто - және парамодификациясы жоқ.
Сутегі үшін, басқа элементтер сияқты, изотоптық массалардың са-лыстырмалы айырмашылығы айтарлықтай мәнге жетеді. Сондықтан бар-лық изотоптар бірдей электронды құрылымымен ерекшеленсе де, олар физикалық жағынан ғана емес, химиялық қасиеттерімен де айтарлықтай ерекшеленеді. Протийдің күрт басым болуына байланысты ауыр изотоп-тардың әсері шамалы әсер етеді және оны өте дәл эксперименттерде ғана жазуға болады. Сондықтан, үлкен қателіксіз табиғи сутектің қасиеттері таза протийден тұратын жүйенің қасиеттеріне сәйкес келеді деп болжауға болады.

- Изотоптық әсерлер
Көптеген жылдар бойы дейтерий және жақында тритий таңбаланған атомдар ретінде кеңінен қолданыла бастады. Бұл таңбаланған атом-дарды қолданудың ыңғайлылығы массадағы немесе радиоактивтілік-тегі айырмашылықтар оларды анықтауға және бөлуге мүмкіндік беретіндігі-мен түсіндіріледі, ал химиялық тұрғыдан олар қарапайым сутегі атом-дарына ұқсас. Көптеген элементтер үшін ядро массасының бір немесе бірнеше бірлікке өзгеруі Атом салмағының өте аз пайыздық өзгеруіне әкеледі, бұл ядро массасының заттың химиялық әрекетіне жанама әсерін ғана анықтайды, бірақ изотоптар арасындағы химиялық айырмашылық-ты анықтау мүмкін емес. Алайда, B, C, N және әсіресе N-нің ең жеңіл элементтері үшін бір элементтің әртүрлі изотоптары бар заттармен реак-циялар аз, бірақ әр түрлі жылдамдықпен жүреді. Көбінесе бұл реакция механизмдерін егжей-тегжейлі зерттеуде жақсы нәтиже береді. Биоло-гиялық жүйелердегі дейтерийді сутегімен алмас-тыру жұқа тепе-теңдік процестерін айтарлықтай өзгерте алады. Дейтерий жағдайында бұл айырмашылық жоқ.
- Сутектің ең жеңіл изотопы
Протий-сутектің ең жеңіл изотопының атауы, символмен көрсетілген . Протий ядросы бір протоннан тұрады, сондықтан изотоптың атауы
Кесте-3
Нуклеиттің қасиеттері
Атомдық масса
Артық массасын 7 288, 97050(11) кэВ
Байланыстың меншікті энергиясы (нуклонға) 0, 0 (0) кэВ
Изотоптық таралуы 99, 9885 (70) %
Жартылай шығарылу кезеңі тұрақты
Сплин және ядро паритеті
Протий сутегі атомдарының жалпы санының 99, 9885±0, 0070% құрайды және барлық химиялық элементтердің изотоптары арасында табиғатта ең көп кездесетін нуклид болып табылады. Болып табылады емес, металмен. Қалыпты жағдайда ол әрдайым газ тәрізді күйде келеді, түсі, дәмі мен иісі жоқ, бірақ қаласаңыз, сутекті сұйытылған немесе қатайтылған күйге келтіруге болады, бірақ бұл өте төмен температура мен өте жоғары қысымды қажет етеді.
- Дәлдік ең алдымен.
Сутектің жеңіл изотопының салыстырмалы массасы дәл дәлдікпен анықталады: 1, 007276470 (егер 12С көміртегі изотопының массасы 12, -ға тең болса) . Егер дәл осындай дәлдікпен өлшенген болса, мысалы, экватордың ұзындығы, онда қате 4 см-ден аспайды!
Бірақ мұндай дәлдік не үшін қажет? Өйткені, әрбір жаңа Сан тәжірибе жасаушылардан көп күш-жігерді талап етеді . . . Құпия жай ашылады: протия ядролары, протондар, көптеген ядролық реакцияларға қатысады. Егер реакция ядроларының массалары мен реакция өнімдерінің массалары белгілі болса, онда формуланы қолдана отырып, оның энергетикалық әсерін есептеуге болады. Тіпті ядролық реакциялардың энергетикалық әсерлері массаның шамалы өзгеруімен бірге жүретіндіктен, бұл массаларды мүмкіндігінше дәл өлшеу керек.
- Жеңіл-су
Протий бар су " жеңіл су" деп аталады, өйткені протий арқылы жеңіл сутегімен байытылған су мобильді, өміршең болады. Судағы Протий крис-талды торды өзгертеді, молекулалық деңгейде мұндай су дененің әр жасу-шасына өзінің барлық пайдалы қасиеттерін қалдықсыз береді, мұндай су-дың ерігіштігі жоғары, биохимиялық реакциялардың жылдамдығын артты-рады, метаболизм процесін тездетеді, нәтижесінде ол бүкіл денеге қалып-қа келтіретін әсер етеді.
Табиғи судың негізгі бөлігін (99% - дан жоғары) протий суы құрайды.
Протий суының молекуласы сутегі атомдарынан тұрады, олардың әрқайсысының атомдық салмағы бірлікке тең және атом салмағы 16 бірлікке тең оттегі атомы бар .
Табиғи жағдайда таза болмайды. Бүкіл әлемде мұндай суды бірнеше арнайы зертханалардан табуға болады. Ол өте күрделі жолмен алынады және ең үлкен сақтық шараларын сақтайды. Таза суды алу үшін табиғи суларды өте жұқа, көп сатылы тазарту жүргізіледі немесе суды бастапқы элементтерден синтездейді және олар изотоптық қоспалардан мұқият тазартылады.
Изотоптық деңгейде қоспасы бар протикалық (еріген) суды үйде алуға болады. Мұны істеу үшін кәдімгі ағынды су мұздату мен ерудің бірнеше кезеңінен өтуі керек. Кәдімгі судың құрамында бірнеше изомерлер бар (тритий, дейтерий, протий), бұл процесс қолайсыз (тритий және дейтерий) құтылуға және біздің ағзамыз "жақсы жұмыс істейтін" - протийді таңдауға көмектеседі.

- Қадір-қасиетін протиев суы
Еріген су биологиялық белсенді. Ол ағзадағы зат алмасуды ынта-ландырады, токсиндер мен токсиндердің жақсы шығарылуына ықпал етеді, сіңіру үшін аз энергияны қажет етеді.
Еріген суды үнемі тұтыну дененің сауығуына және жасаруына ықпал етеді. Мұндай сумен жуудан тері жібекке қарағанда жұмсақ болады, ал шашты жақсырақ жуады және тарайды.
Қадір-қасиетін протиевой су:
¾он үйде мүмкіндігінше қоспалардан тазартылады.
¾он ауыр Судан (ауыр сутегі атомдарындағы молекулалар - дейтерий) тазартылған, оның қоспалары кез-келген суда, тіпті бөтелкеде де болуы мүмкін. Ауыр су денсаулыққа жақсы әсер етпейтіні белгілі.
¾протикалық су күнделікті қолдану үшін минералды тұздармен қанықтыру үшін оңтайлы.
¾конец, протий суының ең маңызды артықшылығы-ол құрылымдалған. Оның құрылымы ағзадағы судың құрылымына мүмкіндігінше жақын. Бұл еріген су, таза, көз жасы сияқты, ұзақ өмір сүретін тау өзендерінің хрустальды суы сияқты.

- Жеңіл су алу
Міне, мамандар протикалық суды қалай алуға кеңес береді:
. Ыдысқа құйылған Ағын суды одан хлор шығару үшін 6-8 сағат бойы қорғау қажет. Ыңғайлы болу үшін контейнер ретінде қарапайым пластикалық ПЭТ бөтелкелерін қолданған дұрыс.
. Содан кейін суды тоңазытқышқа салыңыз және мезгіл-мезгіл алғашқы мұздың пайда болуын бақылаңыз.
. Алғашқы мұз-ауыр су, мұндай судың қату температурасы 3, 8? көбірек, яғни ауыр су немесе дейтерий тезірек қатып қалады. Сұйық күйде қалған суды мұздан бөлу үшін оны басқа контейнерге құю керек.
. Осыдан кейін мұз лақтырылады, ал бөлінген су қайтадан мұздатуға салынып, резервуардың жартысынан көбін алатын, бірақ 2/3 аспайтын мұздың пайда болуын күтеді.
. Осыдан кейін сұйық күйде қалған су ағызылады, бұл қоспалары бар жеңіл су. Мұз-бұл қоспалардан тазартылған протикалық су, биологиялық процестердің жүруіне ең қолайлы.
Дейтерий - ауыр сутегі
Дейтерий-ядросы бір протон мен бір нейтроннан тұратын екі тұрақты сутегі изотоптарының бірі. D және таңбаларымен белгіленеді . Атомдық массасы 2-ге тең. D2 молекуласы диатомды. Табиғи сутектің құрамы-0, 012-0, 016%. Балқу температурасы-254, 5°C, қайнау температурасы-249, 5°C.
II-Бөлім. Сутек элементі жайлы қызықты мәліметтер.
2. 1. Дейтерийдің пайда болуы
Онымен жақынырақ танысу үшін сутегі изотоптарын бөлудің тиімді тәсілдерін жасау керек болды. Бұл Э. в. Уошборн мен Г. Юри өнеркәсіп-тік электролизер ваннасындағы ескі суды зерттеп, оның құрамында қа-рапайым суға қарағанда дейтерий көп екеніне көз жеткізуден басталды. Түсініктеме тез табылды: судың оттегі мен сутекке ыдырауы кезінде протийдің жеңіл изотопы негізінен шығарылады, дейтерий оттегімен тығыз байланысты. Осылайша, осы ерекше изотопты білудің бірінші кезеңінде оның қарапайым сутектен маңызды химиялық айырмашылықтарының бірі байқалды .
Сутегі изотоптарын бөлудің электролиттік әдісі Екінші дүние-жүзілік соғысқа дейінгі жылдары негізгі болды.
Енді осы әдісті қолдана отырып, құрамында 99, 9% дейтерий бар су алынады. D2O ауыр суы протий мен дейтерий суын біртіндеп немесе дәлірек бөлу арқылы алынады. Әдетте 5-7 қадам.
1934 жылы Норвегиялық "Норск Гидро" компаниясының зауыты күн сайын он литр ауыр су шығарды. Тоғыз жылдан кейін, фашистер басып алған Норвегияда бұл өндіріс және онымен бірге 1300 кг ауыр су қарсылық батырларымен жойылды. Одақтас бомбалаушылар бұл істі аяқтады. Сол кезде ауыр судың атом қаруын жасаудағы рөлі белгілі болды. Дейтрон, Протоннан айырмашылығы, нейтрондарды нашар сіңіреді, бірақ оларды жақсы баяулатады. Ауыр су Атом реакторлар-ындағы нейтрондардың тамаша модераторы болып табылады . . .
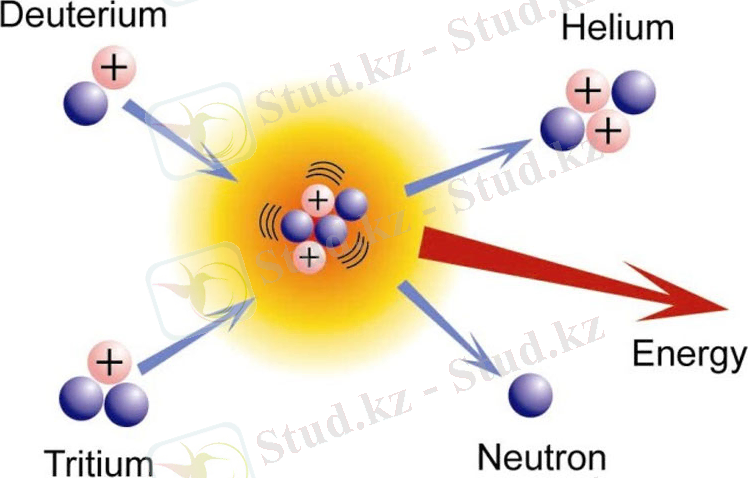
Соғыс уақытында дейтерий өндірудің арзан, тым көп энергияны қажет етпейтін әдістерін жасау маңызды болды. Изотоптық алмасу ре-акцияларына негізделген ауыр су алу әдістері ең ұтымды болды. Соны-мен, су мен сутегі газы арасындағы тепе-теңдік кезінде сұйықтық-та газ фазасына қарағанда дейтерий үш есе көп болады. Рас, тепе-теңдік тым баяу орнатылады. Дейтерийдің көп мөлшерін өндіруде арнайы ката-лизатор мәселені шешеді. Екі қарама - қарсы ағын толтырылған мұнара арқылы қозғалады: жоғары - сутегі мен су буының қоспасы, төмен-су. Газ фазасы, бу, дейтериймен байытылған, содан кейін конденсация-ланады және су ағынымен тасымалданады. Мұнараның түбінен дейтериймен байытылған су ағып жатыр. Осындай бірнеше мұнаралардың каскады жеткілікті концентрацияланған ауыр су береді.
Дейтерий алу үшін тиімді және су мен күкірт сутегі арасындағы изотоптық алмасу реакциясы.

2. 2. Протия мен Дейтерийдің қасиеттеріндегі айырмашылық
Дейтерийдің ашылуы бір элементтің изотоптарындағы химиялық қасиеттердің толық сәйкестігі туралы түсініктерді өзгертті. Бұл айырма-шылықтар болмаса, изотоптарды химиялық әдістермен бөлуге болмай-ды. Протий мен дейтерий қосылыстары қатысатын кейбір реакциялар-дың жылдамдығы 5-10 есе өзгереді. Тірі организмдер ауыр суға-дейтер-ий тотығына айтарлықтай әсер етеді. Отызыншы жылдардың басында концентрацияланған (80-100% D2C) ауыр судың уыттылығы сенімді түрде орнатылды, дегенмен, олар айтқандай, г. Юри бір кездері концен-трацияланған ауыр судың толық стаканын ішкен және бұл оған әсер еткен жоқ. Дейтерий тотығының бір дозасы салыс-тырмалы түрде зиян-сыз болып көрінеді. Протий мен дейтерийдің, қара-пайым және ауыр судың физикалық қасиеттеріндегі айырмашы-лықтар да айтарлық-тай маңызды. Протийдің қайнау температурасы 20, 39°К, дейтерий-23, 57°к, тритий (бұл туралы алда айтылған) - 24, 90°к. ауыр су 3, 82°С температурада қатып қалады, қайнайды - 101, 42°с.
"" - сондықтан, дерлік өлеңдер ауыр жарнамалайтын.
Ауыр судың керемет баяулататын қасиеттері дейтерийдің ядролық сипаттамасымен толығымен анықталады. Баяу нейтрондар дейтрон-дармен дерлік сіңірілмейді, ал жылдам нейтрондар бір соқтығысуда кинетикалық энергиясының 52% жоғалтады. Дейтерий атомдарымен тек 25 соқтығысу және ауыр ядроның бөлінуімен босатылған нейтрон (мысалы, уран ядросы) жылуға айналады. Графит үшін соқтығысу-лардың ұқсас саны 114 құрайды. Кәдімгі суда қажетті баяулауға 18 соқтығысудан кейін қол жеткізіледі, бірақ протий дейтерийге қарағанда 700 есе күшті жылу нейтрондарын сіңіреді.
Ядролық реакция қалыпты, айталық, құдық суға түсуі үшін 235-уранмен байытылған уран қажет.
2. 3. Ядролық зерттеулердегі Дейтрий
Ядролық физиканың кез - келген оқулығында сіз дейтронға арналған жеке тарауды таба аласыз, өйткені бұл ядро екі нуклонның жалғыз бай-ланысқан күйі болып табылады. Бұл ядролық материяны зерттеуге, ядрода әрекет ететін күштерді білуге арналған тамаша объект. Нейтрон-дық-Протонды гантель-тек екі дененің кванттық механикалық жүйесі. мұндай жүйе, көптеген бөлшектері бар жүйелерден айырмашылығы, жақсы есептеледі және теориялық идеялар мен эксперименталды түрде анықталған фактілерді салыстыру үшін өзіндік субмикроскопиялық полигон ретінде қызмет етеді.
Дейтронды зерттеу өте жемісті болды. Оның ядролық сипаттама-ларынан ядролық күштердің табиғаты туралы - олардың әрекет ету радиусы туралы, бөлшектердің өзара әрекеттесу сипатының олардың айналуының өзара бағытына тәуелділігі туралы іргелі тұжырымдар алынады.
Дейтрон-әлсіз байланысқан жүйе. Егер дейтрон нысаны жеткілікті күшті гамма-кванттармен сәулелендірілсе, квант әсерінен гантель про-тон мен нейтронға ыдырайды. Дәл осы жолмен дейтериядағы Протон-ның нейтронмен байланысы алғаш рет өлшенді. Ол кішкентай болып шықты-барлығы 2, 23 МэВ. Күрделі ядроларда бөлшектер шамамен жеті есе күшті болады.

Нуклондардың әлсіз байланысының арқасында дейтерийді бөліп, 0, 1-ден 1 МэВ-ге дейінгі энергиясы бар нейтрондардың моноэнергетикалық ағындарын алды (және алады) . Егер сіз электростатикалық түтікте жыл-дамдатылған дейтрондармен бомбаласаңыз, сол дейтерийдің қосылыс-тарынан нысана 2-ден 6 МэВ-қа дейінгі энергиясы бар нейтрондар ұша-ды. Екеуі де нейтрондық физиканың маңызды құралы. Дәл осы ней-трондар атом энергетикасының бірінші кезеңіндегі көптеген зерттеу-лерде қолданылды. Олардың көмегімен көптеген маңызды ядролық константалар өлшенеді.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz