Атом құрылысының тарихы мен теориясы


ҚАЗАҚСТАН РЕСПУБЛИКАСЫ БІЛІМ ЖӘНЕ ҒЫЛЫМ
МИНИСТРЛІГІ ОҢТҮСТІК ҚАЗАҚСТАН МЕМЛЕКЕТТІК ПЕДАГОГИКАЛЫҚ
УНИВЕРСИТЕТІ
РЕФЕРАТ
Тақырыбы: Атом құрылысы
Тапсырушы:Усмантаев Асадбек
Тобы:1507-31
Қабылдаушы: доцент-Керимбаева К. З.
Шымкент-2021
Жоспар:
- КіріспеАтом тұралы мәлімет . . . 3
- Негізгі бөлімАтом ашылу тарихы . . . 5Атом планетарлық моделі . . . 6Атом құрылымы . . . 8
- Қорытынды . . . 10
- Пайдаланылған әдебиеттер . . . 11
Атом - материяны құрайтын химиялық элементтердің өзіне тән химиялық қасиеттерін сақтайтын ең кіші бөлшегі. Грекше atomos - бөлінбейтін деген ұғымды білдіреді. Атом - бүтіндей алғанда зарядсыз, бейтарап бөлшек. Ол ортасында өзінен радиусы 10 4 - 10 5 есе кіші көлемді алып жатқан оң зарядты ядродан және оны айнала қозғалып жүрген теріс зарядты электрондардан тұрады. Атом өзінің сыртқы бір немесе бірнеше электрондарын жоғалтқанда оң, ал сырттан электрон қосып алғанда теріс ионға айналады. Атомның сызықтық өлшемдері ~10 - 8 см, көлденең қимасының ауданы ~10 - 16 см 2 , көлемі ~10 - 24 см 3 . Бордың атом теориясында ең қарапайым атом - сутек атомы. Оның радиусының дәл белгілі бір мәні бар және ол мүмкін болатын ең кіші айналу орбитасының радиусы шамасына тең: а = 0, 53Һ10 - 8 см (дәлірек, 0, 52917Һ10 - 8 см) . Атомның массасы негізінен оның ядросының массасына тең және ол массалық санға (атом), яғни протондар мен нейтрондардың жалпы санына (нуклондардың жалпы санына) пропорционал болып ұлғаяды. Атом массасы ядро массасымен ондағы электрондар массаларының дәл қосындысына тең емес. Олардың арасындағы айырым атомның байланыс энергиясын анықтайды. Атомның ішкі энергиясының тек дискретті (үздікті) мәндері ғана болады. Атом энергиясының дискретті квантталуы оның құрамындағы бөлшектердің толқындық қасиетінің болуынан атомның осындай қасиеттерін кванттық теория ғана толық түсіндіре алады. Бұл теория бойынша атомдағы электронның күйі 4 кванттық санмен анықталады. Олар: электрон энергиясын анықтайтын бас кванттық сан (n) , атомның импульс моментін анықтайтын, орбиталық кванттық сан (l) , ал l -дің күйлерін сипаттайды. Сонымен бірге кванттық теорияда микробөлшектердің сол 4 кванттық сан анықтайтын күйлерін толқындық функциямен ( φ ) өрнектейді. Ол функцияның квадраты ( φ ) 2 бөлшектердің кеңістік нүктелерінде болу ықтималдығын білдіреді. Кеңістіктегі электрон бұлтының тығыздығы осы ықтималдыққа пропорционал. Кванттық сандардың мәндеріне сәйкес атомдардағы қабықшалар мен қабаттар рет-ретімен толтырылып отырады. Осылайша элементтердің Менделеев кестесіндегі орны анықталады. Алдымен ең кіші n =1 қабат толтырылып, онда болғаны 2 электрон ғана орналасады. Онан кейін n =2 қабат толтырылғанда ядроның заряды өсуіне сәйкес қабаттар ядроға жақындай түседі. 1-қабат 1s қабықшадан, 2-қабат 2s, 2p қабықшалардан, 3-қабат 3s, 3p, 3d қабықшалардан, т. б. тұрады. Әр қабат элементтің периодын анықтайды. Осы период элементтердің химиялық, оптикалық, электрлік және магниттік қасиеттерінің қайталану периоды болып табылады. Осы периодтылық атомның ең сыртқы электрон қабықшаларының қасиетімен анықталады. Мұндай периодтылық иондар қасиетінде де сақталады. Атомның орбиталарында 2 не одан да көп электрондар қозғалып жүрсе, онда мұндай күрделі атомдардағы электрондардың өзара әсерлесуін де еске алу керек. Ол әсерлесулер тек электр статикалық ғана емес, орбиталық магниттік моменттер мен бөлшектердің өзінің ішкі магниттік моменттері де өзара әсерлесуі мүмкін. Мысалы, гелий атомындағы екі электронның негізгі күйдегі әсерлесу энергиясы 78, 98 эВ. Көп электронды атомдар құрылысын зерттегенде бұларды есепке алып отырады. Сонымен бірге әр электронның орбита бойымен қозғалысында туатын электрлі магниттік өрісі мен электронның ішкі магниттік моментінің әсерлесуі де қосымша байланыс энергиясын тудырады. Осының нәтижесінде атом спектрінде нәзік түзілісті, ал электрон мен ядроның магниттік моменттерінің өзара әсерлесуінен аса нәзік түзілісті көреміз. Қазіргі заманғы кванттық электр динамикасында атом электрондарының вакуум құрамындағы виртуальды бөлшектермен әсерлесуін де есептеп атом құрылысының мұнан да күрделі екеніне көз жеткізуге болады.
Атом құрылысы туралы көзқарастардың даму тарихы
“Атом”түсінігі б. э. д 500-200 ж. ж ежелгі грек философтарының қоршаған әлем құрылымы жайлы түсініктер жүйесі ретінде пайда болды. Левкипп әлем өте кішкентай бөлшектер мен бос кеңістіктен тұрады деп тұжырымдады. Демокрит бұл бөлшектерді атомдар (“бөлінбейтін”) деп атады және олар мәңгілік, үнемі қозғалыста болады деп есептеді.
Атомдар өлшемдері өте кішкентай болғандықтан, оларды өлшеу мүмкін емес деген жорамал айтылды. Атомдар пішіні, сыртқы өзгешеліктері денелерге белгілі қасиеттер береді деп есептелді. Мысалы, су құрамындағы атомдар - майда, олар айналып қозғалуға бейім, сондықтан сұйықтықтарға ағу қасиеті тән; темір атомдарында тісшелері бар, сол арқылы олар бір біріне бекініп, темірге қатты дене қасиетін береді . Атомдардың бір бірімен өздігінен әрекеттесу қабілеті туралы ойды Эпикур ұсынды . Осыдан кейін жиырма жүзжылдыққа жуық уақыт бойы қоршаған ортаның атомдық құрылысы туралы ілім өз дамуын таппады да, ұмыт болды. ХIХ ғасырдың басында Дж. Дальтон, сол уақытта ашылған химия заңдарына - еселік қатынас, эквиваленттер, құрам тұрақтылық - сүйеніп, атомистикалық теорияны жандандырды. Жаңа теория қағидаларының ежелгі грек философтары ойларынан негізгі ерекшелігі - олар зат құрылысы туралы нақты эксперименттік деректерге сүйенді. Дальтон белгілі химиялық элементтің атомдары бірдей қасиет көрсететінін, ал әртүрлі элементтерге әртүрлі атомдар сәйкес келетінін анықтады. Атомның маңызды сипаттамасы - атомдық масса енгізілді, кейбір элементтер үшін олардың салыстырмалы мәндері анықталды. Алайда атом әлі де бөлінбейтін бөлшек деп есептелді. XIX ғасырдың аяғы мен XX ғасырдың басында атом құрылысы күрделілігін айқындайтын эксперименттік дәлелдер пайда болды: фотоэффект - металдарға жарық бергенде, олардың бетінен электр зарядын тасымалдаушылардың бөлініп шығу құбылысы; катодтық сәулелер - вакуум түтіктегі теріс зарядталған бөлшектер-электрондар ағыны ; рентген сәулелері - заттарға катодтық сәулелермен күшті әсер ету кезінде бөлініп шығатын, көрінетін жарыққа ұқсас, одан жиілігі жоғары электромагниттік сәуле шығару; радиоактивтілік - бір химиялық элементтің екінші химиялық элементке өз бетімен айналу құбылысы нәтижесінде электрондар, оң зарядталған бөлшектер мен рентген сәулелерінің бөлінуі. Сонымен, атомдар өзара әрекеттесетін теріс және оң зарядталған бөлшектерден тұратыны анықталды.
Атомның планетарлық моделі. Атомның алғашқы үлгілерінің бірін Дж. Томсон ұсынды. Бұл үлгіде атом радиусы ~10 −10 К) м оң зарядталған шар ретінде қарастырылады. Шардың ішінде тепе-теңдік жағдайының маңында электрондар тербеліп тұрады. Электрондардың теріс зарядтарының қосындысы шарға біркелкі таралған оң зарядты теңестіреді, сондықтан тұтас алғанда атом электрлік бейтарап бөлшек болады. Кейінгі зерттеулер бұл модельдің дұрыс емес екенін көрсетті, сондықтан Томсон моделі қазір тек тарихи тұрғыдан қарастырылады. Атомның ішінде электр зарядтарының орналасу тәртібін анықтау үшін 1911 жылы Резерфорд өзінің шекірттері Г. Гейгер және Э . Марсденмен бірге альфа-бөлшектер шоғын өте жұқа алтын фольгадан өткізіп, бірнеше тәжірибелер жасады. Осы тәжірибелерді зерделеу нәтижесінде атомның ядролық, басқаша айтсақ, планетарлық моделі өмірге келді. Тәжірибенің басым көпшілігі фольгадан өткенде алғашқы бағыттан aуытқымайтыны (φ≈1-2°) анықталды. Бұл нәтиже, негізінен, Томсон моделіне сүйеніп жасалған есептеулермен дәл келді. Бірақ, альфа- бөлшектердің мардымсыз аз бөлігі 90°-тан артық бұрышқа ауытқитыны, яғни олар фольгаға соғылып, кері бағытта ұшатыны таңдандырды. Сегіз мыңға жуық бөлшектердің біреуі ғана осындай үлкен бұрышқа ауытқиды екен! Мұны Томсон моделі негізінде түсіндіру тіпті мүмкін болмады. Тәжірибеде алынған нәтижелерді зерделей отырып Резерфорд өз моделін ұсынды. Ол атомның оң заряды оның ортасында орналасқан радиусы шамамен 10 −15 м өте аз көлемге жинақталған деген қорытындыға келді. Бұл орталық бөлшекті Резерфорд ядро деп атады. Атомның массасы түгел дерлік ядрода шоғырланған. Ядроны айнала әр түрлі орбиталармен электрондар қозғалып жүреді. Ең шеткі электрон орбитасының радиусы атомның радиусына тең, R a ≈10 −10 м. Бұл үлгі Күн жүйесінің құрылымына ұқсайтын болғандықтан, оны атомның планетарлық моделі деп те атайды. Модель бойынша атом көлемінің басым көпшілік бөлігі "бос" болып шығады, ядроның радиусы атомның радиусынан 100 000 есе кіші. Орбиталардағы электрондардың теріс зарядтарының қосындысы ядроның оң зарядына тең, атом электрлік бейтарап. Атомның ішіндегі бос кеңістік "өте үлкен". Сондықтан, фольга арқылы өткенде альфа-бөлшектерінің көбі ядродан алыс өтеді де, шашырамайды. Электрондар альфа-бөлшектен 8 мың еседей жеңіл болғандықтан, оның қозғалыс траекториясын өзгерте алмайды. Тек ядроға тікелей қарсы келіп қалған альфа-бөлшектер ғана онымен әсерлесіп, кері ұшады. Мұндай бөлшектер саны ядро радиусының атом радиусына қатынасымен анықталады. Жоғарыда біз тәжірибеге тек сапалық талдау жүргіздік. Резерфорд сонымен қатар өз моделінің және Томсон моделінің негізшде есептеу жұмыстарын жүргізді, олардың нәтижесі Резерфорд үлгісінің дұрыстығын көрсетті. Бірақ классикалық физика тұрғысынан мұндай атомның орнықты болуы мүмкін емес. Бұдан бұрын айтылғандай, зарядталған бөлшек үдемелі қозғалса, міндетті түрде сәулеленуі (электромагниттік толқындар шығаруы) керек. Бұл сәулеленудің жиілігі электронның ядро маңында айналу жиілігіне тең болуы тиіс. Электрон ядроны айнала дөңгелек орбитамен қозғалса, оның центрге тартқыш үдеуі бар. Олай болса, электрон сәуле шығара отырып, өз энергиясын азайтуы тиіс. Энергияның (орбиталық жылдамдықтың) азаюы электронның ядроға кулон күшінің әсерінен біртіндеп жақындап, ақыры оған құлап түсуіне әкеп соғады. Бұған бар болғаны 10 −8 с-ка тең уақыт кетеді екен .
Атом құрылысы. Атом ядродан және осы ядроны айналып тұратын электрондардан құралған. Атом құрылысы мына суретте көрсетілген:
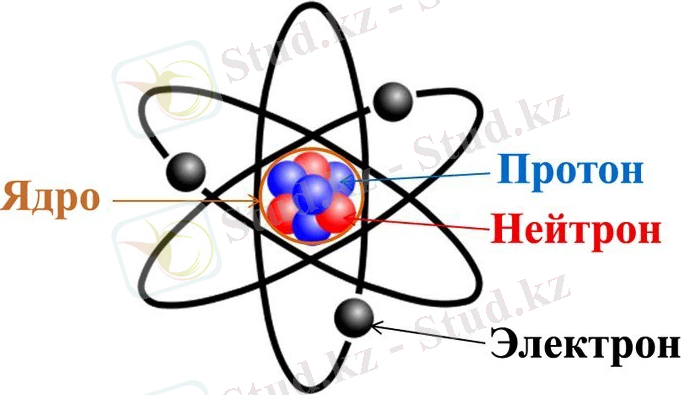
Ядро протондар мен нейтрондардан құралған. Протон оң заряды бар бөлшек, ал нейтронның заряды жоқ бөлшек. Осы екі бөлшектің массалары шамалас, ал электрон болса нейтроннан 1838 есе жеңіл. Электронның заряды теріс. Электронның заряды табиғатта бар электр зарядтардың ең кішісі, протонның заряды электрондікіне тең, тек таңбасы оң.
Атомның құрамында неше электрон бар болса, сонша протон бар болады. Мысалы сутегінің атомында бір электрон және бір протон бар. Сутегі атомының қорытқы заряды +1 - 1 = 0. Яғни осы атом бейтарап болады. Бұл қағида барлық атомдарға орынды.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz