Термохимия: теориялық негіздер мен калориметриялық әдістер


М. Әуезов атындағы Оңтүстік Қазақстан Университеті
Коммерциялық емес акционерлік қоғамы
КЕЙС
Тақырыбы: Термохимия
Орындаған: Көпжасар Қ
Тобы: ЕП-18-4К
Қабылдаған: Утелбаева А
Шымкент - 2021
Мазмұны
- Термохимия
- Термохимиялық теңдеулер
- Глоссарий
- Сөзжұмбақ
- Тест тапсырмалары
Қорытынды
Пайдаланылған әдебиеттер тізімі
1. Термохимия
Термохимия - химиялық динамиканың бөлімі, ол химмиялық реакциялардың жылу эффектісін және реакцияның жүру барысындағы элементтердің физико-химиялық параметрлеріне тәуелділігін қарастырады. Сонымен қатар термохимия мақсатына жылудың фазалық өтулер, ерулер, қосылу, тағы басқа процестер, жылу сыйымдылықты меңгеру және заттардың энтальпиясы мен энтропиясы кіреді. Термохимияның негізгі тәсілі - калориметрия болып табылады. Кей жағдайларда калориметриялық емес те тәсілдер (тепе-теңдік константасын өлшеу нәтижелерінен жылу эффектілерін санау) қолданылады, алайда бұл жағдайларда нәтижелер онша дәл болмайды. Термохимия термодинамиканың және химиялық байланыстар түріндегі энергия концепция тұжырымдамаларын біріктіреді. Бұл тақырып әдетте жылу сыйымдылық, жану температурасы, температурасы, энтальпия, энтропия, еркін энергия және калория сияқты мөлшерлерді есептеуді қамтиды.
Термохимия екі қорытуға негізделген. Қазіргі заманғы терминдерде олар келесідей:
1) Лавуазье және Лаплас заңы (1780) : Кез-келген трансформациямен жүретін энергия өзгерісі кері үрдіспен жүретін трансформацияның энергия өзгеруіне тең және қарсы.
2) Гесс заңы 1840: Кез-келген трансформация бір немесе бірнеше кезеңде жүруіне энергия өзгерісі байланысты болмай, әрқашан бірдей болып қалады. Бұл тұжырымдар термодинамиканың бірінші заңына (1845) кірді және оны тұжырымдауға көмектесті.
Сонымен қатар тузілуі қиын, ал кейде мүлде мүмкін емес реакцияның жылу эффектісін табуға жол ашты. Есептеуге қажетті стандартты жылу түзілулер ∆Н түз о{\displaystyle \Delta H} фундаменталды термохимиялық анықтамаларда жиылған. Лавуазье, Лаплас және Гесс сондай-ақ меншікті жылу сыйымдылығы мен елеусіз жылуды зерттеді, бірақ елеусіз энергия өзгерістерінің дамуына ең маңызды үлес қосқан Джозеф Блэк болды. Густав Кирхгоф 1858 жылы реакция жылуының өзгеруі өнімдер мен реагенттердің арасындағы жылу сыйымдылығының айырмашылығымен анықталды: dΔH/dT=ΔCp. Бұл теңдеудің интегралдауы басқа температурадағы өлшеуден бір температурада реакция жылуын бағалауға мүмкіндік береді.
ХІХ ғасылдың ортасында Томсон және Бертло ой тұжырымдады, олардың айтуы бойынша, энергиясыз болып жатқын химиялық реакциялар максималды жылу бөлінген жаққа ағады. Олармен және олардың шәкірттерімен термохимияның негізгі эксперименталдық тәсілдері жасалды және көптеген реакциялардың жылу эффектілері өлшенді.
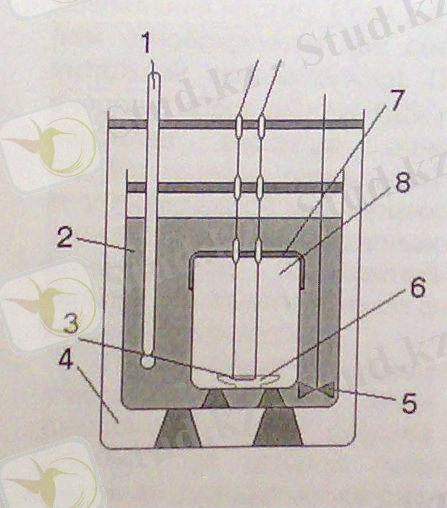
1-сурет 1 - термометр 2 - су 3 - үлгіні жағу үшін арналған спираль 4 - ауа кеңістігі 5 - араластырғыш 6 - үлгі салынған ыдыс 7 - қысымдағы оттегі 8 - бомба калориметр
Жалпы алғанда Бертло-Томсеннің мәлімдемелері шындыққа сай болмады, бірақ термохимияда белгілі бір шартта химиялық реакциялардың ағу мүмкіндігін зерттеу маңызы сақталды. Сонымен, ∆Н - T∆S = -RTLnKp {\displaystyle \Delta H-T\Delta S=-RTLnKp}- термодинамиканың бірінші және екінші бастамасының жалпы теңдеуі болып табылып ({\displaystyle \Delta H} - энтальпия өзгеруі, {\displaystyle \Delta S} - химиялық реакция кезіндегі энтропияның өзгеруі, Т - температура, R - газ тұрақтысы), кез келген реакцияның тепе-теңдік констартасын Кр жылулық өлшемдер арқылы есептеуге мүмкіндік береді.
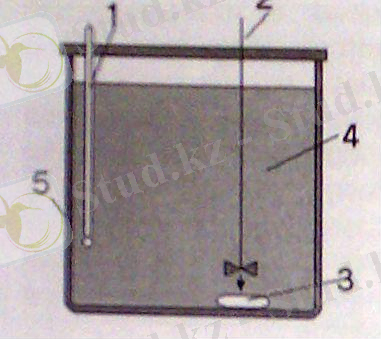
2-сурет 1 - термометр 2 - ампула сындыруғы арналған араластырғаш 3 - ампула 4 - калориметрлік сұйықтық 5 - калориметрлік қабықша.
Энтальпия өзгеруін (жылу эффект) лабораторияда оңай есептеуге болады. Мұны көбіне реакция шекарасын қоршап жасайды: бұл кезде энергия алмасу жүзеге асады. Егер реакция экзотермиялық болса, онда су қызады, ал егер эндотермиялық болса, онда суиды. Егер судың температура өзгеруін өлшесе және су массасы мен оның меншікті жылу сыйымдылығы белгілі болса, бұл жағдайдахимиялық реакция кезінде жұтқан немесе бөліп шығарған энергия мөлшерін табуға болады. Басқа тәсілдер мен өлшеулерге қарағанда 1-суретте көрсетілген қондырғы көмегімен {\displaystyle \Delta H}∆Н-тың нақты шамасын алуға болады. Бұл қондырғы - калориметрлік бомба деп аталады және заттардың жану жылуын өлшеуге арналған. Кейбір реакциялармен {\displaystyle \Delta H}∆Н өлшеуге болады. Мысал ретінде метанның жану реакциясын алуға болады. Бұл реакцияның {\displaystyle \Delta H}∆Н қарапайым асүйлік жабдық пен газ плитасын қолданып табуға болады. Ал басқа реакцияларға мұны орындау қиынға түседі. Мысалға, СаСО3 түзілу (еру) реакциясына 8000С-дан артық температура қажет. Бұл жағдайда берілген энергияны табу үшін суды қолдану қиынға түседі. бұл жағдайларда энтальпияның өзгеруін табу жанама жүріп, энтальпиялық циклдер қолданылуымен жүзеге асады. Жоғарыда айтылғандай, калориметрия реакцияның жылу эффектісін анықтауға, соның ішінде ол тұздардың еру жылуын немесе басқа қосылыстардың суда, не басқа еріткіштерде еруін анықтау үшін пайдаланылады. Бұл термохимияның ең қызықты мақсаты болып табылады, өйткені тұз еріген кездегі бөлінген жылу заттарды қыздыру немесе суыту үшін пайдаланылады.
2. Термохимиялық теңдеулер
Химиялық реакциялар жүру барысында реакцияға түскен зат молекулаларындағы бйланыстар үзіліп, реакция өнімдерінің молекулаларында жаңа байланыстар түзілуі керек. Бұл үрдістер энергия өзгерістері арқылы жүзеге асады.
Энергия сақталу заңы бойынша кейбір реакциялар жылу бөле (экзотермиялық), ал кейбіреулері жылу сіңіріле (эндотермиялық) жүреді, олар реакция теңдеулерінде көрсетілсе, мұндай теңдеулер термохимиялық теңдеулер деп аталады.
Термохимиялық реакция теңдеулерінде заттардың агрегаттық күйі жақша ішінде көрсетіледі және коэффициенттері бөлшек сандарда болуы мүмкін.
Күрделі заттың 1 молінің жай заттардан түзілуі кезінде бөлінетін не сіңірілетін жылуды заттардың түзілу жылуы деп атайды. Жану реакциясы кезінде 1 моль зат жанғанда бөлінетін жылу жану жылуы деп аталады.
Заттың түзілу жылуы оның агрегаттық күйіне байланысты екендігін мына мысалдан көруге болады:
Q түзілуі (H 2 O) сұйық = 286, 4 кДж/моль
Q түзітуі (H 2 O) газ = 241, 9 кдж/моль
2H 2(газ) + О 2(г) = 2Н 2 О сұйық +572, 8 кДж
2H 2(газ) + О 2(г) = 2Н 2 О газ + 483, 8 кДж
Заттардың түзілуі жылуының мәндері стандартты жағдайда анықтама кітаптарында беріледі. (Стандартты жағдай t=25 0 C, p=1атм=101, 3 кПа) .
Энергия сақталу заңына сәйкес заттың түзілуі жылуы мен оның айырылу жылуының абсолюттік мәндері тең, ал таңбалары қарама қарсы болады, бұл тұжырым Лавуазье Лаппас заңы деп аталады.
Термодинамиканың тағы бір заңы -Гесс заңы (1841) . Гесс заңы - реакцияның жылу эффектісі оның жүру жолына тәуелсіз, тек заттардың бастапқы және соңғы күйіне тәуелді.
С (қ) + 1 / 2 O 2(г) =СО (г) + Q 1
СO (г) + 1 / 2 O 2(г) =СО 2 (г) + Q 1
С (қ) + 1 / 2 O 2(г) =СО 2 (г) + Q 1
Q 3 = Q 1 + Q 2
3. Глоссарий
- Термодинамикалық теңдеулер -энергия сақталу заңы бойынша кейбір реакциялар жылу бөле, ал кейбіреулері жылу сіңіре жүреді, олар реакция теңдеулерінде көрсетілсе, мұндай теңдеулер термохимиялық теңдеулер деп аталады.
- Жану жылуы -жану реакциясы кезінде 1 моль зат жанғанда бөлінетін жылу
- Гесс заңы -реакцияның жылу эффектісі оның жүру жолына тәуелсіз, тек заттардың бастапқы және соңғы күйіне тәуелді.
- Термодинамика -физиака ғылымындағы жылудың жұмыс және басқа энергия түрлерімен арадағы қарым- қатынасын зерттейтін тармағы.
- Ішкі энергия -дененің тек ішкі күйіне байланысты энергия.
- Термохимия -химиялық динамиканың бөлімі, ол химиялық реакциялардың жылу эффектісін және реакцияның жүру барысындағы элементтердің физико-химиялық параметрлеріне тәуелділігін қарастырады.
- Жылу сыйымдылық -қандай да бір температуралық шкалада дене температурасын бір градусқа өзгерту үшін талап етілетін жылу мөлшерінің шамасы.
- Энтальпия -жылулық функция, жылу мөлшері - термодинамикалық жүйе күйінің функциясы болып келетін жылуға қатысты шама.
- Энтропия -тұйық термодинамикалық жүйедегі өздігінен жүретін процестің өту бағытын сипаттайтын күй функциясы.
4. Сөзжұмбақ
- Термодинамикалық жүйедегі өздігінен жүретін процесстің өту бағытын сипаттайтын күй функциясы (Энтропия)
- Реакцияяның жылу эффектісі оның жүру жолына тәуелсіз, тек заттардың бастапқы және соңғы күйіне тәуелді заң (Гесс заңы)
- Материя қозғалысының әртүрлі формасының жалпы өлшеуіші не деп аталады? (Энергия)
- Химиялық динамиканың бөлімі (термохимия)
- Жылулық қозғалтқыштардың негізгі жұмыс істеу заңдылықтарын бекіткен француз инженері? (С. Карно)
- Берілген газдың көлемі тұрақты болғанда жүретін процесс (Изохоралық)
- Жүйе мен оны қрошаған сыртқы ортаның арасында ешқандай жылу энергиясының алмасуы болмайтын процесс (адиабаталық)
- Берілген газдың температурасы тұрақты болғанда жүретін процес (Изотермиялық)
- «Салқын жүйеден жылу алып, оны жұмысқа айналдыратынмашина жасау мүмкін емес», - деп айтқан ғалым? (Кельвин)
- Жылулық функция, жылу мөлшері - термодинамикалық жүйе күйінің функциясы болып келетін жылуға қатысты шама? (энтальпия)
- Тест тапсырмалары
1. Ішкі энергия дегеніміз . . .
A) массасы 1 кг затты 10 С-қа қыздыруға қажет жылу мөлшері.
B) жылу берілу кезінде дененің алатын не беретін жылу мөлшері.
C) затты 10 С-қа қыздыруға қажет жылу мөлшері.
D) денені құрайтын барлық бөлшектердің потенциалдық және кинетикалық энергиясы.
E) денені құрайтын барлық бөлшектердің потенциалдық энергиясы.
2. Термодинамикалық жүйеге Q = 2000 Дж жылу мөлшері берілген. Егер А = 500 Дж жұмыс жасаса, онда жүйснің ішкі энергиясы.
A) 1, 5 кДж-ге кемиді.
B) 2, 5 кДж-ге артады.
C) 1, 5 кДж-ге артады.
D) 2, 5 кДж-ге кемиді.
E) өзгермейді.
006
3. Изотермиялық сығылудан кейін ортаға 600 Дж жылу берілгенде атқарылатын жұмысты анықтаңыз.
A) 300 Дж
B) 400 Дж
C) 500 Дж
D) 200Дж
E) 600 Дж
4. Изохоралық қыздыру кезінде ішкі энергия 200 Дж-ға артқанда газдың атқаратын жұмысы.
A) 200 Дж
B) 400 Дж
C) 0
D) 300 Дж
E) 100 Дж
5. Адиабаталық процесс кезінде 400 Дж жұмыс атқарғандағы газдың ішкі энергиясының өзгерісі.
A) 200 Дж
B) 300 Дж
C) 400 Дж
D) 100 Дж
E) 500 Дж
6. Отын толық жанғанда бөліп шығаратын жылу мөлшері:
A) Q = qm .
B) Q = cm∆t.
C) Q = λm.
D) Q = rm.
E) Q = tm.
7. Балқу температурасында алынған, массасы 4 кг қорғасынды балқытуға қажет жылу мөлшері. (
 =
=
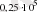 Дж/кг) .
Дж/кг) .
A)
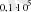 Дж.
Дж.
B)
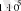 Дж.
Дж.
C)
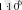 Дж.
Дж.
D) 182920 Дж.
E)
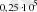 Дж.
Дж.
8. Қайнаудың басынан толық қайнағанға дейін сұйықтың температурасы.
A) жоғарылайды.
B) төмендейді.
C) кейбір сұйықтарда жоғарылайды, ал кейбіреуінде төмендейді.
D) өзгермейді.
E) басында жоғарылайды, сосын өзгермейді.
9. Температураны жоғарылатқанда сұйықтың булану жылдамдығы . . .
A) өзгермейді.
B) артады.
C) кемиді.
D) басында артады, кейін кемиді.
E) басында кемиді, кейін артады.
10. Адиабаталық ұлғаюда идеал газ А/ жұмыс жасайды. Сонда орындалатын теңдік
A) Q=0, ∆U=-А/.
B) Q=А/, ∆U=0.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz