Атом-молекулалық ілімнің негіздері: стехиометрия, атом құрылысы және периодтық заң


Дәріс №1
Атом-молекулалық ілім негізі
Дәрістің мақсаты : атом-молекулалық ілімнің негізгі қағидаларымен танысу. Атом, молекула, моль, мольдік масса, эквивалент, эквивалент заңымен есеп шығара білу.
- Материя туралы түсінік. Химия ғылымы, оның маңызы және басқа ғылымдармен байланысы.
- Атом-молекулалық ілімнің пайда болуы және дамуы.
- Атом-молекулалық ілім тұрғысынан алғандағы химияның стехиометриялық заңдары.
- Химияның негізгі түсініктері.
Материяны бізді қоршаған дүниедегі барлық тірі және өлі денелер деп түсінеміз. Кез келген дене заттардан құралады. Материяның өмір сүруінің екі формасы бар: зат және өріс. Зат - ұсақ бөлшектерден құралған материалдық түзілім. Өріс - бөлшектердің әрекеттесуі жүзеге асатын материалдық орта. Материя үнемі қозғалыста болады. Қозғалыс дегеніміз - кез келген өзгеріс. Материя қозғалысының 5 формасын атап көрсетеді (Ф. Энгельс) : 1 Механикалық қозғалыс. 2 Физикалық құбылыстар. 3 Химиялық құбылыстар. 4 Биологиялық қозғалыс. 5 Әлеуметтік процестер.
Химия ғылымы материя қозғалысының химиялық формасын зерттейді. Химия - заттардың құрамы, құрылысы, олардың бір-біріне айналуы және осы айналумен қабат жүретін құбылыстар туралы ғылым.
Химиялық құбылыс немесе басқаша химиялық реакция - бұл заттардың бір-біріне айналуы. Химиялық реакция кезінде бастапқы заттардың құрамына кірген атомдар қайтадан топтасып, олардан жаңа заттар түзіледі.
2 Заттардың өте ұсақ бөлшектерден тұратындығы туралы пікірді өте ертедегі грек философтары (Демокрит, Левкипп, Лукреций) айтқан болатын. Бірақ мұндай батыл материалистік көзқарастар ол кезде шіркеу тарапынан қуғынға ұшырайтын, сондықтан ұзақ уақыт ұмыт болды.
Заттардың дискреттілігі, яғни ұсақ бөлшектерден тұратындығы, бөлінгіштігі туралы идеялар XVIII ғасырда қайтадан жаңғыра бастады. Қазіргі атом-молекулалық ілімнің негізін қалаушы ғалымдардың (М. В. Ломоносов, Дж. Дальтон, Лавуазье, Пруст, Бертолле, Гей-Люссак, Авогадро және т. б. ) еңбектері нәтижесінде заттардың құрылысы туралы ғылыми мәліметтер жиналды. Атом-молекулалық ілімнің негізгі қағидалары:
1 Барлық заттар молекулалардан, атомдардан немесе иондардан тұрады. Атом - химиялық элементтің қасиеттерін бойында сақтайтын оның ең кіші электронейтрал бөлшегі. Молекула - заттың қасиеттерін анықтайтын оның кіші бөлшегі. Ион - атомдардың (немесе молекулалардың) электрондарды қосып алуы немесе беруі нәтижесінде түзілетін зарядталған бөлшектер.
2 Заттың құрамындағы бөлшектер (молекулалар, атомдар, иондар) үнемі қозғалыста болады. Бұл қозғалыс әрбір затта болатын жылу энергиясы қоры арқылы жүзеге асады.
3 Барлық заттар жай және күрделі заттар болып бөлінеді. Кейбір элементтер бірнеше жай зат түзеді (аллотропия) .
Қазіргі көзқарастарға сәйкес заттар молекулалық және молекулалық емес құрылысты болады, яғни барлық заттар үшін «молекула» ұғымы қолданылмайды. Молекуласы бар заттарда (мысалы, Н 2 , О 2 , Сl 2 , СО 2 , Н 2 О, НСl, С 2 Н 5 ОН, СН 3 СООН, белок, крахмал және т. б. ) бір немесе бірнеше элемент атомдарының белгілі бір санынан жеке өмір сүруге қабілетті молекулалар түзіледі. Қатты немесе сұйық күйде болғанда мұндай заттарда молекулалар әлсіз молекулааралық күштермен байланысады. Ал молекуласы жоқ заттарда (әдетте олар - қатты заттар) оның алынған кристалында қанша атом немесе ион болса, солардың барлығы өзара бір-бірімен байланысқан болады, яғни мұндай заттардан жеке молекулаларды бөліп алуға болмайды. Молекулалық емес құрылысты заттарға металдар, кейбір оксидтер, негіздер, тұздар жатады.
Стехиометрия - заттардың құрамына кіретін элементтердің немесе химиялық реакцияларға түсетін заттардың сандық арақатынастарын зерттейтін химия саласы. Стехиометриялық заңдарға масса сақталу заңы, құрам тұрақтылық заңы, еселі қатынастар заңы, эквиваленттер заңы, көлемдік қатынастар заңы, Авогадро заңы жатады.
Жалпы материяның сақталу заңын 1748 ж. М. В. Ломоносов тұжырымдаған: « . . . Бір денеден қанша кемісе, екіншісіне соншама қосылады; бір жерден бірнеше материя азайса, басқа жерде соншаға артады . . . ». Химиялық реакцияларға қатысты бұл заң былай оқылады: «Химиялық реакцияға түсетін заттардың массасы әрқашан оның нәтижесінде түзілетін заттар массасына тең болады». Химиялық реакция кезінде бастапқы заттар құрамына кірген элемент атомдары ешқайда жойылып кетпейді, алынған қажетті мөлшерінде жаңа заттардың құрамына кіреді, сондықтан жалпы масса өзгермейді. Мысалы:
СuO + H 2 SO 4 → CuSO 4 + H 2 O
1 моль 1 моль 1 моль 1 моль
80 г + 98 г = 160 г + 18 г
Құрам тұрақтылық заңын 1801 ж. француз ғалымы Ж. Л. Пруст тұжырымдады:
«Кез келген химиялық таза заттың құрамы оның алыну жолдарына тәуелсіз тұрақты болады».
Бұл заң молекулалық құрылысты заттар үшін дұрыс болады, себебі молекула - тұрақты бөлшек, оның құрамы өзгермейді. Мысалы, СО
2
құрамында әрқашан, оны қандай жолмен алса да, үнемі 27, 27 % көміртегі және 72, 73 % оттегі болады. Бертолленің пікірінше, заттардың құрамы алыну жағдайларына сәйкес ауыспалы болады. Қазіргі кезде біз білеміз: бұл - молекулалық емес құрылысты заттар. Олардың құрамы кристалдың түзілу жағдайларына байланысты өзгеруі мүмкін, себебі кристалдық затта әр бөлшектің өз орны болады. Егер кристалдың қалыптасу барысында қандай да бір кемшіліктер кетсе, жалпы кристалдағы әртүрлі элемент атомдары санының арақатынасы бұзылады, яғни заттың формуласына сәйкес келмеуі мүмкін. Мысалы, ТiO
2
құрамы мына аралықта өзгеруі мүмкін: ТiO
1, 9-2, 0
. Сонымен, молекуласы бар заттардың құрамы үнемі тұрақты болады, оларды
дальтонидтер
деп атайды. Ал алыну жағдайларына байланысты құрамы өзгеріп отыратын молекулалық құрылысы жоқ заттар
бертоллидтер
деп аталды.
Қазіргі кезде эквивалент ұғымына келесідей түсінік беріледі.
Эквивалент - бұл бөлшек.
Эквивалент деген сонда қандай бөлшек?
Эквивалент - бұл химиялық реакцияларда сутегінің бір атомына (ионына) сәйкес келетін , яғни сонымен қосылысатын, оның орнын басатын немесе өзінен оны бөліп шығаратын заттың нақты немесе шартты бөлшегі.
Ал тотығу-тотықсыздану реакцияларында эквивалент бөлшегі бір электронға сәйкес келеді.
Атом молекулалық ілімінің негізі 18-ғасырдың аяғы мен 19-ғасырдың басында жасалды. Ломоносов 1741 жылы шыққан “математикалық химия” деген еңбегінде атом молекулалық ілімінің негізгі қағидаларын былай тұжырымдады:
1) барлық заттар молекулалардан тұрады;
2) молекулалар атомдардан тұрады;
3) бөлшектер, атомдар, молекулалар үнемі қозғалыста болады;
4) жай заттардың атомы бір молекуладан, күрделі заттардың атомы бірнеше молекуладан тұрады.
Молекула - заттың химиялық қасиетін сақтап тұратын ең кіші бөлшегі. Атом - химиялық элементтің ең кіші бөлшегі. Әрбір химиялық элементке белгілі бір атомның жиынтығы сәйкес келеді. Атомдар бір-бірімен бірігіп байланысып молекула түзеді. Қазіргі анықтамасы: атом - оң зарядталған атом ядросынан және теріс зарядталған электрондардан тұратын электронейтрал бөлшек. Протондар мен нейтрондардың ортақ атауы нуклондар . Жалпы алғандағы атом электрлік бейтарап болғандықтан, электрондардың қосынды заряды ядро зарядына тең болуы керек. Элементтің реттік нөмірі атом ядросының зарядына тең және ядродағы протон санына тең және атомдағы электрон санына тең. Ядро массасы (және атом массасы да) протон (Z) саны мен нейтрон (N) санының қосындысымен анықталады. Бұл қосындыны атомның массалық саны (A) деп атайды A=Z+N.
Элемент - белгілі бір атомның түрі. Бірдей атомдардан тұратын заттар жай заттарға жатады: Ғе, О 2 , Н 2 .
Бір элементтің бірнеше жай заттар түзуін аллотропиялық құбылыс дейді. Көміртектің аллотроптық түрі: алмас, графит, карбин және фулерен; оттектікі - мелекулалық оттек О 2 пен озон О 3 .
Ядро зарядтары (Z) бірдей, ал массалық саны (A) әртүрлі болатын атомдарды
изотоптар
деп атайды. Сутек элементінің үш изотопы бар: протий -
 Н, дейтерий -
Н, дейтерий -
 Н немесе D, тритий -
Н немесе D, тритий -
 Н немесе Т.
Н немесе Т.
Ядро зарядтары (Z) әртүрлі болатын, ал массалык саны (A) бірдей атомдарды
изобаралар
деп атайды.
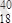 Ar;
Ar;
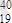 K;
K;
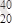 Ca.
Ca.
Молекулалары әртүрлі элементтің атомдарынан тұратын заттарды - күрделі заттар дейді: CuO, H 2 SO 4 . Күрделі заттарға барлық оксидтер, қышқылдар, негіздер, тұздар және толып жатқан органикалық қосылыстар жатады.
Иондар - зарядталған бөлшектер: оң зарядталғанды катиондар және теріс зарядталғанды аниондар дейді.
Атомның ең маңызды көрсеткіштерінің бірі оның массасы. 1961 жылы халықаралық келісім бойынша массаның атомдық бірлігі ретінде атомдық массасы 12-ге тең көміртек изотопы массасының 1/12 бөлігі қабылданды. Көміртек (С-12) атомы массасының 1/12 бөлігі массасының атомдық бірлігі (м. а. б) деп аталады. 1 массаның атомдық бірлігі (1 м. а. б. ) 1, 66∙10 -27 кг тең.
A r (O) = 26, 60∙10 -27 / 1, 66∙10 -27 = 16;
A r (H) = 1, 67∙10 -27 / 1, 66∙10 -27 = 1.
Салыстырмалы атомдық масса дегеніміз сол элемент атомы массасының көміртек атомы массасыныкі 1/12 бөлігінен немесе массасының атомдық бірлігінен неше есе ауыр екенін көрсететін сан.
Зат мөлшері ν - атом, молекула, иондарының құрылыс бірліктерінің санын көрсететін физикалық шама. Ол ν таңбасымен белгіленеді, өлшем бірлігі - моль . Моль дегеніміз - 0, 012 кг 12 С изотобындағы құрылыс бірліктеріне тең шама.
Зат мөлшерінің 1 молінің массасы оның молярлық массасы деп аталады М = m/ν ; өлшем бірлігі - кг/моль немесе г/моль .
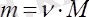 .
.
Зат массасының сақталу заңы (1748 ж. М. В. Ломоносов; 1766 ж. А. Лавуазье ашты. ) Реакцияға қатысқан заттардың массасы шыққан зат өнімдерінің массасына тең . Бұл заң ядролық реакцияларда қолданылмайды. 1905 жылы Эйнштейн энергия сақталу заңын ашты:
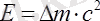 .
.
Мұндағы Е - энергия;
m - масса;
с - вакуумдағы жарықтың жылдамдығы, ол 2, 9979∙10 8 м/с тең.
Бұл формула бойынша энергия массалардың өзгерісі мен жарық жылдамдығының квадратының көбейтіндісіне тең. Яғни, ядролық реакцияларда массаның өзгерісі алынады: демек, ядролық өзгерістерде масса тұрақты болмайды.
Зат массасының сақталу заңының мәнін былай түсіндіруге болады: реакцияға қатысқан заттардың құрамында қандай атомдар қанша мөлшерде болса, реакция нәтижесінде шыққан заттардың құрамында да сондай атомдар сонша мөлшерде болады. Химиялық реакциялар кезінде атомдар массалары өзгермейтіндіктен реакцияға қатысқан заттардың массасы тұрақты болады. Барлық химиялық реакциялар заттар массасы сақталу заңына бағынады.
Заттар массасы сақталу заңының мысалы ретінде литийдің оттегі арқылы тотығу реакциясының теңдеуін келтірейік:
4Li + O 2 = 2Li 2 O;
6, 94∙4 + 15, 999∙2 = 6, 94∙4 + 15, 999∙2;
59, 758 = 59, 758.
Бұл теңдеуден реакцияға төрт атом литий, екі атом оттегі қатысатынын, ал реакция нәтижесінде түзелген литий оксидінің құрамында да төрт атом литий, екі атом оттегі бар екенін көруге болады. Олай болса реакцияға қатысқан заттар мен шыққан заттардың құрамындағы атомдардың түрлері мен сандары өзгермейтіндіктен реакцияласқан заттардың массасы одан түзілген заттардың массасына тең болады.
1801 жылы француз ғалымы Ж. Пруст құрам тұрақтылық заңын ашты. Алыну әдісіне қарамастан берілген қосылыстардың құрамы тұрақты болады. А ммиакты мынандай әр түрлі әдістермен алуға болады:
N 2 + 3H 2 = 2NH 3 ;
NH 4 Cl + NaOH = NH 3 + H 2 O + NaCl;
NH 4 Cl = NH 3 + HCl.
Бұл реакциялар теңдеулерінен аммиак қандай әдістермен алынса да сапалық құрамы жағынан азот пен сутегіден, сандық құрамы жағынан бір атом азоттан және үш атом сутегіден тұратынын көруге болады. Сондықтан оның массасы және құрамындағы элементтердің проценттік мөлшерлері де тұрақты болады.
Құрамын сақтайтын қосылыстар - дальтонидтер , ал құрамын сақтамайтын қосылыстар бертолидтер деп аталды.
Еселік қатынас заңын Д. Дальтон ашты (1803 ж. ) . Егер екі элемент бір-бірімен бірнеше химиялық қосылыс түзсе , онда бір элемент мөлшерінің екінші элемент мөлшеріне қатынасы бүтін сандарға тең болады . Көміртегі оксидтері СО мен СО 2 -дегі көміртегінің 12 масса мөлшеріне келетін оттегі массаларының өзара қатынасы 16:32 = 1:2 қатынасындай болатынын аңықтау қиын емес.
Еселік қатынас заңынан молекулалық қосылысқа кіретін элементтің ең кіші бөлшегі атом екеніне көз жеткізуге болады. Мысалы көміртегі (II) оксидінде оттегінің 1 атомы болса, көміртегі (IV) оксидінде оттегінің 2 атомы болады.
Реакцияға қатысқан және оның нәтижесінде түзілген газдардың көлемдерін зерттей келіп француз ғалымы Гей-Люссак (1808 ж. ) газдардың көлемдік қатынас заңын ашты. Реакцияға түсетін газдардың көлемдерінің түзілген газ өнімдерінің көлемдеріне қатынасы бүтін санға тең . 1 көлем сутегі мен 1 көлем хлор әрекеттесіп 2 көлем хлорсутек түзеді; екі көлем сутегі мен бір көлем оттегі әрекеттесіп 2 көлем су буын түзеді:
H 2 + Cl 2 = 2HCl;
2H 2 + O 2 = 2H 2 O.
Бойль-Мариот заңы: Тұрақты температурада берілген газ массасындағы газ қысымы мен көлемінің көбейтіндісі тұрақты шама болады :
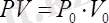 , егер
, егер
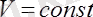 .
.
Гей-Люссак заңы: Тұрақты қысымда берілген газ массасындағы көлем абсолютті температураға тура пропорционал болады :
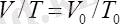 , егер
, егер
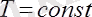
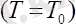 .
.
Шарль заңы: Тұрақты көлемде берілген газ массасындағы қысым абсолютті температураға тура пропорционал болады :
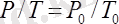 .
.
Үш параметрдің арасындағы қатынас Менделеев-Клайперон теңдеуімен сипатталады:
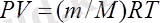 .
.
Мұндағы Р - газ қысымы;
V - газ көлемі;
Т - абсолюттік температура;
R - универсалды газ тұрақтысы;
m - газдың мольдік саны;
М - газдың молярлық массасы.
Авогадро заңы: 1811 жылы итальян физигі Авогадро химиялық реакцияларға түскен газдардың көлемдерінің қатынастарын зерттеп мынадай тұжырымдама жасады: Бірдей температура мен қысымда алынған кез келген газдардың бірдей көлеміндегі молекула сандары бірдей болады. Заңнан шығатын салдар:
1) Кез келген газдың 1 молі қалыпты жағдайда бірдей көлем алады. V = 22, 4 дм 3 /моль .
2) Қалыпты жағдайда 1 моль газдың тұрақты көлеміндегі бөлшектердің саны Авогадро тұрақтысымен сипатталады: N A = 6, 02·10 23 моль -1 .
Эквивалент дегеніміз - реакция кезінде орнын баса алатын, қосып алатын, бөліп шығаратын бір сутек ионының немесе тотығу-тотықсыздану реакциясы кезіндегі бір электрон эквивалентіне тең заттың бөлшегі.
Йодты сутекте HI сутегінің 1 молімен қосылып тұрғандықтан йодтың эквиваленті 1 мольге , күкіртті сутекте H 2 S cутегінің екі молімен қосылып тұрғандықтан күкірттің эквиваленті 1/2 мольге , аммиакта NH 3 сутегінің үш молімен қосылып тұрғандықтан азоттың зквиваленті 1/3 мольге , силанда SiH 4 сутегінің төрт молімен қосылып тұрғандықтан кремнийдің эквиваленті 1/4 мольге тең болады.
Эквиваленттер заңы: реакцияға түсетін заттардың массасы олардың эквиваленттеріне тура пропорционал болады.
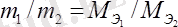 .
.
Егер әрекеттесуші заттар газ түрінде болса, онда эквиваленттер заңы былай өрнектеледі:
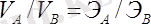 .
.
Мұндағы V А мен V В - әрекеттесуші газдың көлемі.
Химиялық қосылыстың эквиваленті деп оның сутегінің немесе басқа заттың 1 эквивалентімен қалдықсыз әрекеттесетін мөлшерін айтады.
Заттың эквивалентін анықтау үшін химиялық реакция құрып, оның молекулалық массасын әрекеттесуші заттың эквивалент санына бөлу керек.
Алмасу реакциясына қатысатын негіздер мен қышқылдардың эквиваленттік массаларын олардың молярлық массаларын реакция кезінде жоғалтатын гидроксид немесе сутегінің иондарының сандарына бөлу арқылы табады:
NaOH + H 2 SO 4 = NaHSO 4 + H 2 O;
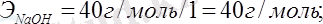
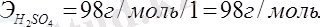
NaOH + H 2 SO 4 = Na 2 SO 4 + H 2 O,
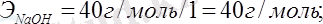
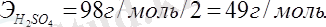
Дәріс №2
Атом құрылысы және периодтық заң
Дәрістің мақсаты : атомның электрондық құрылысын және периодтық заңды зерттеу.
- Атом құрылысы.
- Периодтық заң.
Э. Резерфорд атом құрылысының моделін ұсынды. Бұл модельді атомның ядролық немесе планеталық моделі деп атады. Өйткені, атом құрылысы Күн жүйесіне ұқсас деп қарастырылды. Бірақ бұл модель атом құрылысының орнықты күйін және олардан шығатын сәулелердің қарқынын классикалық физика ұғымдары аясында түсіндіре алмады. Сондықтан Резерфорд моделі мен классикалық физика арасындағы айтылған қайшылықтарды шешу үшін 1913 ж. Н. Бор өз қағидаларын ұсынды.
Француз ғалымы А. Беккерель 1896 жылы Рентген сәулелерін зерттеумен шұғылданды. Зерттеу барысында кейбір минералдардың сәуле шығаратынын байқаған. Бұл зерттеу нәтижелері радиоактивтілік құбылысының ашылуына себеп болды.
Электронның кеңістіктегі орны оның энергетикалық күйіне байланысты болады. Электронның болу мүмкіндігінің максимал шамасы орбиталь деп аталады. Электронның орнын сақтау үшін бүтін сандар алынады. Ол сандар квант сандары деп аталады.
Бас квант саны n 1, 2, 3 . . . ∞ мәндері болады. Ол электронның энергиясын және орбитальдың өлшемін анықтайды. n = 1 болғанда электронның энергетикалық күйі ең төменгі денгейге сәйкес келеді. Электрондық қабат саны артқан сайын энергия да артады. Сондықтан атомдағы орбитальдар белгілі бір энергетикалық деңгейге бөлінеді. Ол энергетикалық деңгейлерді кейде K, L, M, N, O, P, Q - латын алфавитінің әріптерімен белгілейді.
Қосымша квант саны - l , орбитальдың кеңістіктегі пішінін сипаттайды. Сонымен бірге белгілі бір деңгейдегі электронның әртүрлі энергетикалық жағдайын анықтайды. 1, 0, 1, 2 . . . n - 1 мәндері болады. Қосымша квант санының әртүрлі мәндерін ажырату үшін латын әріптерімен белгілеу қабылданған: s ( l = 0), р ( l = 1), d ( l = 2), f ( l = 3), g ( l = 4) . Қосымша квант саны l -дың әртүрлі мәндеріндегі электронның пішіні әртүрлі болады, оларды энергетикалық деңгейшелер деп атайды; n = 1, болғанда l = 0, 1; демек І-деңгейде 2 электрон, ол электрон 1s-ке толтырылады; n = 2, l = 0, 1; яғни ІІ-деңгейде 6 электрон болады, олар 2s 2p-ға толтырылады; n = 3, l = 0, 1, 2; ІІІ-деңгейде 18 электрон болады, олар 3s 3p 3d-ға толтырылады; n = 4, l = 0, 1, 2, 3; IV-деңгейде 18 электрон болады, олар 4s 4p 4d 4f-ке орналасады.
Магнит квант саны m l . Орбитальдардың кеңістікте бағытталуын сипаттайды. Электрон орбитальда қозғалғанда магнит өрісін тудырады. Оның мәндері m l = - l, …0, …+ l.
Кеңістікте бағытталуын анықтау үшін (2 l + 1) формуласын қолданады. l = 0; m l = 0; болса, (s-орбиталь) кеңістікте пішіні шар тәрізді болады, l = 1 (р-орбиталь) ; m l = - 1, 0, 1 кезінде орбитальдың бағытталуы үш түрлі, яғни 3-орбитальға 6-электрон орналаса алады.
Шредингер теңдеуін шешу үшін енгізілген 3 квант саны жеткіліксіз, сондықтан, 4-ші квант саны енгізілді, ол спин квант саны деп аталады, m s әрпімен белгіленеді. Спин дегеніміз -электронның кеңістіктегі қозғалысына байланыссыз, оның өзіндік импульс моментін сипаттайтын шама.
Атомдағы электрондардың энергетикалық деңгейлерге орналасу ретін көрсететін формуланы атомның электрондық конфигурациясы немесе атомның электрондық формуласы деп атайды.
Атомдағы электрондық қабаттардың құрылысын, электрондық конфигурациясын толық түсіну үшін негізгі 4 ұстанымды білу керек:
1) Паули қағидасы.
2) Ең аз энергия ұстанымы.
3) Гунд ережесі.
4) Клечковский ережесі.
1925 жылы Швейцар физигі В. Паули мынадай қағида ұсынды. Атомда бірдей қасиет көрсететін екі электрон болуы мүмкін емес. Электрондық қасиеттері квант сандарымен сипатталатын болғандықтан Паули қағидасы: а томда 4 квант сандары бірдей екі электрон болуы мүмкін емес деп сипатталады. Яғни, бір атомдық орбитальда екі электроннан артық электрон бола алмайды және олардың спиндері қарама-қарсы болуы қажет. Квант санының біреуі n, l , m l , m s спиндері әртүрлі болуы керек. n, l , m l бірдей болғанмен, m s = +1/2; -1/2 болуы мүмкін. Паули қағидасы бойынша: n = 1, l = 0, m l = 1 болса, m s = +1/2; -1/2 болады. Спиндері қарама-қарсы орналасқан екі электрон болуы мүмкін. Орбитальдағы электрондар санын N = 2n 2 формуласымен анықтайды.
І-деңг. n = 1, N = 2.
II-деңг. n = 2, N = 8.
III-деңг. n = 3, N = 18.
1 Н (1s) атомының электрондық конфигурациясын былай көрсетуге болады: электрондық формуласы - 1s 1 . Квант ұяшықтарында Паули қағидасы бойынша 2 электрон спиндері бір-біріне ешқашан параллель болмайды.
3 Lі 1s 2 2s 1
Спиндердің орналасуы Гунд ережесімен анықталады: Қосымша квант санының берілген мәнінде электрондар спиндерінің қосындысы ең жоғарғы мән болатындай орналасады . Гунд ережесі бойынша р-электрондар орбитальдарға орналасқанда ең алдымен жеке-жеке ұяшықтарға толтырылады, содан кейін ғана қарсы спинмен алғашқы электронға параллель орналасады. Бұл жағдайда спиндердің қосындысы 3/2 болады.
Ең аз энергия ұстанымы бойынша атомдағы әрбір электрон ең аз энергияға сәйкес орналасуға тырысады. Энергия ең алдымен n квант санымен, содан кейін l квант санымен анықталады. Сондықтан ең алдымен n мен l квант сандарының қосындысының аз мөлшеріне орналасады; Е4s < E3d; 5p < 4f.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz