Стехиометриялық заңдардың негіздері және олардың химиядағы қолданылуы


Қазақстан Республикасы білім және ғылым министрлігі
Әл - Фараби атындағы Қазақ Ұлттық Университеті

Факультеті: «Химия және химиялық технология»
Топ: ХИ-101 К
РЕФЕРАТ
Тақырыбы: «Химияның негізгі стехиометриялық заңдары»
Орындаған: Есім Қаламқас
Тексерген: Қамұнұр Қастер
Алматы, 2020ж
Жоспар:
I. Кіріспе бөлім.
Негізгі химиялық түсініктер мен заңдар
II. Негізгі бөлім.
1. Зат массасының сақталу заңы
2. Құрам тұрақтылық заңы
3. Эквиваленттер заңы
4. Авогадро заңы
5. Еселік қатынас заңы
6. Газдардың көлемдік қатынас заңы
III. Қорытынды бөлім
Қолданылған әдебиеттер
Негізгі химиялық түсініктер мен заңдар:
Стехиометрия - заттардың арасындағы массалық және көлемдік қатынастарды қарастыратын химияның бөлімі.
- «Стехиометриялық мөлшер» деген ұғым химиялық реакцияның теңдеуіндегі немесе формуладағы заттың мөлшеріне сәйкес келеді. «Стехиометриялық есептеулерге» заттардың түрлері мен олардың арасында жүретін теңдеулері бойынша әр түрлі есептеулер және оған заттардың түрлері мен химиялық реакциялардың теңдеулерін құрастыру да жатады. Стехиометрияның негізін стехиометриялық заңдар құрайды. Бұларға заттар массасының сақталу заңы, құрам тұрақтылық заңы, эквиваленттер заңы, еселік қатынас заңы, кәлемдік қатынас заңы, Авогадро заңы жатады. Бұл заңдар заттардың атомдар мен молекулалардан тұратынын және атом - молекулалық ілімнің дұрыс екенін дәлелдесе, ал атом молекулалық ілім стехиометриялық заңдардың мәндерін толық түсіндіріп береді
Химиялық элемент. Ядро зарядтары бірдей атом түрлері .
Атом - химиялық реакция негізінде бөлінбейтін элементтің қасиетін сақтайтын кіші бөлігі.
Молекула - заттың химиялық қасиетін сақтайтын кіші бөлігі
Жай зат - бір түрлі элемент атомдарынан тұратын зат.
Күрделі зат әр түрлі элемент атомдарының құралған зат.
Массасының атомдық бірлігі (м. а. б) көміртегі - 12(12С) изотопы атом массасының 1/12 бөлігі, яғни 1, *10-27кг. Элементтің салыстырмалы атомдық массасы (Аr) өлшеусіз бірлік, табиғи элементтің изотоптық құрамының орта массасының 6С12 изотопы массасының 1/12 бөлігіне қатынасына тең шама.
Аr =
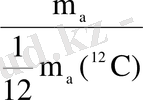 ; мұндағы (r - латынның relotivins - салыстырмалы деген сөзінен шыққан) .
; мұндағы (r - латынның relotivins - салыстырмалы деген сөзінен шыққан) .
Шартты бөлшек - шынайы, нақты кездесетін бөлшектердің кез - келген түрі (атомдар, молекулалар, иондар, электрондар, атомдық топтар т. б. ) және шартты түрде кездесетін Ba2+, H3PO4 тәрізді бөлшек үлестері. Моль - 6С12 изотопының массасы 0, 012 кг қанша бөлшек болса, сонша бөлшек болатын зат мөлшері. (яғни 6, 02*1023) Бұл сан бөлшектер молін емес олардың санын көрсетеді.
Сондықтан «сутек атомдарының молі» дегеннен гөрі «атомды сутек молі» деген ұғым дұрысырақ. Моль санын ν (ню) деп белгілеу қабылданған. Кей оқулықтарда - «n» деп белгілейді: ν (Н) = 1 моль, ν(Н2О) =1 моль.
Авогадро тұрақтысы (NA) кез - келген жүйенің бөлшектер санының (N) жүйе заттары мөлшеріне (ν) немесе (n ) қатынасына тең. N(ν) =NA(N/n=NA) . NA моль-1=6, 02*1023моль-1. Осыдан кейін былай деп тұжырымдаймыз.
Бірдей жағдайда (Т, р) әр түрлі газдардың бірдей молекуласы бірдей көлем алады.
Газдың мольдік көлемі (Vm) 22, 4 л/моль, газдың кез - келген көлемі V=n*Vm болғандықтан зат мөлшері 1 моль (қ. ж. ) газ көлемі 1 моль*22, 4л/моль=22, 4л.
Заттың мольдік массасы. М(х) зат массасының (m) зат мөлшеріне (ν) қатынасымен анықталатын шама. М(х) =
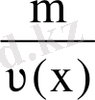 немесе М(х) =
немесе М(х) =
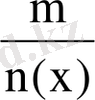 ;
;
Мольдік масса бірлігі кг*моль-1 немесе г*моль-1. Мольдік масса сан жағынан салыстырмалы молекулалық массаға тең. Мысалы,
Ar (Na) =23 Mr (H2SO4) =98
M(Na) =23г/моль M(H2SO4) =98г/моль.
Мольдік көлем Vm - зат көлемінің осы көлемдегі зат мөлшеріне қатынасымен анықталатын шама.
Vm=
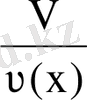 ;
;
Бірлігі - м3/моль немесе л/моль. ν(х) =1 моль, Vm=22, 4 литр, немесе 22, 34*10-3м-3.
Абсолюттік атом массасы (кг, г) - элементінің мольдік массасының Авогадро тұрақтысына қатысы. Мысалы,
m(O) =

m(O) =
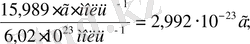
Абсолюттік массасының мәні сол сияқты массаның атомдық бірлігі мен салыстырмалы атомдық масса көбейтіндісіне де тең. Мысалы, m(O) =15, 999∙1, 6605∙10-23кг; (орын ауыстыру)
Абсолюттік молекула массасы (кг, г) берілген зат салыстырмалы массасының Авогадро тұрақтысына қатынасы көрсетіледі.
m(H2O) =
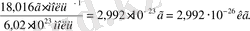
m(H2O) =
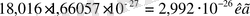 .
.
Жалпы материяның сақталу заңын 1748 ж. М. В. Ломоносов тұжырымдаған: « . . . Бір денеден қанша кемісе, екіншісіне соншама қосылады; бір жерден бірнеше материя азайса, басқа жерде соншаға артады . . . ». Химиялық реакцияларға қатысты бұл заң былай оқылады: «Химиялық реакцияға түсетін заттардың массасы әрқашан оның нәтижесінде түзілетін заттар массасына тең болады». Химиялық реакция кезінде бастапқы заттар құрамына кірген элемент атомдары ешқайда жойылып кетпейді, алынған қажетті мөлшерінде жаңа заттардың құрамына кіреді, сондықтан жалпы масса өзгермейді. Мысалы:
СuO + H2SO4 → CuSO4 + H2O
1 моль 1 моль 1 моль 1 моль
80 г + 98 г = 160 г + 18 г
Құрам тұрақтылық заңын 1801 ж. француз ғалымы Ж. Л. Пруст тұжырымдады: «Кез келген химиялық таза заттың құрамы оның алыну жолдарына тәуелсіз тұрақты болады». Бұл заң молекулалық құрылысты заттар үшін дұрыс болады, себебі молекула - тұрақты бөлшек, оның құрамы өзгермейді. Мысалы, СО2 құрамында әрқашан, оны қандай жолмен алса да, үнемі 27, 27 % көміртегі және 72, 73 % оттегі болады. Бертолленің пікірінше, заттардың құрамы алыну жағдайларына сәйкес ауыспалы болады. Қазіргі кезде біз білеміз: бұл - молекулалық емес құрылысты заттар. Олардың құрамы кристалдың түзілу жағдайларына байланысты өзгеруі мүмкін, себебі кристалдық затта әр бөлшектің өз орны болады. Егер кристалдың қалыптасу барысында қандай да бір кемшіліктер кетсе, жалпы кристалдағы әртүрлі элемент атомдары санының арақатынасы бұзылады, яғни заттың формуласына сәйкес келмеуі мүмкін. Мысалы, ТiO2 құрамы мына аралықта өзгеруі мүмкін: ТiO1, 9-2, 0. Сонымен, молекуласы бар заттардың құрамы үнемі тұрақты болады, оларды дальтонидтер деп атайды. Ал алыну жағдайларына байланысты құрамы өзгеріп отыратын молекулалық құрылысы жоқ заттар бертоллидтер деп аталды.
Қазіргі кезде эквивалент ұғымына келесідей түсінік беріледі. Эквивалент - бұл бөлшек. Эквивалент деген сонда қандай бөлшек?
Эквивалент - бұл химиялық реакцияларда сутегінің бір атомына (ионына) сәйкес келетін, яғни сонымен қосылысатын, оның орнын басатын немесе өзінен оны бөліп шығаратын заттың нақты немесе шартты бөлшегі.
Ал тотығу-тотықсыздану реакцияларында эквивалент бөлшегі бір электронға сәйкес келеді.
1. Зат массасының сақталу заңы
Атом-молекулалық ілім тұрғысынан қарағанда реакцияға қатысқан заттардың құрамында қандай атомдар қанша мөлшерде болса, реакция нәтижесінде шыққан заттардың құрамында сондай атомдар сонша мөлшерде болады. Бастапқы заттардың атом саны реакция нәтижесінде түзілген заттардың атом санына тең болады.
М. В. Ломоносов бұл заңды 1748 - 1756 ж. ж. ашты. Химия осы заң ашылғаннан кейін сапалық түрден сандық ғылымға айналды.
Энергия сақталу заңы:
Әрекеттесу кезінде жүйенің энергиясы тұрақты болады, тек бір түрден басқа түрге көшеді.
Реакция нәтижесінде энергия бөлінеді немесе сіңіріледі, яғни реакция өнімдеріндегі энергия қоры басқа заттардың энергиясымен салыстырғанда аз немесе көп болып келеді. Химияда заттағы энергия қоры құрамында жылуы бар бөлінетін немесе сіңірілетін энергияны жылу деп атайды. Осы заң негізінде химиялық реакцияның жылу эффектісін зерттейтін бөлімін химиялық термодинамика деп атайды. Өнеркәсіпте энергия сақталу заңы негізінде жылу балансы жүргізіледі.
nA + mB = AnBm
Бастапқы зат Реакция өнімі
4Р + 5О2 = 2P2O5
4*31 +10*16 = 4*31 + 10*16
284 = 284
∗ 2Mg+O2=2MgO v, моль 2 1 2
m(Mg) +m(O2) =m(MgO) Mr 24 32 40
M, г/моль 24 32 40
m, г 48 32 80
2. Құрам тұрақтылық заңы
Алыну жолына қарамастан кез - келген химиялық қосылыстың сандық құрамы бірдей болып келеді.
(Ж. Пруст, 1801 - 1808 ж. ж. ) . Қосылыс құрамына кіретін элементтер массаларының қатынасы тұрақты. Бұл заң тек газ және сұйық түрдегі заттарға қолданылады. Ал қатты күйдегі заттар қасиеттері бұл заңға негізделмеген. Себебі кез - келген қатты заттың кристалл құрылысында атоммен толтырылмаған бос қуыстар, басқа элементтердің атомдық қоспалары, идеалды құрылыстан ауытқуы байқалады.
Мысалы, висмуттың таллиймен қосылысында таллийдің масса бірлігіне 1, 24 - тен 1, 82 - ке дейін висмуттың масса бірлігі сәйкес келеді. ТіО2 титан диоксидінде титанның масса бірлігіне 0, 65 - тен 1, 67 - ге дейін оттегінің масса бірлігі сәйкес келіп, келесі формуламен беріледі: ТіО1, 9-2, 0. Бұл формула зат құрамының шекарасын көрсетеді.
Құрам тұрақтылық заңы берілген қосылысқа немесе жеке молекулаға макроскопиялық сандық құрамын анықтау үшін қолданылады. Бұл заң қосылыстың молекулалық формуласын, сандық құрамын анықтау үшін де
қолданылады. Технологиялық процесте Құрам тұрақтылық заңын қолдану арқылы бастапқы реагенттерді ысырапсыз қолданады және өнімді ластанудан қорғайды.
Су молекуласын мынадай тәсілдермен алуға болады:
2H2 + O2 = 2H2O
NaOH + HCl = NaCl + H2O
Cu(OH) 2 = CuO + H2O
CH4 + 2O2 = CO2 + 2H2O
Кейбір элементтер әр түрлі пропорцияларда қосылып, әр түрлі қосылыстар түзеді. Мысалы: оттек азотпен әрекеттесіп 5 түрлі оксид түзеді, оның әрқайсысында азот пен оттектің массалық қатынастары әр түрлі болады.
Массалық қатынастары
mN / mO
Құрам тұрақтылық заңы берілген қосылысқа немесе жеке молекулаға макроскопиялық сандық құрамын анықтау үшін қолданылады. Бұл заң қосылыстың молекулалық формуласын, сандық құрамын анықтау үшін де
қолданылады. Технологиялық процесте Құрам тұрақтылық заңын қолдану арқылы бастапқы реагенттерді ысырапсыз қолданады және өнімді ластанудан қорғайды.
Қосылыстар
Дальтонидтер Бертоллидтер
CH4, PCl3, H2S CuZn3, CuZn, W2C, WC
Мысалдар:
NaCl v(Na) : v(Cl) =1:1 m(Na) :m(Cl) =23:35, 5
2Na+Cl2=2NaCl 2Na+2HCl->2NaCl+H2
Na2O+2HCl->2NaCl+H2O NaOH+HCl->NaCl+H2O
3. Эквиваленттер заңы
Эквиваленттер заңы-химиялық заңдардың ең бір негізгісі . Олар химиялық элементтер бір-бірімен өздерінің химиялық эквиваленттеріне сай, белгілі сандық қатынаста әрекеттесетінін белгілейді. Эквивалент дегеніміз бағалары тең деген сөз. (И. Рихтер 1791 ж)
Эквивалент деп берілген қышқылдық негіздік реакцияда сутектің 1 катионына, немесе берілген тотығу-тотықсыздану реакциясында 1 электронға сәйкес шартты немесе нақты бөлшекті айтады. Зттың эквивалентінің 1 моль мөлшерінің массасын оның эквивалентінің молярлық массасы деп атайды. оның өлшем бірлігі-г/моль.
“ Эквивалентті ” дегеніміз “тең құнды” “тең бағалы” дегеніміз.
Элемент эквиваленті деп оның моль сутегі атомдарына тең құнды болған (эквивалент болған ) мөлшерін айтамыз.
Элемент эквиваленті деп оның моль сутегі атомдарына тең құнды болған (эквивалент болған ) мөлшерін айтамыз.
НСl Н2О NH3 СH4
Эcl = 1моль Эо=1/2 моль ЭN=1/3 моль Эс=1/4 моль
Эквивалент моляр массасы (г/моль) . Эквивалент көлем (көлем бірлігі) . Эквиваленттік факторы.
Әсерлесуші заттар массаларының бір-біріне қатынасын олардың эквиваленттерінің моляр массаларының қатынасындай қабылдаса болады.
m1 = Мэ (1)
m2 Мэ (2)
m1, және m2 -әсерлесуші заттар массалары, Мэ (1) және Мэ (2) олардың эквиваленттерінің моляр массалары.
∗ Мысалдар:
m(1) :m(2) =mэкв(1) :mэкв(2) 2NaOH+H2SO4=Na2SO4+2H2O
v, моль 2 1 1 2
Мr 40 98 142 18
M, г/моль 40 98 142 18
m, г 80 98 142 36
m(NaOH) :m(H2SO4) =mэкв(NaOH) :mэкв(H2SO4)
mэкв(NaOH) =40г
4. Авогадро заңы
Авогадро заңы. (А. Авогадро, 1811ж. ) . Бірдей температура мен қысымда әртүрлі газдардың бірдей көлемдеріндегі молекулалар саны бірдей болады.
Бұл заң ғылымға молекула заттардың кіші бөлшегі туралы қағида енгізді. Сонымен қатар атом элементтің ең кіші бөлшегі ретінде көзқарас та сақталды. Авогадро газ тәрізді жай заттардың молекулалары екі атомнан тұрады деп көрсетті.
Авогадро заңынан мынадай салдар шығады: бірдей жағдайда әртүрлі газдардың бірдей молекулалары бірдей көлем алады.
Әртүрлі газдар молекулалары мөлшерлерінің бір - бірінен үлкен айырмасы бола тұрса да (мысалы, Н2 мен С5Н12) бірдей сандары неге бірдей көлем алады? Оның себебі қалыпты температура мен қысымда газдар молекулаларының арақашықтығы молекулалар мөлшерінен бірнеше есе үлкен болады. Сондықтан газдар көлемі бірдей жағдайда молекулалар мөлшеріне емес, олардың арақашықтығына ғана байланысты болады. Газдар қысымын арттырып, температурасын өте төмендеткенде олардың молекулалары бір - біріне шегіне жете жақындасады. Мұндай жағдайларда газдар сұйық немесе қатты күйге айналуы мүмкін. Бұл сұйық немесе қатты заттардың көлемдері молекулалардың өздерінің алатын көлемдеріне байланысты болады.
Авогадро заңынан келесі өте маңызды салдар шығады: барлық заттардың моліндегі молекулалар саны бірдей, олай болса әртүрлі газдардың моліндегі молекулалар саны бірдей болғандықтан олар бірдей жағдайда бірдей көлем алады.
Мысалы, әртүрлі газдардың қалыпты жағдайда алатын көлемін есептейік. Тәжірибе бойынша қалыпты жағдайда 1 л сутектің массасы 0, 09 г, 1 л оттектің массасы 1, 43 г, 1 л азоттың массасы 1, 25 г. Газдардың әрқайсысының молінің массасын бір литр массасына бөліп, қалыпты жағдайда олардың бірдей көлем алатынын табамыз:
Vн2 = 2 г / моль / 0, 09 г / л = 22, 4 л / моль
Vо2 = 32 г / моль / 1, 43 г / л = 22, 4 л / моль
VN2= 28 г / моль / 1, 25 г / л = 22, 4 л / моль
... жалғасы
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz