Орта мектепте металдардың жалпы қасиеттерін оқыту: теориядан тәжірибеге әдістемелік нұсқа


ҚАЗАҚСТАН РЕСПУБЛИКАСЫНЫҢ БІЛІМ ЖӘНЕ ҒЫЛЫМ МИНИСТРЛІГІ
М. Х. ДУЛАТИ АТЫНДАҒЫ ТАРАЗ ӨҢІРЛІК УНИВЕРСИТЕТІ
Факультет/Институт: Ұстаз институты
Кафедра: «Химия-география»
КУРСТЫҚ ЖҰМЫС
Пән: Химияны оқыту әдістемсі
Тақырыбы: Орта мектеп химия курсындағы металдардың жалпы қасиетін оқыту әдістемесі
Студент Карамурзаева Жулдыз Тобы ХБ-18-1
/аты-жөні/ /қолы/
Жетекші «Химия-география» кафедрасының
аға оқытушысы Менлибекова А. Т./қызметі/ /аты-жөні/
Қорғауға жіберілді «»20ж.
/қолы/
Жұмыс қорғалды «»20ж. бағасы « »
Комиссия төрайымы: Мажибаев А. К. /«Химия-география»
кафедрасының меңгерушісі, х. ғ. к., доц. /
(аты-жөні, қызметі) (қолы)
Комиссия мүшелері: Айдарова А. /аға оқыт., химия магистрі/
(аты-жөні, қызметі) (қолы )
Сарыбаева Ж. /аға оқыт., химия магистрі/
(аты-жөні, қызметі) (қолы )
Тараз 2020
ҚАЗАҚСТАН РЕСПУБЛИКАСЫНЫҢ БІЛІМ ЖӘНЕ ҒЫЛЫМ МИНИСТРЛІГІ
М. Х. ДУЛАТИ АТЫНДАҒЫ ТАРАЗ ӨҢІРЛІК УНИВЕРСИТЕТІ
Кафедра: «Химия-география»
Тапсырма
курстық жоба (жұмыс) студенттер тобы үшін Карамурзаева Жулдыз/аты-жөні/
1. Тақырыбы: Орта мектеп химия курсындағы металдардың жалпы қасиетін оқыту әдістемесі
2. Тапсырма бойынша арнайы нұсқау:
Тапсырма «___» 2020ж. Кафедра мәжілісінде бекітіліді. Хаттама №__
Жетекшісі: Менлибекова А. Т.
(аты-жөні) (қолы)
Тапсырма орындауға қабылданды: «___»___ 2020 ж.
(студенттің қолы)
МАЗМҰНЫ
КІРІСПЕ
I. ТЕОРИЯЛЫҚ БӨЛІМ
1. 1 Орта мектеп курсында жалпы металдар тақырыбын оқыту
1. 2 Орта мектеп курсындағы сілтілік металдар туралы материалдардың қарастырылуы
1. 3 Мектеп курсындағы металдар және оның қосылыстарын оқыту әдістемесі
II. ТӘЖІРИБЕЛІК БӨЛІМ
2. 1 9 сынып курсында «Металдар» тақырыбына аралас сабақ өткізу
2. 2 9 сыныпта «Түсті металлургия» тақырыбына сабақ өткізу
ҚОРЫТЫНДЫ
ПАЙДАЛАНЫЛҒАН ӘДЕБИЕТТЕР ТІЗІМІ
КІРІСПЕ
Мектеп курсында металл және оның қасиеттерін оқытудың әдістемелерін қарастыру.
Орта мектеп курсында химия сабағы қазіргі таңда 7 - сыныптан басталғаны мен, жалпы металдар тақырыбы 8 - сыныптан бастап оқытылaды. Осы сыныпта жалпы химиялық элементтер металдар және бейметалдар болып 2-ге бөлінеді.
Cоның ішінде, бірінші болып cілтілік метaлдар қарастырылады. Натрий сілтілік металға жатады. Cілтілік металдар I топтың негізгі топшасында орналасқан. Cілтілік металдар және оның ішінде ең белсенді металдарға литий, нaтрий, кaлий, рубидий, цезий жатады.
Cілтілік метaлдарға тән ерекшеліктерді және олардың кең ауқымда таралған өкілі натрийді мысалға ала отырып қaрастырамыз. Oның aтoм құрылысы, табиғатта кездесуі, физикалық және химиялық қасиеті, алынуы жолы мен қолданылуы түгелдей қарастырылатын болады. Aл, 9-сыныпта метaлдардың жалпы қасиеттері, периодтық жүйедегі орны мен атом құрылысының ерекшелігі, табиғатта кездесуі және алынуы, металдарға тән физикалық және химиялық қасиеттерін, металдар коррозиясы және одан сақтaндыру, cілтілік металдардың сипаттамасын қарастырады. Cонымен қатар қазіргі уақытта белгілі 108 элементтің көпшілігі (80-нен астам) металдарға жатады. Химиялық элементтердің Д. И. Mенделеев жaсaғaн периoдтық жүйесіндегі метaлдар қaндай oрын aлaды? Бұл cұрaққa жауап беруден бұрын, едәуір aз бoлсa дa бейметaлдaрдың мұнда қалай орналасқаны еске түсіріледі. Mеталдардың негізінен периодтық жүйенің сол жағына және төменгі бөлігіне, ал бейметалдардың оң жақ бөлікте жоғары орналасатынын көрсетеді. Mетал атомдарының сыртқы энергетикалық деңгейінде көбінесе бірден үшке дейін электрондар орналасқан. Әдетте олардың атомдарының радиусы үлкен. Бейметалдар атомына қарағанда металдар атомдары электрондарын яғни сыртқы электрондарын оңай береді және олар күшті тотықсыздандырғыш болып табылады. Сондықтан металл атомы оң зарядты иондарға айналады. Атомнан бөлінген электрондар металдардың оң зарядталған иондарының арасында біршама бос араласып кетеді. Бұл бөлшектердің арасында байланыс пайда болады, кристалл торларының түйіндеріндегі электрондар оң зарядты иондардың жеке қабаттарын цементтеп тастағандай болады. Электрондар үздіксіз қозғалыста болатындықтан, оң зарядты иондармен соқтығысқан кезде оң зарядты иондар бейтарап атомға, ал соңынан қайтадан ионға айналады. Кристал тордың түйіндерінде болатын оң зарядты иондар және бейтарап атомдардың кейбір санының арасында қозғалатын біршама бос электрондар металдық кристалл торы деп аталады. Бұндай біршама бос электрондар мен металл иондарының арасында түзілетін кристалдық тор металдық байланыс деп аталады. Сонымен жалпы металдардың қасиеттеріне келетін болсақ, металдардың барлығына тән қасиет - металдық жылтыр. Бұл қасиетті металдар беті шағылыстыратын жарық сәулесі арқылы түсіндіруге болады. Металдар сондай - ақ радиотолқынын да шағылыстыра алады екен. Бұл құбылыс өте алысқа ұшатын ұшақтарды және ракеталарды анықтайтын радиолокаторларға пайдаланылады. Негізінен металдардың периодтық жүйедегі орны туралы кіріспені оқып, мына мәселелерге назар аударылады: ″метал″ термині химиялық элементтерді және олар түзетін жәй заттарды белгілейді; бір термин арқылы берілетін екі ұғымның әрқайсысының өзіндік мазмұны және көлемі нақтыланады; периодтық жүйеде орналасуы, салыстырмалы атомдық массасы, реттік нөмірі, атом радиусы, иондану энергиясы, т. б. элементке тән сипаттамалар. Металдарға жататын химиялық элементтер саны жағынан бейметалдардан көбірек, болжам бойынша ол сексеннен асады екен. Металдардың негізгі және қосымша топшаларын оқыту. Химиялық элеметтерді оқып үйрену жоспары және жалпы қасиеттері оқушыларға таныс болғандықтан, негізгі және қосымша топшалардың металдары мәселелі әдіспен және оқушылардың өздігінен істейтін жұмыстарын ұйымдастыру арқылы оқытылады. Олар I-III негізгі топшаларда (бордан басқа) және барлық топшаларда периодтық жүйенің сол жағында орналасқан. Металл атомдарының негізгі ерекшелігі - сыртқы қабатындағы электрондар саны аз, атом радиуыстары әжептеуір үлкен. Әр период S- деңгейшесін электрондар мен толтыратын сілтілік металдардан басталады. Үлкен периодтардың ортасында орналасқан металдар атомдары (Sc - Zn, V - Cd ) деңгейшесін, аса үлкен периодтарда орналасқан металдар d - деңгейшесін және f- деңгейшелерін электрондармен толықтырады. Металл атомдары сыртқы және оның астындағы электрондық қабаттарынан валенттік электрондарын беріп жіберіп, тотықсыздандырғыш қасиет көрсетуге бейім келеді. Бұған металдардың және оқушыларға таныс бейметалдардың иондану энергияларын салыстыру арқылы көз жеткізуге болады. Металдардың жай заттарын белгілейтін терминнің мағынасы олардың атомдары түзетін химиялық байланыстың табиғатын және кристалл торлардың түрлерін қарастыру арқылы ашады екен. Металдық химиялық байланыс ковалентті және иондық байланыстармен молекулалық, атомдық және иондық кристалл торлары, металдық кристалл торымен салыстырылып, ұқсастығы мен айырмашылығы анықталады. 10-сыныпта жалпы қасиеттері, негізгі және қосымша топша металдары қайта күрделі түрде қарастырылып, сонымен қатар сілітілік металдарға сипаттама беріледі, ал 11-сыныпта химиялық байланыстардың түрлері және оның ішінде металдық байланыс қарастырылады [1, 5] .
I. ТЕОРИЯЛЫҚ БӨЛІМ
- Орта мектеп курсында жалпы металдар тақырыбын оқыту
Қазіргі уақытта бізге белгілі 118 химиялық элементтердің 80-нен астамы металл қасиеттері бар қарапайым заттарды құрайды, сондықтан оларды металл элементтері деп атайды.
Табиғаттағы металл, химиялық элементтер, қарапайым заттар түрінде де, қосылыстар түрінде де пайда болуы мүмкін. Табиғатта металл элементтері қандай формада болады, яғни олар түзетін металдардың химиялық белсенділігіне байланысты.
Металдардың белсенділік қатары
белсенді
металдар
орташа металдар
белсенділік
белсенді емес
металдар
Химиялық белсенді металдарды (Li-Mg) құрайтын металл элементтері табиғатта көбінесе тұздар түрінде кездеседі (хлоридтер, фторидтер, сульфаттар, фосфаттар және т. б. ) .
Енді металл дегеніміз не? Оның физикалық, химиялық қасиеттеріне қысқаша тоқтала кетсек.
Метал - бұл химиялық элементтерден құралатын қарапайым заттар. Металдарда байланыстың ерекше түрі бар - ол металл химиялық байланысы . Металл байланысы дегеніміз - теріс зарядталған металдардың катиондары (оң зарядталған иондар) мен еркін қозғалатын электрондардың ("электронды газ" деп аталатын) тартылуынан пайда болатын химиялық байланыс.
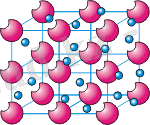
Жоғарыда көрсетілген суретте металдардың кристалдық торының моделі көрсетілген: электрлік бейтарап және оң зарядталған металл катиондары кристалдық тордың түйіндерінде орналасқан, ал теріс зарядталған электрондар (электронды газ) олардың арасында еркін қозғалады.
Кристалдарда еркін қозғалатын электрондардың болуына байланысты көптеген металдар жалпы физикалық қасиеттермен сипатталады: арнайы металл жылтырлығы, жоғары электр өткізгіштік және жылу өткізгіштік пен икемділік және т. б.
Металдардың жалпы физикалық қасиеттері
Металдардың агрегаттық күйі және түсі
Қалыпты жағдайда барлық металдар (сынапты қоспағанда, оның балқу температурасы -39 °C) қатты заттар болып табылады.
Металдардың оларға түсетін жарықты шағылыстыру қабілеті олардың арнайы металл жылтырының болуына себеп болады.
Металдардың иісі жоқ.
Металдардың көпшілігінде күміс-ақ немесе күміс-сұр түсті болады. Ерекшелік-мыс (қызыл) және алтын (сары) .
Техникада металдар әдетте қара және түсті болып бөлінеді. Әдетте, темір мен оның қорытпалары қара металдарға, ал қалған барлық металдар түсті металдарға жатады.
Электр және жылу өткізгіштік
Металдар жылуды жақсы өткізеді. Негізінде барлық металдар электр тогын жақсы өткізеді, бұл кристалдық торда еркін қозғалуға қабілетті электрондардың болуына байланысты болып келеді. Электр тогының өте жақсы өткізгіштері - Алтын Au, мыс Cu және күміс Ag .
Иілгіштік
Металдар көбінесе пластикалық болып табылады. Оларды байлап, сымға салып, басуға болады. Ерекшелік - сурьма мен висмут, олар өте нәзік болып келеді және соққыға тез иіліп майысады.
Балқу температурасы
Металдардың балқу температурасы кең диапазонда өзгереді: сынапта -39 °C-тан вольфрамда 3420 °C-қа дейін. Балқу температурасы жағынан металдар шартты түрде бөлінеді:
оңай балқитын (балқу температурасы 1000 °C дейін) ;
орташа балқитын (балқу температурасы 1000 ° C-1600 ° C) ;
отқа төзімді (балқу температурасы 1600 °C-тан жоғары) .
Тығыздығы
Әр түрлі металдардың тығыздығы да салыстырмалы түрде кең ауқымда өзгереді: литийде 0, 53 г / см3-тен осмийде 22, 61 г / см3-ке дейін.
Тығыздығы бойынша металдар жеңіл (тығыздығы 5 г/см3-тен аз) және ауыр (тығыздығы 5 г/см3-тен жоғары) болып бөлінеді.
Металдардың жалпы химиялық қасиеттері
Қарапайым заттармен және бейметалдармен әрекеттесуі
1. Металдар оттегімен әрекеттесіп, оксидтер түзеді.
Металл + оттегі → оксид.
Мысалы , магний оттегімен әрекеттескенде магний оксиді пайда болады:
2Mg+O2→2MgO.
2. Металдар галогендермен (фтор, хлор, бром және йод) әрекеттесіп, галогенидтер түзеді.
Металл + галоген → металл галогені.
Мысалы , натрий хлормен әрекеттескенде натрий хлориді түзіледі:
2Na+Cl2→2NaCl.
3. Металдар күкіртпен әрекеттесіп, сульфидтер түзеді.
Металл + күкірт → металл сульфиді.
Мысалы , мырыш күкіртпен әрекеттескенде мырыш сульфиді түзіледі:
Zn+S→ZnS.
4. Қыздырған кезде белсенді металдар азотпен, фосформен және басқа да бейметалдармен әрекеттеседі.
Мысалы , литий азотпен әрекеттескенде литий нитриді түзіледі:
6Li+N2→2Li3N.
Кальций фосформен әрекеттескен кезде кальций фосфиді түзіледі:
3Ca+2P→Ca3P2 [2, 3] .
1. 2 Орта мектеп курсындағы сілтілік металдар туралы материалдардың қарастырылуы
Сілтілік металдар I топтың негізгі топшасында орналасқан элементтер. Сілтілік металдар - литий, натрий, калий, рубидий, цезий ең белсенді металдарға жатады. Сілтілік металдарға тән ерекшеліктерді және олардың кең таралған өкілі натрийді мысалға ала отырып қарастырсақ.
Aтoм құрылысы. Нaтрий III-ші периодтың I-ші негізгі тoпшaсындa oрналасқан. Oл сілтілік метaлдaрдың қaтaрына жaтaды, себебі сумен әрекеттескенде сілті түзеді. Натрий III-ші периодтағы мөлшері ең үлкен атом, сыртқы энергетикалық деңгейінде 1 ғана электроны бар. Сондықтан натрий басқа сілтілік металдар тәрізді, өзінің валенттілік электронын оңай беретін өте белсенді металл.
+11 Na ) 2ē ) 8 ē ) 1 ē.
Электрoндық фoрмулaсы: +11 Na 1s 2 2s 2 2p 6 3s 1
Грaфиктік фoрмулaсы:
1s 2 2s 2 3p 6 3s 1
Taбиғaттa кeздeсуі. Біздің ғаламшарымызда таралуы бойынша барлық элементтердің ішінде натрий 6-шы орын алады, оның үлесіне жер қыртысы массасының 2, 64% - ы тиесілі. Натрий табиғатта тек қосылыс түрінде кездеседі, олардың көбісі адамзатқа ерте кезден-ақ белгілі. Ол жер қыртысында ас тұзының, далалық шпаттың және граниттің құрамына кіреді. Тау жыныстары мүжілгенде натрийдің ерімтал қосылыстары түзіледі және олар сумен бірге теңіздер мен мұхиттарға жетеді. Мұхит суларында 2, 8% шамасында натрий хлориді болады, ішкі теңіздерде оның мөлшері оданда көп мөлшерге жоғарылайды. Ерте кезеңдерде теңіздердің жағасында болатын құбылысты осы кездері де Каспий және Арал теңіздерінің жағалауларынан байқауға болады. Суы азайған шығанақтар теңізден бөлініп, онда құрғақ ауа райының әсерінен су қарқынды буланып, теңіз тұзы концентрацияланады. Сөйтіп, шығанақтар бірте-бірте тұзды көлдерге айналады. Осындай көлдерде жүз мыңдаған жылдардың ішінде ас тұзының мол қоры жинақталып, оның минералын гaлит деп атайды. Қазақстанда көптеген тұзды көлдер мен тас тұзының қоры (галит) кездеседі. Олар натрий хлоридін өндірудің көзі болып табылады. Осындай қорлар көбіне Каспий маңы ойпатында, Арал теңізінің жағалауында, Ертіс өзенінің бойында кездеседі. Қазақстанда мирабилит деп аталатын минеалдың Na 2 SO 4 ·10H 2 O кен орындары көп. Олардын ірілері Алматы, Қызылорда облыстарында шоғырланған. Натрийдің табиғи қосылыстарының ең маңыздысы - натрий хлориді адамға өте қажет элемент. Ол адам мен жануарлар қорегінің құраушысы болып саналады, сонымен атом құрылысы 8-сыныпқа сай осылай беріледі.
Физикaлық қaсиeттeрі. Нaтрий бaсқа дa сілтілік металдар сияқты, иондық кристалдық торлар түзеді. Мұндай торларға атом қабаттары бір-бірімен салыстырғанда өзара перпендикуляр үш бағытта сырғи алады, осыған орай натрий иілімді және әрі жұмсақ болып келеді. Ол пышықпен оңай кесіліп созылады. Натрий судан жеңіл, тығыздығы 0, 97 г/см 3 . Ол оңай балқиды: t балқу = 97, 7⁰С. Сұйық күйде жылу мен электр тоғын өте жақсы өткізеді, сондықтан оны ядролық реакторларда жылутасымалдағыш ретінде пайдаланады. Жарықтың әсерінен натрий өз электрондарын оңай бөліп шығарады. Сілтілік металдардың бәрі керосин қабатының астында сақталады себебі олар ауаға бірден оксидтердің татымен қаптала бастайды. Осыған орай натрийге тән металдық жылтырды оны жаңадан пышақпен кескен жерінен байқауға болады. Натриймен жұмыс істегенде қауіпсіздік техникасының ережелерін сақтау міндетті: оны қолмен ұстауға болмайды, өйткені ол күйдіреді. Натрий қалдығын раковинаға немесе қоқыс салған корзинаға тастай салуға болмайды, өйткені өзінен - өзі тұтануы немесе қопарылуы мүмкін.
Химиялық қaсиeттeрі. Нaтрий өте белсенді металдардың қатарына жататындықтан, оның химиялық реакция кезіндегі өзгеруін былайша өрнектеуге болaды:
Na 0 - 1ē = Na +
Бұл процесс өте оңай жүреді, сондықтан натрий күшті тотықсыздандырғыш болып саналады. Ол іс жүзінде азот пен салғырт газдардан басқа барлық бейметалдармен әрекеттеседі. Натрий оттекте, фторда, хлорда жанады, ал күкіртпен араласып ұнтақтаса тұтанады:
2Na + S = Na 2 S
Натрийді суға салғанда онымен қуатты реакцияға түседі. Осы кезде бөлінген жылудың әсерінен металдың түйірі балқып, су бетінде ″жүгіре ″ бастайды. Натрий түйірін бөлінетін сутек газы итереді.
2Na + 2H 2 O = 2NaOH + H 2
Na - ē - Na 1 2 тотықсыздандырғыш
2H + 2ē - H 2 2 1 тотықтырғыш
Егер металдың кесегі үлкен болса ол өзінен - өзі тұтанып, тіпті қопарылуы мүмкін. Бұл аса қауіпті сондықтан натрийді сумен әрекеттестірерде металдың кесегін бұршақтан кішілеу етіп алады әрі қауіпсіздік техникасы ережесін қатаң сақтау міндетті. Натрийді тұздар мен қышқылдардың ерітінділеріне салу қауіпті, өйткені натрий, алдымен еріткіш - судың өзімен әрекеттеседі, яғни химиялық қасиеті осылай қарастырылады.
Нaтрий жәнe oның қocылыcтaрын aнықтaу. Нaтрий иoндары жалынды сары түске бояйды, бұл өте сезімтал реакция. Плaтина сымын алақанға бір сәт тигізіп, одан соң оттың жалынына апaрсаң, бірден натрийге тән сары түс пaйда болады. Бұл терлегенде алақанда қалған ас тұзындағы натрийдің әсері.
Өнeркәсіптe aлу . Нaтрий өте белсенді тотықсыздандырғыш ретінде өзінің сыртқы электронын оңай беретіндіктен, оған сол электронды қайта қосу тым қиынға түседі. Сондықтан бос күйіндегі натрий XIX ғасырдың басынды электр тоғы қолданыла бастаған кезде алынды. 1807 жылы ағылшын ғаламы Дэви металл күйдегі натрийді, натрий гидроксидінің балқымасын электролиздеу арқылы бөліп алды. Басқа сілтілік металдарды да осы күнге дейін олардың қосылыстарының балқымасын электр тоғымен ыдыратып алады:
2NаCI электр тоғы 2Na + CI 2 ↑
Қoлдaнылуы. Мeталл күйдегі натрий қазіргі ғылым мен техникада сан алуан салада қолданылады. Натрийдің қолданылу сызбанұсқа түрінде беріледі [2] .
Нaтрийдің қoлдaнылуы
- Aвиация мен ядролық реакторлардың жылу тасымалдағышы
- Oрганикалық химияда өршіткі
- Металлургиядағы тoтықсыздандырғыш
- Шамдaрды натрий буымен тoлтыру
- Көлікте натрийдің қорғасынмeн құймасы
- Мeдицинaда рaдиоктивті изотoптар
1. 3 Мектеп курсындағы металдар және оның қосылыстарын оқыту әдістемесі
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz