Аналитикалық химия: технологиялық мамандықтарға арналған қысқаша курс - гравиметрия, титриметрия және физика-химиялық талдау әдістері


ҚАЗАҚСТАН РЕСПУБЛИКАСЫНЫҢ БІЛІМ ЖӘНЕ ҒЫЛЫМ МИНИСТРЛІГІ
АЛМАТЫ ТЕХНОЛОГИЯЛЫҚ УНИВЕРСИТЕТІ
ҚОЗЫБАЕВ А., ОМАРҚҰЛОВ Т. О.,
ЖЕКСЕНБАЙ Н.
АНАЛИТИКАЛЫҚ ХИМИЯНЫҢ ҚЫСҚАША КУРСЫ
Алматы, 2015
ЭӨЖ 543(075. 8)
ББК 24. 4я73
Оқулық Алматы технологиялық университетінің әдістемелік бірлестігімен баспаға ұсынылған
Пікір жазғандар:
Қозыбаев А. Омарқұлов Т. О., Жексенбай Н.,
«Аналитикалық химияның қысқаша курсы»: оқулық кредиттік технология бойынша технологялық мамандықтарда оқитын студенттерге арналған. - Алматы: АТУ, 2015. - 209 бет.
ISBN
Оқулық ҚР оқу және білім министрлігінде бекітілген «Аналитикалық химияның» типтік бағдарламасы бойынша құрастырылған, жоғарғы оқу орнында технологиялық мамандықтар бойынша оқитын студенттерге және оларды оқытатын мұғалімдерге арналған.
Оқулық технологиялқ кредиттің талаптарына сәйкес құрастырылған және дәріс конспектісін, зертханалық тәжірибелер, тәжірибелік сабақтар, студенттердің мұғалімдермен бірігіп жасайтын тапсырмалары толығымен берілген.
Оқулық күндіз, сырттай, арақашықтықта аудиторияда және аудиториядан тыс жерде оқитын студенттерге арналған, сонымен қатар кредиттік технология бойынша технологиялық мамандықтарға жоғарғы оқу орындарында сабақ беретін мұғалімдерге арналған.
ЭӨЖ 543(075. 8)
ББК 24. 4я73
ISBN
© АТУ, 2015
©Қозыбаев А. Омарқұлов Т. О., Жексенбай Н.
КІРІСПЕ
Бұл оқулық Мемлекеттік оқу стандартына сәйкес және аналитикалық химияны технологиялық мамандықтарында кредиттік технология бойынша оқитын студенттерге арналып жазылған.
Бірінші бөлімінде аналитикалық химияның классикалық (химиялық) әдістері гравиметрия және титриметрия қарастырылған. Осы әдістердің теориялық негіздері, қолданылатын жерлері, жетістіктері мен кемшіліктері, метрологиялық сипаттамалары қысқаша баяндалған. Көлсетілген аналитикалық анықтаулардың схемалары студенттерді осы тәсілдердің негізімен және жалпы түсініктерімен танысуға мүмкіндік жасайды. Дегенмен теориялық, практикалық және есептеу бөліктері бір - бірімен тығыз байланысты.
Екінші бөлімінде физика - химиялық анализ тәсілінің теориялық негіздері қысқаша көрсетілген: спектральды, электрохимиялық, хроматографиялық. Осы тәсілдердің аналитикалық мақсатта қолдану мүмкіншіліктері айтылған.
Жоғарыда айтылғандай әдістеме екі бөлімнен тұрады: классикалық (гравиметрия, титриметрия) және физика - химиялық (оптикалық, электрохимиялық, хроматографиялық) талдау әдістерінен тұрады. Мұнда аналитикалық химияның барлық тақырыбын қамтиды. Әр бір тақырыптағы теориялық негіздері мен есептеулер келтірілген, олар мысалдар мен пысықталынған. Сонымен қатар студенттерді оқу материалдары мен жұмыс істеуге және ғылыми көзқарастарын дамытуға мүмкіндік жасалынған. Осының барлығы студенттер өз бетінше дайындалып сабақты және емтиханды дұрыс тапсыруға жағдай жасайды. Студенттердің білімінің сапалылығын жазбаша түрде және ауызша тексеруге болады.
Оқулық сырттай және күндіз оқитын студенттердің өз бетінше жұмыс жасауына негізделген.
БӨЛІМ 1. ДӘРІС КОНСПЕКТІЛЕРІ Тақырып 1. Химиялықлық талдау әдістері және оның түрлері
Аналитикалық химияның теориялық негіздері қоғамтану пәнінің заңдары, Д. М. Менделеевтің периодтық заңы, зат массасының және энергияның сақталу заңы, заттың құрам тұрақтылық заңы, массалық әсерлесу заңы А. М. Бутлеровтың химиялық құрылыс теориясынан құралады.
Аналитикалық химияда анализдеу мен синтездеу тығыз байланысты. Анализ-бұл заттардың құрам бөлігін анықтауға және химиялық қосылыстарды синтездеуге, түсті ерітінділерді, ерігіштігі аз кристалды заттарды зерттеуге негізделген.
Аналитикалық химияның әдістері.
Аналитикалық химия екі бөлімнен тұрады: химиялық (классткалық) және физика-химиялық анализ.
Химиялық талдау әдісі екі негізгі бөліктен тұрады:
а) гравиметриялық;
б) титриметриялық.
Физика - химиялық талдау әдісі:
а) оптикалық талдау және спектралды анализге;
б) электрохимиялық талдауға;
в) хроматографиялық анализге және т. б. бөлінеді.
Бұлардан да басқа әдістер бар, мысалы: металлдарды анықтау, судың кермектілігін анықтау, тамақ өнімдерін анализдеу, органикалық қосылыстарды анықтау. Соңғы жылдары компьютерді және математикалық әдістерді химиялық анализдерде кеңінен қолданып келеді.
Заттармен азық-түліктердің сапасын анықтау әдістеріне қойылатын талаптар:
Әдісті стандарттау және унификациялау;
- Анализдеу әдістемесін бекіту;
- Заттың сапасын көрсететін құжатта тіркеу. Аналитикалық сигнал.
Барлық аналитикалық әдістер аналитикалық сигналды өлшеу мен анықтауға негізделген.
Аналитикалық сигнал-бұл заттардың физикалық және химиялық қасиеттерін анықтау үшін және компоненттердің сандық, сапалық мөлшерін табу үшін қолданатын факторлар.
Физикалық анализ әдісінде (химиялық реакциясыз) аналитикалық сигнал ретінде қайнау температурасын алады;
Гравиметриялық анализде аналитикалық сигнал ретінде тұнбаның массасын алады;
Титриметриметриалық анализде аналитикалық сигнал ретінде титрдың көлемі алынады.
Физико-химиялық анализ әдісінде аналитикалық сигнал ретінде физикалық мәндерді алады. Мысалы, тоқ күші, оптикалық тығыздық, электр өткізгіштіктер.
Гравиметриялық анализ әдісінің мәні
Гравиметриялық анализ заттардың массасын анықтауға негізделген.
Гравиметриялық анализдің екі түрі бар: айдау әдісі және тұнбаға түсіру әдісі.
- айдау әдісі мен ұшқыш заттардың массасын анықтайды;
- тұндыру әдісі мен тұнбаға түсетін заттарды анықтайды.
Гетерогенді ортадағы тепе-теңдік (С. Ж. Ж. - студенттің жеке жұмысы)
Аз еритін қосылыстарды тұнбаға түсіргенде гетерогенді жүйемен кездесеміз. Тұнба ерітіндімен беттескенде екі жүйе болады -қатты және сұйық. Бұл жағдайда тұнба ериді, осы кезде динамикалық тепе-теңдік орнайды.
тұнба АВ
 А
+
+ В
-
ер-ді.
А
+
+ В
-
ер-ді.
Массалық әсерлесу заңы бойынша, тепе-теңдік орнағанда,
= К АВ немесе
 =соnst [А
+
] [В
-
] = К
Ав
;
=соnst [А
+
] [В
-
] = К
Ав
;
 =соnst
=соnst
мұндағы, [А + ] [В - ] - концентрациялық көбейткіш (КК) ;
К
АВ
 - ерігіштік көбейткіш (ЕК) .
- ерігіштік көбейткіш (ЕК) .
ЕК-бұл гетерогенді тепе-теңдіктің тұрақтысы (константа) тұнба
 ер-ді яғни ЕК
[АК]
= [А
+
] [В
-
] .
ер-ді яғни ЕК
[АК]
= [А
+
] [В
-
] .
Тұнбаның түзілуі және еруі
Егер КК>ЕК тұнба түзіледі (таблицадан алынған мән қаныққан ерітінді) . КК ерітіндідегі ион < ЕК тұнба тұнбаның еруі (таблицалық мән) қанықпаған ерітінді. ЕК аз еритін қосылыстардың концентрациясы басқа заттардың концентрациясына байланысын көрсетеді. ЕК-ті пайдаланып заттардың тұнбаға түсуін, еруін және реакциялардың жүруін анықтауға болады.
Біртекті иондар тұнбаның түзілуіне әсер етеді. Бұл жағдайда тұнбаның ерігіштігі азаяды. Тепе-теңдік - тұнба түзілу жағына ығысады.
Тұнбаның еру процессі кезінде қаныққан ерітіндінің құрамынан электролиттің бір ионын шығарып, оны басқа жаңа қосылыпен байланыстыруқажет. Ерітінді қанықпаған күйге айналады да тепе-теңдік тұнбаның еріген бағытына ығысады.
Тұнбаның ерігіштігіне әсер ететін факторлар
Ерітіндінің рН-ң өзгеруі - сутегінің көп иондары тұнбаның еру қабілетін арттырады.
Ерітіндінің құрамында кешен түзуші заттар болса-тұнба ериді.
Тұз эффектісі-тұнбаның ерігіштігі ұқсас иондары жоқ басқа тұздардың қатысуы мен артады.
Бөліп түнбаға түсіру. Ерітіндіде қатысатын бірнеше иондар тұнба түзеді. ЕК-ке байланысты тұнбаға түсу реті: бірінші ЕК-аз тұнба арықарай ЕК-тің артуына байланысты тұнба түзіле береді.
Тұнбаға түсіру әдісінің схемасы:
- Пробаны (затты) өлшеу және еріту;
- Анықтайтын компонентті тұнбаға түсіру;
- Сүзу және жуу;
- Кептіру және қақтау (прокаливание) ;
- Өлшеу және анализ нәтижесін есептеу.
Бұлардың ішіндегі негізгісі тұнбаға түсіру. Тұнбаға түсіргішті дұрыс таңдау мен тұнбаға түсіру заттың формасына, структурасына, тұнбаның тазалық дәрежесіне және оның мөлшеріне, концентрациясына байланысты болады.
Тұнбаның формасы
Көбінесе тұнбаны қақтағанда өзінің химиялық құрамын өзгертеді. Мысалы,
2Fe 3+ тұнбаға түсіру ↓ 2Fe(OH) 3 t 0 C Fe 2 O 3
анықталатын тұнбаға гравимериялық
зат түсу формасы (өлшеу) формасы
Тұнбаға түсу формасы-ол анықталатын компоненттің ерітіндіден тұнба ретінде басқа қосылыс түрінде түзілуі;
Гравимериялық форма тұнбаның (заттың) қақтағаннан кейінгі формасы. Кейде қақталған тұнба (зат) өзінің химиялық формасын өзгертпейді. Мысалы,
Ba 2+ + SO 4 2- →↓BaSO 4
анықталатын зат
BaSO 4 қақтау BaSO 4
тұнбаға түсу гравиметриялық (өлшеу)
формасы формасы
Тақырып 2. Тұнбаның түзілу механизмдері және оған қойылатын талаптар. тұнбаның ластануы және тазарту жолдары
Қатты фазаның (тұнбаның) түзілу күрделі процесс, оны мына схемамен көрсетуге болады.
Анықталатын компонент + тұнба түсіргіш
↓
индукциялық кезең
(алғашқы кристалдардың түзілуі)
↓
тұнбаның түзілуі
(үлкен бөлшектердің түзілуі)
↓
бөліп-бөліп жылдам тұнбаға
тұнбаға түсіргішті құю түсіргішті тез құю
алғашқы кристалл алғашқы кристалдардың
бетінде заттың бөлінуі үлкен агрегаттарға
қосылуы (коагуляция)

кристаллды аморфты
тұнбаның түзілуі тұнбаның түзілуі
Сурет 1 - Кристалды тұнбаның түзілуі
Аналитикалық мақсатта күрделі кристаллды тұнбамен жұмыс жасаған ыңғайлы. Осыны ескеріп күрделі кристалды тұнбаның түзілуіне жағдай жасау қажет.
Аморфты тұнбаның түзілуі.
Аморфты тұнбалар коллоидтты бөлшектердің бірігуінен түзіледі. Коагуляция және пептизация процессін болдырмау үшін, аморфты тұнба түзілуіне жағдай жасау қажет.
Гравиметриялық анықтаудың оптимальды жағдайын жасауға теориялық негіздері
Кез-келген затты анықтау үшін, анализдің дәл мәні қажет, сондықтан оптимальдық жағдайды жасау керек:
- Тұнбаға түсіргішті анықтау;
- Тұнбаға түсу және гравиметриялық форманы дұрыс анықтау;
- рН тұнбаға түсуге әсері;
- Кешен түзілудің әсері;
- Жуатын сұйықты таңдау;
- Тұз эффектісі.
- Бірігіп тұнбаға түсу (соосаждение) .
Тұнба түзілген кезде бірігіп басқа қоспалар түседі. Оның бірнеше түрі бар: адсорбция, окклюзия, изоморфизм:
- адсорбция: қоспа қатты фазаның бетінде орналасады;
- окклюзияда қоспа тұнбаның ішкі қабатында орналасады;
- изоморфизмде аралас кристаллдар түзіледі.
Анализ жүргізген кездегі бірігіп тұнбаға түсудің себептері:
- гравиметриялық анықтау жүргізгенде қате жіберу;
- микрокомпонент кез-келген коллектор-мен (носитель) бірігіп түседі;
- реакцияның сезімталдығын артырады;
- тұнбаға түсу жағдайын арттырады;
- анализге кедергі жасайтын заттарды жою.
Ластанудан тазарту жолдары:
- қоспаларды басқа иондармен біріктіріп, аз тұнбаға түсетін формаға ауыстырады;
- тұнбаны жақсылап жуу;
- қайта тұнбаға түсіру;
- тұнбаға түсіру талаптарын бұзбау.
Гравиметриялық әдістегі есептеулер:
- Анализге берілген заттың сынамасын есептеу.
m(анализ. зат) =К
(1)
мұндағы, К - тұнбаның түріне сәйкес коэффициент.
Егер тұнба аморфты болса К = 0, 1, ал кристалды болса К = 0, 5
p, q - стехиометриялық коэффициен
- Тұнбаға түсіргіштің (т. т) көлемін есептеу.
V(т. т. ) = 1, 5
(2)
мұндағы, q, р - стехиометриялық коэффициент;
 ,
,
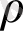 - тұнбаға түсіргіштің тығыздығы;
- тұнбаға түсіргіштің тығыздығы;
- анықталатын заттың мөлшерін есептеу.
F=
(3)
мұндағы, Р, q - стехиометриялық коэффициент.
m(анық. зат) = m (грав. ф) ⋅F (4)
 (анық⋅зат) =
(анық⋅зат) =
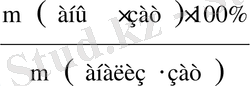 =
=
 (5)
(5)
Титриметриялық анализ анықтауға берілген затқа жұмсалған титранттын (реактивтің) дәл көлемін өлшеуге негізделген әдіс, сондықтан оны кейде көлемдік анализ деп атайды.
Сол жұмсалған титранттың көлемі арқылы анықталатын заттың мөлшерін табады. Титрант ретінде берілген ерітіндінің концентрациясы жоғары дәлдікпен анықталған болу керек. Бұндай ерітінді титрленген немесе стандартты деп аталады. Ал титрленетін (анализге берілген ерітінді) жұмысшы енрітінді деп аталады.
Титрлеу - бұл титрант титрлейтін ерітіндіні жайлап (тамшылатып) қосып отыру.
Эквиваленттік нүкте (Э. Н. ) - бұл титрлейтін ерітінді мен титранттың көлемі химиялық эквивалентті түрде тең болған кезі.
Эквиваленттік нүктеге жеткен кезде эквиваленттік заң орындалады.
Титрант ерітіндісін стандарттау - бұл оның жоғары дәлдікпен концентрациясын тұрақтандыру.
Сурет 2 - Титриметриялық анализ әдісінің классификациясы
Титриметриялық анализ бірнеше топқа бөлінеді:
- титрлеу реакциясының типіне қарай;
- титрлеу әдісіне байланысты;
- титрлеу түріне байланысты.
Реакция түріне байланысты классификациялау:
- қышқылдық - негіздік титрлеу әдісі (протон алмасу) ;
- тотығу - тотықсыздану әдісі (перманганатометрия, иодометрия т. б. ) ;
- кешен түзу әдісі (комплексонометрия, меркуриметрия т. б. ) ;
- тұнбаға түсіру әдісі (аргентометрия, меркурометрия т. б. ) .
Титрлеу әдісі.
- тура титрлеу;
- кері титрлеу.
Титрлеу түрі.
- пипетирлеу әдісімен титрлеу;
- жеке өлшеу әдісімен титрлеу.
Титриметрия әдісіндегі есептеулер.
Титриметрия әдісінде эквиваленттік факторға (f э ), эквиваленттік молярлы масса (М э ), эквиваленттік молярлы концентрациясы (С э ), молярлы концентрация (С) .
Титриметриялық анализ әдісінде концентрацияны титр (Т) арқылы өрнектейміз.
- жұмысшы заттың титрімен (Тж. з. ) немесе титр:
Т ж. з. =
; Т(х) =
(6)
өлшем бірлігі г/мл, г/см 3 .
С э (х) ⋅ V(х) = С э (х) ⋅ V(х) (7)
мұндағы С э (х), V(Х) - бірінші ерітіндінің нормалды конценрациясы және көлемі.
С э (Х), V(Х) - екінші ерітіндінің нормалды концентрациясы және көлемі.
Тақырып 4. Қышқылдық - негіздік титрлеу әдісіН + + ОН - = Н 2 О - бұл әдіс осы реакцияға негізделген.
Қышқылдық - негіздік титрлеу әдісінің екі түрі бар:
алкалиметрия - титрант - негіз титрлейтін ерітінді - қышқыл
ацидиметрия - титрант - қышқыл титрлейтін ерітінді - негіз.
Бұл әдісімен Н + және ОН - концентрациясы өзгереді. Яғни титрлейтін ерітіндінің рН өзгереді. рН-тың белгілі бір мәнінде эквиваленттік нүктеге жетеді, осы кезде титрлеуді тоқтатамыз.
Қышқылдық - негіздік титрлеу индикаторлары.
Э. Н. анықтау индикатордың көмегімен жүргізіледі, рН - тың белгілі мөлшерінде ерітіндінің түсі өзгереді. Индикатордың түсінің өзгеруі. Освальдтың иондық теориясына және хромоформ теориясына негізделеді.
Титрлеу қисығы
Титрлеу қисығы индикаторды анықтау үшін қажет. Титрлеу қисығын рН есептеу арқылы тұрғызады: 1) Э. Н. дейін ; 2) Э. Н. 3) Э . Н. кейін.
Э . Н. - ге жақын жерде рН-күрт өзгереді титрлеу биіктігі пайда болады. Титрлеу биіктігінде жатқан индикатор титрлеу үшін жарайды.
рН
индик.
Э. Н. V, мл
Сурет 3 - Титрлеу қисығы
Биіктік мәні титрлейтін ерітіндінің концентрациясына байланысты. Титрлейтін ерітінді әксіз болса, биіктік төмен болады. Биіктік азайған сайын қолданатын индикатор да азаяды.
Титрлеудің - 4 түрі бар:
- күшті қышқылды күшті негізбен және керісінше титрлеу;
- әлсіз қышқылды күшті негізбен және керісінше титрлеу;
- күшті қышқылды әлсіз негізбен және керісінше;
- әлсіз қышқылды әлсіз негізбен титрлеу.
Тотығу-тотықсыздану титрлеу әдісі-анықталатын затты тотықтырғыш және тотықсыздандырғыш титрлеуге негізделген.
Тотығу-тотықсыздану реакциясының төрт түрі бар:
- перманганатометрия - KMnO4;
- иодометрия - J2немесе J-;
- дихроматометрия -K2Cr2O7;
- броматометрия - KBrO3.
Тотығу-тотықсыздану раекциясының негізінде электронейтралды заң жатады: егер бір зат тотықса белгілі бір электронын беріп, келесі зат тотықсызданады, электронды қабылдап электронейтралды заң материяның сақталу заңының жалғасы.
Екі жүйенің жартылай реакциясының схемасын былай жазуға болады:
Тотық.
1
+Тотықсыз.
2
 Тотықсыз.
1
+Тотық.
2
редокси жұптары қатысады.
Тотықсыз.
1
+Тотық.
2
редокси жұптары қатысады.
Тотығу-Тотықсыздану бағыты тотығу-тотықсыздану потенциалының редокс-жұбының салыстырмалы күшіне байланысты. Тотығу-тотықсыздану потенциалын өлшеуді гальваникалық элементтің көмегімен жүргізеді, ол стандартты потенциал деп аталады - Е 0 .
стандартты потенциал - ионды беру және қабылдау қабылеті;
Е 0 - үлкен болған сайын күшті тотықтырғыш, керісінше тотықсыздану қабылеті аз;
2-і тотықтырғыштан қайсысының күші аз болса содан электронды алады;
егер Е(Э. Қ. К. ) = Е 0 (тот. ) - Е 0 (тотықсыз) > 0 болса, онда тотығу - тотықсыздану реакциясы редоксиметрияда қолданады.
Тотығу-тотықсыздану реакциясы Нернст теңдеуімен көрсетіледі:
Е
т-з
=Е
0
тт / тз
+
 ln
ln
 . (8)
. (8)
Тотығу-тотықсыздану потенциалына әсер ететін факторлар:
температура, неғұрлым t 0 -ра жоғары болса, соғұрлым тотығу - тотықсыздану потенциалы үлкен.
әсерлесетін заттың концентрациясы.
Егер тотығу - тотықсыздану реакция сонда стехиометриялық коэффициент болса, онда олар Нернст теңдеуінде дәрежелік көрсеткіш ретінде түседі.
Е
а ТоТ/ d ТЗ
= Е
0
а ТоТ / d ТЗ
+
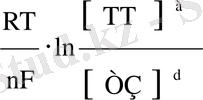 (9)
(9)
сутегі ионының (Н + ) концентрациясы тотығу-тотықсыздану реакциясын (m) қатысады.
Е
ТоТ/ТЗ
=Е
0
ТоТ/ТЗ
+
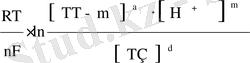 (10)
(10)
Нернст теңдеуіне константаның сандық мәнін қойып (R, F), T= 293 K, натуралды логарифмді ондық логарифмге айналдырып (ауысу модуль / 2, 3) теңдеуді былай жазамыз:
Е
ТоТ/ТЗ
= Е
0
ТоТ / ТЗ
+

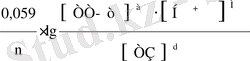 (11)
(11)
Титриметриялық анализде тотығу - тотықсыздану раециясын мына жағдайларда қолданады:
- соңына дейін жүреді (қайтымсыз ) ;
- жылдам және стехиометриялы жүреді;
- химиялық құрамы белгілі зат түзіледі;
- эквиваленттік нүктенің дәл анықтауға мүмкіндік береді;
- зерттелетін ерітіндінің құрамындағы бөгде заттармен реакцияға түспейтін.
Тотығу - Тотықсыздану реакциясының жылдамдағына әсер ететін факторлар.
- әсерлесетін заттардың концентрациясы;
- температура;
- ортаның рН;
қатысатын катализатор.
Тотығу - тотықсыздану реакциясының тепе - теңдік константасы (К) :
lgK=

 . (12)
. (12)
Яғни тотығу - тотықсыздану потенциалының айырымы неғұрлым көп болса, соғұрлым тепе - теңдік константасы жоғары болады.
Редоксиметрияда титрлеу қисығын мына координатада (Е-V) тұрғызады.
Е, В
Э. Н. V, мл
Сурет 4 - тотығу - тотықсыздану потенциалы
Неғұрлым стандартты потенциалдың айырымы көп болса, соғұрлым тепе - теңдік константа көп, егер неғұрлым титрлеу биіктігі жоғары болса, соғұрлым индикаторды таңдау шегі көп.
Тотығу - тотықсыздану титрлеу тәсілдері
Редоксиметрияда Э. Н. мына әдістерде анықтауға болады:
- Тотығу - тотықсыздану жүйесінің түсінің өзгеруіне қарай тотығу - тотықсыздану индикаторын қолдануға болады;
- қосылған ерітіндінің түсіне қарай - индикаторсыз (перманганатометрия) .
- жұмысшы ерітіндіге титрлейтін ерітіндіні қосқандағы түсіне қарай (иодометрия) .
Қайтымсыз индикаторлардың ерітіндісіне жұмысшы ерітіндіні артық мөлшерде қосқанда тотықсыздану арқылы түсі өзгеретін (броматометрия) .
Тақырып 6. Перманганатометриялық және иодометриялық титрлеу әдістеріKMnO 4 тотығу қасиеті жүрген реакцияның ортасына байланысты,
рН< 7 MnO - 4 +8H + +5e - → Mn 2+ +4Н 2 О; Е 0 =1, 51В, М э =1/5М;
құлпынай түсті түссіз
рН=7 MnO 4 - + 2Н 2 О +3е - =MnO 2 ↓ + 4ОН - ; Е 0 =0, 60В, М э =1/3 М;
күлгін - түс қоңыр түсті
рН>7 MnO 4 - + е - =MnO 2- 4 Е 0 =0, 56В, М э =М.
жасыл түс
Титрлеу қышқылдық ортада кеңінен таралған, себебі:
KMnO 4 тотықтырғыш қасиеті жоғары;
негіздік және бейтарап ортада Э. Н. анықтау қиын;
KMnO 4 - тің жұмысшы ерітіндісін былай дайындайды:
фиксанал әдісі.
Тікелей перманганатометрия титрлеу әдісімен кез-келген анықтайды.
Иодометриялық титрлеу әдісі
Негізгі теңдеуі I
 + 2e
-
↔︎2I
-
, E
0
I
+ 2e
-
↔︎2I
-
, E
0
I
 / 2I
/ 2I
 = +0, 54 В
= +0, 54 В
Бұл универсалды әдіс, себебі тотықтырғыш та тотықсыздандырғыш та бола алады.
Тотықсыздандырғышты анықтау.
2S
2
O
3
2-
+I
 → 2I
-
+ S
4
O
6
2-
→ 2I
-
+ S
4
O
6
2-
Титрлеудің соңында бояуының түсі азаяды сондықтан, индикатор ретінде крахмалды колданады.
Тотықтырғышты анықтау.
Cr 2 O 7 2- + 6I - + 14H + →3I 2 + 2Cr 3+ + 7H 2 O
Бұндай титрлеуді жүргізуге болмайды, себебі I 2 айналуын анықтау мүмкін емес, яғни Э. Н. анықталмайды. Сондықтан қосалқы әдіс - ығыстыру әдісін қолданады.
Тақырып 7. Комплексонометрия. Комплексонометриялық титрлеу әдістеріКешенді титрлеу әдісі кешен түзетін реакцияларға негізделген.
Комплесонометрияда мындай реакциялар жүреді:
- жылдам
- стехиометриялы
- санды
Комплексонометрия сілтілік, ауыспалы металдардың катиондарын анықтауға арналған.
Титрант ретінде динатрий тұзы, қышқылы ЭДТА / ( комплексон III, трилон Б) қолданады.
HOOCH 2 C CH 2 COONa
N-CH 2 -CH 2 -N немесе
NaOOCH 2 C CH 2 COOH
қысқаша Na 2 H 2 Т r
Екі зарядты металл (Mg 2+ ) мен әрекеттесу схемасын былай жазуға болады.
OOCH 2 C CH 2 COONa
N-CH 2 -CH 2 -N
NaOOCH 2 C CH 2 COO -
Mg 2+
Яғни ЭДТА металл катионымен әрекеттескенде Н + ығыстырады, сондықтан титрлегенде рН үлкен қзымет атқарады.
Титрлеу қисығы РМе - V титрант байланысты; РМе = - lg
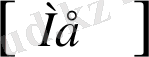 ;
;
РМе
Э. Н. V
Титрлеу биіктігі - комплекстің К тұр және реагент концентрациясына байланысты.
Индикатор ретінде металлиндикаторлар - органикалық бояғыштар (эрнохром қара, мурексид ) қолданады.
Меркуриметрия - сынап (II) тұздарын титрант ретінде қолдануға негізделген (меркури - ион) .
Cl - , Br - , CN - , CNS - иондарын анықтағанды аздиссоционалатын қосылыстар түзіледі.
Hg
2+
+ Cl
-
↔︎
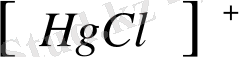
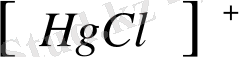 + Cl
-
↔︎ HgCl
2
+ Cl
-
↔︎ HgCl
2
I - мен титрлегенде тұрақты комплекс түзіледі:
Hg
2+
+ 4I
-
↔︎




Әдістің кемшіліктері:
- сынап тұздары улы.
Артықшылығы:
- Иондарды тікелей анықтайды;
- Галоген иондарымен қатар сынап тотықтарының иондарында анықтайды;
- Сынап қосылыстары дефицит емес.
Тұнбаға түсіру арқылы титрлеу - тұнбаға түсіру раекциясына негізделген. Сондықтан гравиметриялық анализ әдісіне ұқсастығы бар. Анықталатын заттың мәні титриметриялық әдісіндей анықталады.
Бізге белгілі тұнбаға түсіру әдістері:
Аргентометрия - титрант AgNO 3
AgNO 3 + Cl - → AgCl↓ + NO - 3
анық. зат.
Меркурометрия - титрант Hg 2 (NO 3 ) 2
Hg 2 (NO 3 ) 2 + 2Cl - → Hg 2 Cl 2 ↓ + 2NO - 3
анық. зат.
Тұнбаға түсіру арқылы титрлеу әдісіне қойылатын талаптар:
- тұнбаның аз ерігіштігі;
- титрантты қосқанда тұнбаның тез түзілуі;
- аз мөлшерде ластанады;
- Э. Н. анықтайтын индикатор бар.
- Э. Н. былай анықтайды;
- индикаторсыз;
- адсорбциялық индикаторды қолданып.
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz