Термодинамика негіздері: ішкі энергия, жұмыс, жылу және негізгі заңдар


Термодинамика негіздері
Термодинамика - энергияның түрленуiне қатысты жалпы заңдарға негiзделген жылулық процесстер туралы ғылым. Бұл заңдар молекулалық құрылымдарына байланыссыз барлық денелер үшiн орындалады.
Iшкi энергия туралы түсiнiк. Термодинамикадағы жұмыс
Iшкi энергия туралы түсiнiк. Макроденелерд механикалық энергиямен қатар, өздерiнiң iштерiне тұйықталған энергияға ие. Ол - iшкi энергия. Ол барлық энергетикалық түрленулердiң балансына кiредi. Механикалық жұмыс жасамай-ақ денелердi қыздырғанда, олардың iшкi энергиясы ұлғаяды. Iшкi энергияның механикалық энергияға айналуының керi процесi болатыны сөзсiз. Молекулалық-кинетикалық теория көзқарасынан макроскопиялық дененiң iшкi энергиясы барлық молекулалардың ретсiз қозғалыстарының кинетикалық энергиялары мен олардың бiр-бiрiмен өзара әсерiнiң потенциалдық энергияларының қосындысына тең .
Термодинамикадағы жұмыс. Термодинамикада қозғалыстағы ортаның аз бөлшектерiнiң бiр-бiрiне қатысты орын ауыстыруы ғана қарастырылады. Нәтижесiнде дене көлемi, оның iшкi энергиясы өзгередi. Дене жылдамдығы тұтасымен алғанда нөлге тең болып қалады. Жұмыс классикалық механикадағы сияқты анықталады, бiрақ ол дененiң кинетикалық энергисының өзгеруiне емес, оның iшкi энергиясының өзгеруiне тең болады . Мысалы, газдардың сығылуы кезiнде поршень өзiнiң механикалық энергиясының бiр бөлiгiн газдарға бергендiктен, молекулалардың кинетикалық энергиясы ұлғаяды, газ қызады. Керiсiнше, егер газ ұлғайса, онда алыстаған поршенмен соқтығысқаннан кейiн молекулалардың жылдамдығы азайып, газ суиды.
Жұмысты есептеу . Қозғалмалы ортаның көлемi өзгергендегi iстелген жұмыс мынаған тең болады
А ′ = p · (V 2 -V 1 ) = p · ΔV . (3. 1)
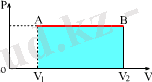
Ұлғаю кезiнде ( V 2 > V 1 ) газ оң жұмыс жасайды: А′ >0. Сығылу кезiнде V 2 < V 1 , сондықтан оның жұмысы терiс болады: А′ <0. Керiсiнше, газ сығылған кездегi сыртқы күштердiң жұмысы оң болады да, газ қыза бастайды. Ұлғаю кезiнде сыртқы күштердiң жұмысы терiс болады - газ суиды.
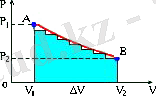
Тұрақты қысым жағдайында, газдың жұмысы геометриялық тұрғыдан түсiндiргенде 3. 1. -суретiнде келтiрiлген ( P-V ) графигiндегi V 1 АВV 2 тiк төртбұрышының ауданына дәлме-дәл тең екендiгiн оңай көруге болады. Жалпы жағдайда газ қысымы көлемге байланысты функция болып табылады. Бiрақ, газ жұмысы бұрынғысынша сандық түрде бастапқы және соңғы күйлердегi p 1 және p 2 қысымдарына тең AV 1 және AV 2 кесiндiлерiмен және P -ның V -ға байланысты графигiмен шектелген фигураның ауданына тең болады(3. 2-сурет) .
Жылу мөлшерi. Жылу балансының теңдеуi
Жұмыс жасалынбай-ақ , бiр денеден екiншi денеге энергияның берiлу процесi жылу алмасу немесе жылу берiлу деп аталады. Жылу алмасу кезiндегi iшкi энергияның өзгеруiнiң мөлшерлiк шамасын жылу мөлшерi деп атайды. Жылу алмасудың үш түрi бар - жылуөткiзгiштiк, конвекция және сәуле шашу (сәулелi жылу алмасу) (3. 3 - сурет) .
Меншiктi жылу сыйымдылығы. Массасы m дененi t 1 температурадан t 1 температураға дейiн қыздыру үшiн оған мынадай жылу мөлшерiн беру қажет:
Q = c · m ·( t 2 -t 1 ) = c · m · Δt . (3. 2)
Бұл қатынас дененiң сууы кезiнде де орындалады, бiрақ ол жағдайда жылу мөлшерi терiс болады, себебi Δt<0 . Пропорционалдық коэффициент с меншiктi жылу сыйымдылығы деп аталады.
Меншiктi жылу сыйымдылығы деп температурасы 1 o К -ге өзгергендегi массасы 1 кг дененiң алған немесе берген жылу мөлшерiн айтамыз.
Меншiктi жылу сыйымдылығы c заттың физикалық қасиеттерiне қалай байланысты болса, жылу алмасуы жүретiн процестiң түрiне де солай байланысты болады.
Буға айналудың меншiктi жылуы. Сұйықты буға айналдыру үшiн оған белгiлi бiр жылу мөлшерiн беру қажет.
1 кг сұйықты тұрақты температурада буға айналдыру үшiн қажет болатын жылу мөлшерiн заттың буға айналуының меншiктi жылуы деп атайды. Бұл шама r символымен белгiленедi және СИ жүйесiнде Дж/кг -мен өлшенедi.
Массасы m сұйықты буға айналдыру үшiн мынадай жылу мөлшерi қажет:
Q бу = r · m . (3. 3)
Конденсация кезiнде дәл сондай жылу мөлшерi бөлiнедi : Q бу = - rm .
Балқудың меншiктi жылуы. Дене тұрақты температурада балқиды. Молекулалардың кинетикалық энергиясы өзгермейдi, барлық берiлетiн жылу олардың потенциалдық энергиясын ұлғайтуға шығындалады.
1 кг затты сол температурадағы сұйыққа айналдыруға қажет болатын жылу мөлшерiн балқудың меншiктi жылуы λ ( Дж/кг ) деп атайды.
Массасы m болатын кристаллдық дененi балқыту үшiн мынадай жылу мөлшерi қажет:
Q бал = λ · m (3. 4)
Жылу балансының теңдеуi. Тұйық жүйедегi жылу алмасу кезiнде, оның iшкi энергиясының қосындысы өзгермейдi . Кез келген жеке алынған дененiң энергиясының өзгерiсi жылулық тепе-теңдiк басталғанға дейiнгi дененiң берген немесе алған жылу мөлшерiне тең: ΔU i = Q i . Барлық денелер үшiн бұл шамаларды қосып және жүйенiң жинақталған iшкi энергисы тұрақты екенiн ескерiп, мынаны аламыз: ΔU 1 + ΔU 2 + ΔU 3 + . . . = 0. Бұдан мына теңдеу шығады: Q 1 + Q 2 + Q 3 +… = 0. (3. 5)
Бұл теңдеу жылу балансының теңдеуi деп аталады. Мұндағы Q 1 , Q 2 , Q 3 , . . - жылу алмасу процесi кезiндегi дененiң берген немесе алған жылу мөлшерлерi. Олар жоғарыда көрсетiлген формулалармен өрнектеледi.
Идеал газдың iшкi энергиясы. Термодинамиканың бiрiншi заңы
Идеал газдардың iшiнде өзiнiң физикалық қасиеттерi бойынша қарапайым болып табылатын газ - бiр атомды газ (гелий, неон, аргон және т. б. ) .
Бiр атомды газдың iшкi энергиясы. Идеал газдың барлық iшкi энергиясы оның молекулаларының қалыптаспаған қозғалысының кинетикалық энергиясы болып табылады. Массасы m бiр атомды газ үшiн ол бiр атомның орташа кинетикалық энергиясының E = 3kT/2 жалпы атомдар санына N = mN a /M көбейткенге тең. kN a = R екенiн ескерiп, мынаны табамыз:
U = 3mRT/2M . (3. 6)
Бiр атомды идеал газдың iшкi энергиясы, молекулаларының өзара әсерлесуiнiң потенциалдық энергиясы нөлге тең болғандықтан, көлемге (қысымға) байланысты емес. Тек газ температурасының өзгеруiнiң есебiнен ғана газдың энергиясы өзгередi. Нақты газдар және сұйықтар үшiн молекулалардың орташа потенциалдық энергиясы нөлден өзгеше. Газдарда ол кинетикалық энергиямен салыстырғанда өте аз, ал сұйықтар мен қатты денелер үшiн кинетикалық энергиямен шамалас болып келедi. Демек, жалпы жағдайда, iшкi энергия потенциалдық энергия сияқты қозғалмалы ортаның көлемiне, температурасына тәуелдi болады.
Термодинамиканың бiрiншi заңы. Көптеген деректердi жинақтаудың негiзiнде энергияның сақталуының жалпылама заңы тұжырымдалды: табиғатта энергия U жоқтан пайда болмайды және жоғалмайды, ол тек бiр түрден екiншi түрге ауысады .
Жылу құбылыстарында таралған энергияның сақталу және айналу заңы термодинамиканың бiрiншi заңы деп аталады .
Жалпы жағдайда, жүйенiң бiрiншi U 1 күйден екiншi U 2 күйге ауысуы кезiнде, iшкi энергия атқарылған жұмыстың есебiнен қалай өзгерсе, жүйеге сырттан берiлген жылудың әсерiнен де солай өзгере алады. Термодинамиканың бiрiншi заңы нақ осылай тұжырымдалады: iшкi энергияның өзгерiсi жүйеге берiлген жылу мөлшерi мен сыртқы күштердiң жұмысының қосындысына тең :
ΔU = A + Q . (3. 7)
Егер жүйе жылу өткiзбейтiн болса ( Q = 0) және ол механикалық жұмыс атқармаса ( А =0), онда ΔU = 0, немесе U 1 = U 2 : тұйық жүйенiң iшкi энергиясы өзгермейдi (сақталады) . Бұл дерек жылулық баланс теңдеуiн қорытқанда қолданылған болатын.
Термодинамиканың бiрiншi заңынан, ешқандай энергетикалық шығынсыз шексiз мөлшерде жұмыс жасай алатын қондырғыны - мәңгiлiк двигательдi жасап шығару мүмкiндiгiнiң терiстiгi шығады. Шын мәнiнде, егер жүйеге жылу берiлмесе ( Q = 0 ), онда жұмыс A iшкi энергияның азаюы есебiнен ғана жүзеге асар едi: A = ΔU . Двигатель, энергия қоры таусылғаннан кейiн, жұмысын тоқтатады.
Термодинамиканың бiрiншi заңын изопроцестерге қолдану
Изохоралық процесс. Бұл процесте газ көлемi өзгермейдi: V = const . Газдың iшкi энергиясының өзгерiсi оған берiлген жылу мөлшерiне тең: ΔU = Q . Егер газ қыздырылса, онда Q > 0 және ΔU > 0 - iшкi энергия ұлғаяды. Газды суытқан кезде: Q < 0 және ΔU < 0, оның iшкi энергиясы азаяды.
Изотермалық процесс. Изотермалық процесс кезiнде газдың температурасы тұрақты болады ( Т = const ) және оның iшкi энергиясы өзгермейдi. Газға берiлген барлық жылу мөлшерi пайдалы жұмыс атқаруға жұмсалады: Q = А′ . Газ белгiлi жылу мөлшерiн ( Q > 0) алған кезде, ол оң жұмыс атқарады ( А′ > 0) . Керiсiнше, егер газ қоршаған ортаға жылу берсе, онда оның атқарған жұмысы терiс болып саналады.
Изобаралық процесс. Изобаралық процесс кезiндегi газға берiлген жылу мөлшерi оның iшкi энергиясының бiрге өзгеруiне және қысым тұрақты болған кездей P = const жұмысты атқаруға шығындалады.
Адиабаталық процесс. Қоршаған ортамен жылу алмасуы болмайтын жағдайда өтетiн жүйедегi изопроцесс адиабаталық процесс деп аталады.
Адиабаталық процесс кезiнде Q = 0 және жүйенiң iшкi энергиясының өзгеруi жұмыс атқару арқылы ғана жүредi: ΔU = А . ΔU = А теңдiгi белгiлi қорытынды жасауға мүмкiндiк бередi. Егер жүйеде оң жұмыс жасалса, мысалы газ сығылатын болса, онда оның iшкi энергиясы ұлғаяды және температурасы өседi. Керiсiнше, газ ұлғайған кезде, ол өзi оң жұмыс атқарады ( А ұ > 0) . Оның iшкi энергиясы азаяды да, газ суиды.
Егер цилиндр түбiне эфирге батырылған мақтаны салып, дереу поршендi қозғалтсақ, онда мақтадағы эфир буы жалындайды. Бұл эффект Дизель двигателiнiң жұмыс iстеу принципiнiң негiзiне алынған.
Бұл жерде цилиндрге жанармай қоспасы емес, кәдiмгi атмосфералық ауа сорылады. Сығылу тактының соңында арнайы форсунка арқылы сұйық отын - солярка шашыратылады. Осы сәтте сығылған ауа температурасының жоғарлағаны сондай, тiптен жанармай тұтанады.
Күн көзiнiң әсерiнен жылыған ауа, жоғары көтерiледi де, биiктiкке көтерiлген сайын қысымның азаюына байланысты тез арада ұлғайып-таралады. Бұл ауаның ұлғайып-таралуы оның салқындауына әкелiп соғады. Осының нәтижесiнде су булары конденсацияланады да, бұлттар пайда болады (3. 5 - сурет) .
Жылулық процесстердiң қайтымдылығы. Тура және керi циклдар. Жылу двигателi. Карно циклi
Энергияның сақталу заңы, оның мөлшерiнiң өзгермейтiндiгiн жариялағанымен, бұнда қандай энергетикалық түрленулердiң шын мәнiнде мүмкiн болатындығын көрсетпейдi. Табиғаттағы процесстердiң барлығы тек белгiлi бiр бағытта ғана өтедi. Олар өз бетiнше керi бағытта жүзеге асырылмайды. Өз бетiнше тек бiр бағытта ғана өтетiн процестердi қайтымсыз процестер деп атайды; керi бағытта олар өздерiн тек қана күрделiрек процесстер тiзбегiнiң бiр звеносы ретiнде ғана көрсете алады.


Термодинамиканың екiншi заңы. Термодинамиканың екiншi заңы энергетикалық түрленулердiң бар болу мүмкiндiгiнiң бағытын көрсетедi. Салқынырақ денеден ыстығырақ денеге жылуды тасымалдау, екi жүйеде де немесе қоршаған ортада бiр мезгiлде басқа өзгерiстер жасамайынша, мүмкiн емес. Жылу двигателi. Iс-әрекетi жұмыс атқарушы дененiң механикалық энергиясын iшкi энергияға түрлендiруге негiзделген двигательдер жылу двигателдерi деп аталады (3. 6, 3. 7, 3. 8 - суреттер) .
Кез-келген дененiң (қыздырғыштың) iшкi энергиясын, қыздырғыштың жылуын басқа температурасы төменiрек денеге(тоңазтқышқа) бергенде ғана, яғни тек жылу алмасу процесi кезiнде ғана, iшiнара механикалық энергияға айналдыруға болады.
Ең алғаш рет бұл мәселенi, идеалды жылу машинасын ойлап тапқан француз ғалымы С. Карно зерттедi. Ондай машинаны құрастыру үшiн жоғарғы температурадағы қыздырғыш, мейлiнше төмен температурадағы тоңазтқыш және жұмыс атқарушы дене болуы керек (3. 9 - сурет) . Барлық жылу машиналарындағы жұмыс атқаратын дене, өзi ұлғайған кезде жұмыс жасайтын, газ болып табылады. Тоңазтқыш ретiнде атмосфера, не болмаса конденсатор деп аталатын салқындатуға арналған арнайы қондырғылар алынады.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz