In vitro микроклональды көбею негізінде қазақстандық селекция раушандарының коммерциялық сорттарын жедел көбейту әдістері


МАЗМҰНЫ
Кіріспе . . .
6
1
Атмосфераның ластану мәселесіне әдебиеттік шолу . . .
8
1. 1
Энегетика өндірістерінің (ЖЭО, ЖЭС, ГЭС) атмосфера ауасының
ластануына қосатын үлесі . . .
8
1. 1. 1
Электр энергетикасы объектілерінің атмосфералық ауаға әсері . . .
8
1. 1. 2
Атмосфера ауасының энергетика шығарындыларымен ластану
сипаты . . .
9
1. 1. 3
Атмосфералық ауаның ластануының адам денсаулығына әсері . . .
11
1. 1. 4
Көмір өндіру саласы объектілерінің атмосфералық ауаға әсері . . .
12
1. 2
Тау-кен өндірісінің атмосфера ауасының ластануына қосатын
үлесі (шахта, түсті меллургия, байыту фабрикалары, металлургия зауыттары) . . .
13
1. 2. 1
Атмосфераға шығарындылар және атмосфералық ауаның
ластануы . . .
20
1. 3
Машина жасау өндірістерінің атмосфера ауасының ластануына
қосатын үлесі . . .
22
2
Атморсфера ауасының мониторингін жасау әдістемесі . . .
28
2. 1
Зерттеу нысандары . . .
28
2. 2
Атмосфера ауасының ластануын бақылау жұмыстарын
ұйымдастыру . . .
28
2. 3
Құралдар және нұсқа алу әдістемесі . . .
33
2. 4
Зиянды заттар концентрациясын индикатор түтігімен анықтау . . .
36
3
Зерттеу бөлімі . . .
40
4
Еңбек қауіпсіздігінің жай-күйін бағалау . . .
46
Қорытынды . . .
51
Пайдаланған әдебиеттер тізімі . . .
52
ҚЫСҚАРТУЛАР
BAP 6-бензиламинопурин
IBA - индол-3-май қышқылы
NAA - α-нафталин сірке қышқылы
ТДЗ - Тидиазурон
IAA - индол-3-сірке қышқылы
КІРІСПЕ
Соңғы уақытта Қазақстанда қалалар мен жаңа құрылыстар санының өсуіне байланысты жасыл желектер құру қажеттілігі туындап отыр, олардан скверлер, саябақтар, аллеялар мен топтық посадтар қалыптастырылуда. Аумақты көгалдандыру үшін қоғамдық жерлерде қылқан жапырақты және жапырақты ағаштар, бұталар, сондай-ақ эстетикалық функцияны ғана емес, сонымен қатар белгілі бір микро-климатты құратын гүлді сәндік өсімдіктердің әртүрлі формалары қолданылады. Өсімдіктердің өсуі мен дамуы үшін қолайсыз климаттың қатал болуына байланысты (температураның күрт өзгеруі, топырақтың тұздануы мен ылғал тапшылығымен бірге күннің жоғары оқшаулануы) Қазақстан аборигендік дендрофлора мен сәндік өсімдіктердің шектеулі құрамымен ерекшеленеді, бұл одан әрі көгалдандыру жұмыстарын жүргізу үшін өсімдіктерді жерсіндіру мен жерсіндіру қажеттілігін негіздейді. Раушанның көптеген сорттары дәстүрлі түрде шламмен таралады, көшеттерге немесе клональды қорларға егіледі. Алайда, вакцинация - бұл қымбат процедура, ал дәстүрлі өсіру-бұл еңбек процесі.
Биотехнологияның бір жаңалығы болды раушанның коммерциялық сорттарын микроклональды көбейту мен раушан өсірудің дәстүрлі әдістерінің баламасы. Селекциялық және тұқым өсіру жұмысының тиімділігін арттыру жасушалық технологияларды, атап айтқанда, in vitro микроклональды көбеюін қолданумен байланысты. Бұл әдіс бірегей генотиптерді (алыс гибридтер, асыл тұқымды үлгілер, биоинженерлік әдістерді қолдана отырып алынған формалар) тез арада таратуға және өндіріске жаңа сорттарды енгізуді тездетуге мүмкіндік береді (RuzicD., 2006: 149-153, Saxena G., 2000: 133-140) . Микроклональды көбеюдің маңызды артықшылығы-бұл әдіспен алынған отырғызу материалы оған өсімдік берген генетикалық жағынан бірдей. Дәстүрлі әдістермен салыстырғанда бұл биотехнологиялық әдіс саңырауқұлақ және бактериялық патогендерден, вирустық, микоплазмалық және нематодты инфекциялардан сауықтырылған материал алуға, сондай-ақ көбеюдің жоғары коэффициентіне қол жеткізуге мүмкіндік береді, өйткені клондық микро көбею кезінде сіз жылына 100 000 клон ала аласыз, ал әдеттегі жағдайда-дәл сол уақытта тек 50-100 өсімдік алынады (DasP., 2010: 70-78, PratarK. P., 2006: 94-114) . Селекциялық процестің тиімділігін азайту мүмкіндігі де маңызды болып табылады, нақты технологиялар климаттық жағдайларға қарамастан жыл бойы жұмыс істеуге және отырғызу материалын өсіру үшін қажетті аумақты үнемдеуге мүмкіндік береді. Технологияның экономикалық тиімділігі көптеген Еуропа елдерінде көрсетілген, олар сәндік өсімдіктердің сәндік материалдарын жаппай көбейту үшін микроклональды көбейту әдісін қолдана отырып, сәндік Гүл өсімдіктеріне жыл сайын өсіп келе жатқан сұранысты қанағаттандырады (KimS. W., 2009: 199-203, Khosravi P., 2007: 100-104, Nak-Udom N., 2009: 583-586) . Қазақстанда сәндік гүл өсімдіктерінің коммерциялық сорттарының ландшафтық дизайны мен өсірілуі көп еңбекті қажет ететін көбейту әдістеріне балама болып табылатын сәндік өсімдіктердің сапалы отырғызу материалын жаппай тираждау және жылдам ұдайы молайтуға негізделген рентабельді және әмбебап технологияның болмауына байланысты нашар дамыған. Бұл жұмыс микроклональды көбейту In vitro әдісі негізінде қазақстандық селекцияның будандары мен раушандарының коммерциялық сорттарын жедел көбейтудің тиімді әдістерін жасауға арналған.
- Роза гүлін in vitro жағдайында микрокөбейту әдісіне әдебиеттік шолуРоза гүлі
Роза - гүлдердің патшайымы. Жалынды махаббат пен тәжім етудің, сүйкімділіктің нышаны. Раушан бағзы замандардан-ақ ең сәнді өсімдік саналып келген. Аталған гүлдің әдемілігі жағынан да, түсінің байлығы жағынан да, мұрныңызды жарардай хош исі тұрғысынан да теңдесі жоқ десек, артық айтқандық емес.
Ежелгі Иран халқында осы гүлдің көркемдігі туралы жүздеген томды кітаптар жазылған. Еңбектегі Иран халқының ақындарының айтуынша, раушан Тәңірдің тарту еткен сыйы екен. Күндердің күнінде Флора патшалығының балалары Құдайдан өздеріне қашанда ұйқыда жүріп, билеушіге тән міндеттерін есінен шығарып ала беретін Лотостан басқа патша тағайындап беруін жалынып сұрайды. Мейірімді Аллаһ Тағала өтініштеріне құлақ асып, оларға өткір тікенді, періштедей пәк ақ раушанды жібереді.
Раушан гүлінің тарихы жер бетінде адамзат баласы пайда болмай тұрғанда, яғни осыдан 25 миллион жыл бұрын басталатындығына көптеген ғалымдардың еңбектеріндегі деректер дәлел бола алады.
Раушан туралы қолжазбалардағы ең көне деректер Тигр мен Ефрат өзендерінің арасында орын тепкен Ура қаласындағы патша моласынан табылған (осыдан 5000 жыл бұрын) .
Конфуцийдің еңбектеріне сүйенер болсақ, ежелгі Қытайдың патшалық кітапханасында раушан туралы 600 кітап болған екен. Және сол кездің өзінде қытайлықтар раушан майын дайындау тәсілін жетік білген. Б. з. д. 372-287 жылдары өмір сүрген Теофраст раушан гүлдің жабайы және бақта өсетін түрлерін ажыратып берген. Ал, көненің көзі саналатын Алтай қорғандарынан (б. з. д. V - IV ғ. ғ. ) раушандар бейнеленген күміс тиындар табылған.
Раушандар әлеміндегі соңғы жаңалықтар:
•Әр түрлі елдердің селекционерлерінің арқасында бүгінде раушанның шамамен 25 000 сұрпы алынған.
•Раушанды сұрыптауды жүргізіп отырған алпауыт мемлекеттердің басында Франция, АҚШ және Англия тұр.
•Раушан гүлдері ақ, алқызыл, сары тіпті қара және көгілдір түсті болып келеді. Гавай аралдарының көгілдір аспандарының астында көгілдір күлтелі раушандар жайқалып тұрады.
•Раушандардың ең сирек кездесетін түрі - меруерт раушандар. Мұндай гүлдер Румынияның Клуж қаласындағы «Напока» ботаникалық бағында өсіріледі. Күлтелері ашық жасыл түсті бұл таңғажайып раушандар инеліктің қанатын еске түсіреді.
• Бұл аз десеңіз, соңғы уақытта мұңды кейіптейтін қара раушандар дүниеге келген.
• Италияда өткен гүлдер көремесіне сабағында бірде-бір тікен жоқ ақ раушан гүлі қойылған.
Қазақстан ғылым академиясының Бас ботаник. бағында 1957 - 84 ж. аралығында Раушангүл тұқымдасының әсемдік түрі - раушан гүлінің 16 сорты шығарылған. Ең бастылары: “ Қазақстандық мерекелік ” (биікт. 130 см-дей, гүлі қызыл түсті) ; “ Алматыдан сәлем ” (биікт. 130 см-дей, гүлі қызғылт түсті) ; “ Алматы хош иістісі ” (биікт. 190 см-дей, гүлі қызғылт түсті, хош иісті) ; “ Қызжібек ” (биікт. 110 см, гүлі қызыл күрең түсті) ; “ Аққу ” (биікт. 250 см-дей, гүлі ақ түсті) ; “ Гүлсұлу ” (биікт. 190 см-дей, гүлі қызыл күрең түсті, қыста үсімейді), т. б.
1. 2 Клондық микро көбею
Жаңасын енгізу жолындағы маңызды кедергілердің бірі тәжірибеде сорттар-көп мөлшерде алу мүмкін еместігі вегетативті көбею үшін тұқым немесе отырғызу материалы. Бұл кедергі биотехнологияның көмегімен жойылады селекционерлерге микро көбейтудің тиімді және жылдам әдісі өсімдіктер. In vitro эксперименталды морфогенез процесін зерттеу ұйымның барлық деңгейлерінде - жеке тордан қашу шыңына дейін клондық микропроцессорлық технологияның пайда болуына әкелді көптеген елдерде қазірдің өзінде коммерциялық болып табылатын өсімдіктер. Клондық микропропагация-массалық асексуалдық жасушалар мен ұлпалар мәдениетінде Өсімдіктердің көбеюі өсімдіктердің пайда болған формалары генетикалық жағынан түпнұсқаға ұқсас данасына Бұл алынған отырғызу материалы өте маңызды өсімдіктің генетикалық жағынан ұқсас әдісі, ол өсімдіктердің соматикалық жасушаларынан пайда болады. Жыныстық көбею кезінде ұрпақтар бірігу нәтижесінде пайда болған зиготадан дамиды екі түрлі адамның ұрық жасушалары. Бұл зигота құрамында гендер бар әке мен ана ағзасы, сондықтан ұрпақ, жыныстық көбею кезінде пайда болатын, бірдей емес кейбір ата-аналарға және екі ата-ананың да тұқым қуалайтын бейімділігін көтереді. Клондық микропроцессордың артықшылықтары дәстүрлі әдістермен:
- генетикалық біртекті отырғызу материалын алу; саңырауқұлақ және бактериялық патогендерден өсімдіктерді сауықтыру, вирустық, микоплазмалық және нематодты инфекциялар;
- жоғары көбею коэффициенті: клональды микро көбейту жылына 100 000-1000 000 клон алуға болады, ал қалыпты жағдайда-сол мерзімде тек 5 100;
- селекциялық процестің ұзақтығын қысқарту;
- дәстүрлі түрде көбейту қиын өсімдіктердің таралуы тәсілдермен;
- жыл бойы жұмыс жүргізу мүмкіндігі және үнемдеу;
- отырғызу материалын өсіру үшін қажетті алаңдар.
Өнім санына сәйкес көбейту технологиясы in vitro-ны кішігірім және ауқымды деп бөлуге болады. Бұл бөлім мақсаттармен және қолдану салаларымен байланысты.
Клондық микропропагация қолданылады:
- көп мөлшерді тез алу үшін вируссыз материал (бұл технология әдіске негізделген, апикальды меристематикалық тіндердің мәдениеті ретінде белгілі ірі масштабты технология) ;
- аз санды сақтау және көбейту үшін селекциядағы жеке генотиптер (үлкен масштабты қажет етпейді) ;
- жаңа өсірілген сорттарды тез көбейтуге арналған (дейін ай ішінде бірнеше мың өсімдік, ал дәстүрлі әдістерді қолдану бірнеше жылға созылады) ;
- ағаш өсімдіктерін көбейту, өсіру және селекция ұзақтығына байланысты баяу жүзеге асырылатын немесе вегетативті көбеюдің болмауы (осы түрлердің көпшілігі вегетативті көбею қиын, ал кейбір жағдайларда, мысалы, монокотилонды пальмалар үшін және кейбір орман ағаштарының түрлері, жалпы вегетативті көбею мүмкін емес) ;
- гетерозис гибридтерін немесе басқаларын ұстауға арналған өсімдіктерді кесіп өту кезінде бөлінетін гетерозиготалар;
- сирек кездесетін және Құрып кету қаупі төнген түрлерді сақтауға арналған заттар, мысалы, женьшень, оның ауқымы Қиыр Шығыста (Қытай, Корея, Ресей), тек Қытайда Ресеймен шекарада сақталған .
Клондық микропроцессордың негізін қалаушы француз ғалымы Жорж Морель. 1960 жылы ол осы әдісті жасады орхидеялар үшін. Эксплант ретінде Ж. Морель жоғарғы жағын қолданды цимидиум (сем. Орхидея), өсу конусынан және белгілі бір жағдайларда екі жапырақты бүршіктерден тұрады сфералық түзілімдер пайда болды - протокормалар (сурет. 1) . Қалыптасқан хаттамаларды бөлуге болады, содан кейін жаңадан дайындалған қоректік заттарға өздігінен өсіріңіз жапырақты примордиялар мен тамырлар пайда болғанға дейінгі орта. Нәтижесінде атындағы бұл процесс шексіз және оны алуға болатындығы анықталды жоғары сапалы және генетикалық біртекті, безвирусный отырғызылатын материал. Біздің елде клондық микропроцессорлық жұмыстар болды 60-шы жылдары тіндер мәдениеті және морфогенез зертханасында басталды. Өсімдіктер физиологиясы институты. К. А. Тимирязева РАН. Астында профессор Р. Г. Бутенконың басшылығымен жағдайлар зерттелді картоптың, қант қызылшасының, Қалампырдың, гербераның микропозициялары, фреезиялар және басқа да өсімдіктер, өнеркәсіптік микропроцессорлық технологиялар.
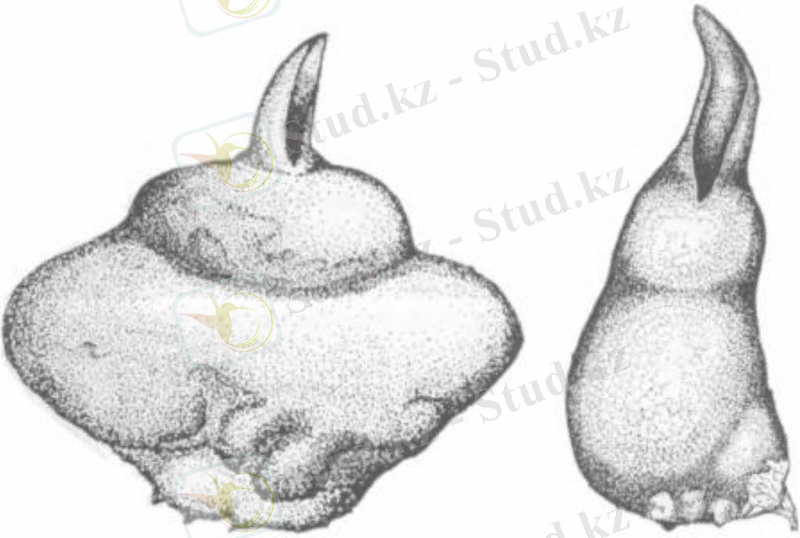
Сур. 1 протокормалардың пайда болуы: А-эпифит Laelia sincorana Schltr. ; B-laelia iundii Rchb литофиті. f. et Warm.
Клондық микро көбеюді көптеген жолдармен жасауға болады. Клондық микропропагацияның негізгі түрлері:
- апикальды үстемдікті басу және аксиларлы бүйректің дамуы;
- микротүтікшелер;
- білім микроклубней, микролуковиц;
- әсер етуші бүйректің пайда болуының индукциясы;
- содан кейін органогенез немесе эмбриоидогенез индукциясымен каллус тінін алу.
Аксиларлы қашу арқылы көбейту.
Жоғары өсімдіктердің көпшілігінде өсудің аралық түрі бар, онда жапырақтардың сүйектерінде қосымша меристематикалық ұлпалар болады, олар негізгі өсімдіктерге ұқсас өсінділерде пайда болады.
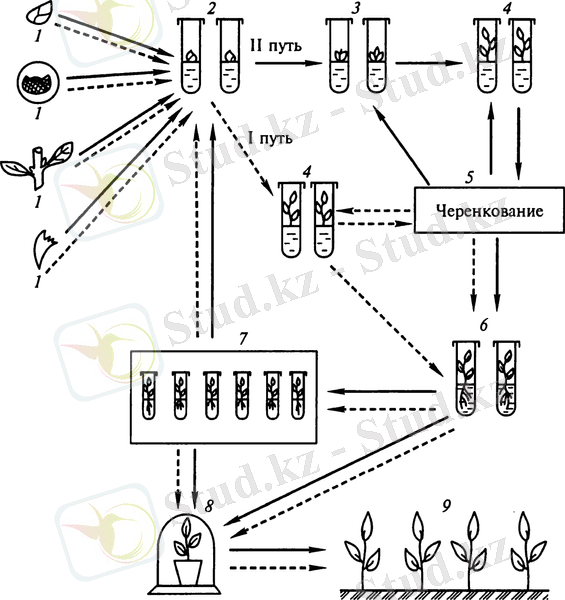
Сурет 2. Қолданыстағы меристемалардың дамуын белсендіру (I жол), эксплантта адвентивті бүршіктердің пайда болуын индукциялау (II жол) әдісімен өсімдіктердің клональды микро көбеюінің схемасы:
1 - Бастапқы эксплантты таңдау; 2 - стерильді дақыл алу; 3 - тікелей бастапқы эксплантта адвентивті бүршіктердің пайда болуы; 4 - бүйректің өсуі және микропобегтердің пайда болуы; 5 - микропобегтердің көбеюі (кесу) ; 7 - төмен температурада регенерант өсімдіктерін сақтау; 8-өсімдіктерді жылыжай жағдайларына ауыстыру; 9 - регенерант өсімдіктерін отырғызу топырақ.
Өсімдіктің осы түріне тән тармақталу түріне сәйкес аксиларлы меристематикалық тіндердің шектеулі саны дамиды. Олардың көпшілігінің дамуы тежелген апикальды үстемдік құбылысына байланысты (апикальды бүршіктердің басым дамуына байланысты бүйірлік бүршіктердің өсуін басу) . Клондық микропроцессордың бұл әдісінің негізі апикальды үстемдікті жою және аксиларлы меристемаларды белсендіру болып табылады. Бұл қол жеткізу мүмкін жоюды верхушечной меристемы сабақтарының және кейіннен микрочеренкованием қашу in vitro безгормональной ортада (сур. 3) . Апикальды үстемдік бірнеше гормоналды жүйелермен басқарылатын болса да, көптеген өсімдіктерде аксиларлы өсінділердің өсуі, сайып келгенде, меристематикалық тіндерді цитокининдермен қамтамасыз етуге байланысты. Апикальды үстемдікті алып тастау ортаға цитокинин белсенділігі бар заттарды енгізу арқылы да мүмкін (сурет. 3), бұл салыстырмалы түрде қысқартылған интеродтары бар өсінділердің пайда болуына әкеледі, ал аксиларлы өсінділер мен меристематикалық түйнектер жаңа өсінділерді тудырады.
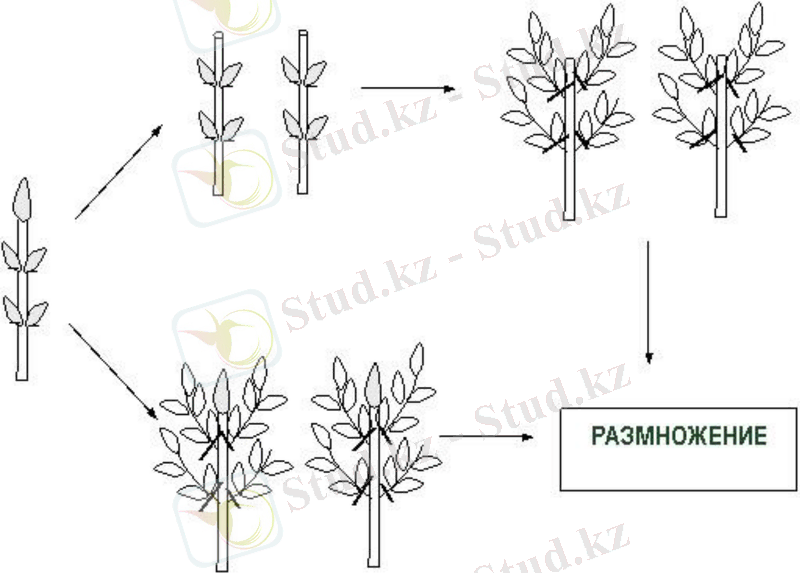
Сурет 3. Аксиларлы меристемаларды белсендіру арқылы өсімдіктердің көбею схемасы:
1 - апикальды меристеманы алып тастау арқылы: 2-ортаға гормондар қосу арқылы.
Гормондарсыз негізгі ортада өсірілетін қашу ұштары, әдетте, апикальды үстемдігі бар жалғыз қашу түрінде дамиды. Цитокинині бар ортада өсірілгенде, негізгі қашу көбінесе дамымаған, одан кейін екінші ретті қашу, содан кейін үшінші және т. б. тез қалыптасады өсіп келе жатқан қашу. Мұндай байлам жеткілікті түрде дамығаннан кейін оны жалпы тамыр жүйесі бар кішкентай туфтерге немесе жаңа ортада өскенде бірдей қашу туфтерін құра алатын жеке өсінділерге бөлуге болады. Жақсы теңдестірілген орта болған кезде, бұл процесс шексіз жалғасуы мүмкін. Мысалы, гладиолидің тез өсетін өсінділері 11 жыл бойы физиологиялық нашарлаусыз сақталды.
Дамымаған аксиларлы өсінділердің пайда болу жылдамдығы in vitro жапырақтарының қалыптасу жылдамдығына байланысты. Соңғысы өсімдіктердің түріне және қоректік ортаның жарамдылығына байланысты өзгереді. Белгілі бір дәрежеде көбею жылдамдығын цитокинин концентрациясы мен Қолданылатын ыдыстың мөлшерімен басқаруға болады. Әр түрлі өсімдіктерде жылдамдық әр түрлі болады, жақсы өсетін өсімдіктер үшін ол 4 - тен 8 аптаға дейін бес-он есе артады. Мысалы, гербераны көбейту кезінде қашудың жоғарғы жағы 4, 62 мкМ/л цитокинин бар қоректік ортаға орналастырылады. Сабақтың жоғарғы өсуі отырғызудан 7-8 күн өткен соң басталады. Негізінде жапырақтары бар вегетативті қашу 5-6 аптадан кейін пайда болады. Қашудың негізінде каллус дамып, тамырлар сараланады. Бүршіктер жапырақтардың сүйектеріне салынады. Цитокининнің ортаға 1, 38 - 4, 62 мкМ/л енгізілуі екінші және үшінші реттік аксиларлы өсінділерді құрайтын бүйірлік бүршіктердің оянуына және тез дамуына әкеледі. Аксиларлы бүршіктерден шыққан өсінділерді кинетиннің бірдей концентрациясы бар ортаға оқшаулау және беру кезінде аксиларлы бүршіктердің активтену процесі қайталанады, ал 3-4 аптада 8-10 қашу пайда болады.
2, 31-13, 29 мкм/л концентрациясындағы BAP (6 - бензиламинопурин) таңқурай, шие, қара өрік, алма ағаштарының аксиларлы қашуының дамуын ынталандырады. Сонымен қатар, стерильді алынған бір шыңнан жылына бірнеше мың өсімдік алуға болады. Мысалы, in vitro таңқурай меристемасын өсіру кезінде 50 000 өсімдікке дейін ұрпақтар алуға болады, ал әдеттегі кесу әдісі жылына 50 өсімдік алуды қамтамасыз етеді.
Аксиларлы қашу алу үшін IN vitro-да пайда болған қашудың немесе қосалқы қашудың кесілген ұштары мәдениетке енгізіледі. Көбею үшін қажет тіндерді апикальды тіндерден кесуге болады немесе бүйірлік қашу. Сыртқы жапырақтарда ластануды болдырмау үшін матаның мөлшерін шектеңіз (1 - 5 мм) .
Апикальды эксплуатация неғұрлым көп болса, соғұрлым ол тез өседі және өмір сүру мүмкіндігі соғұрлым жоғары болады. Апикальды эксплант әдетте цитокинин мен ауксин концентрациясы төмен ортаға орналастырылады. Әрбір келесі трансплантация кезінде ортадағы цитокинин деңгейі көбеюдің максималды жылдамдығына жеткенше біртіндеп артады. Егер тіннің түбінде каллустың пайда болу тенденциясы байқалса, ауксин ортадан шығарылады. Цитокининдер әрдайым дерлік тамырлардың пайда болуын тежейді, сондықтан келесі өсіру циклі нәтижесінде пайда болған қашу байламдары оңай бөлінеді. Цитокинині жоқ ортаға ауысқан кезде тамырлардың пайда болуы өздігінен жүреді, әсіресе монокотилонды өсімдіктерде.
Өсімдіктердің микро көбеюінің басты мәселесі-фитохормондардың қоршаған ортаға шоғырлануы. Микро көбеюге негіз болатын Мурасигтің еңбектерінде цитокининдердің жоғары концентрациясы туралы мәліметтер келтірілген, сонымен қатар қоректік орта құрамы мен өсіру шарттары туралы дайын ұсыныстар берілген. Алайда, көбеюдің максималды коэффициентін алу үшін цитокининдердің жоғары концентрациясын қолдану өсімдік морфологиясының өзгеруі, аксиларлы меристемалардың көбеюін басу және қашудың тамырлану қабілетін төмендету сияқты микро-көбеюге жағымсыз әсерлерді тудырады.
Микро-көбеюдің жеткілікті жылдамдығын қамтамасыз ететін цитокининдердің минималды концентрациясы бар қоректік ортаны пайдалану, сондай-ақ фитохормондардың төмен деңгейі бар ортада өсіру циклдерінің ауысуы цитокининдердің қоректік ортада үнемі болуына байланысты уытты әсерін болдырмауға көмектеседі.
1. 3 Клондық микропроцессордың әртүрлі кезеңдеріндегі өсімдік тіндерін өсіру кезеңдері мен әдістері
Микро көбейту процесі бірқатар дәйекті операциялардан тұрады, олардың әрқайсысының өзіндік ерекшелігі бар. Клондық микропропагация кезеңдері:
- тиісті экспланттарды іріктеу, оларды стерилизациялау және қоректік ортаға көшіру ;
- микропроцессордың өзі;
- өскіндердің тамырлануы, содан кейін оларды топырақ жағдайларына бейімдеу;
- жылыжай жағдайында өсімдіктерді өсіру және оларды далаға отырғызуға дайындау.
I кезең. Түсіндіруді таңдағанда, қолданылатын өсімдік түрін де, микро көбейту әдісін де ескеру қажет. Микроклондарды алу процесіне жыл мезгілі және ата-аналық өсімдіктің даму кезеңі әсер етеді, эксплант реакциясы көбінесе өсімдіктің қай мүшесінен алынғанына байланысты. Көптеген өсімдіктер белсенді өсу кезеңінде мәдениетке жақсы енсе де, кейбір өсімдіктердің экспланттары тек ұйқысыз фазада қашу түзеді. Лалагүл шамдарының таразыларының экспланттарынан жазда немесе қыста емес, көктемде немесе күзде қабылданса, балалардың қалпына келуін алу оңай. Наурыз айында оқшауланған апикальды карнавация меристемасы өміршең өсімдіктердің ең көп пайызын береді. Өсімдіктердің абсолютті жасы неғұрлым аз болса, қашу соғұрлым қарқынды өседі. Бұл тәуелділік әсіресе ағаш өсімдіктерінде айқын көрінеді.
Эксплантты оқшаулау және оны зарарсыздандыру туралы айтатын болсақ, стерилизацияның сәттілігіне әсер ететін экспланттың ата - аналық донор өсімдіктерін арнайы даярлау мәселесін елемеуге болмайды.
Рудбекия розеткалық өсімдігінің стерильді мәдениетін алу үшін оны сабақты созу үшін қысқа күннен бірнеше күнге ұзақ күннің жағдайына ауыстырған жөн. Бұл жердегі жапырақтардың розеткасының пайда болуына әкеледі өсімдіктердің сабақтарының бөліктері. Бұл жағдайда әдеттегі стерилизациялық ерітінділерді қолдану жақсы нәтиже береді.
Гербера-Розетка өсімдігі, оның қысқартылған сабағы апекспен бірге жерге батырылады. Сонымен қатар, қашудың жоғарғы жағы көптеген түктермен жабылған, олардың арасында жердің ұсақ бөлшектері жиналады. Мұның бәрі жалпы қабылданған шаралармен зарарсыздандыруды қиындатады. Тек аналық өсімдіктерді отырғызу әдісін өзгерту арқылы қанағаттанарлық нәтижелерге қол жеткізілді. Аналық өсімдіктерді сабақтың өсу нүктесі жерден жоғары болатындай етіп отырғызу керек.
Деберг пен Мейн микро көбеюде арнайы нөлдік кезеңді бөлуді ұсынады, оның мақсаты өсімдіктерді экспланттарды оқшаулауға дайындау болуы керек.
Нөлдік кезеңде өсімдіктерді төмен ылғалдылықпен және шектеулі суарумен жылыжайларда өсіру керек. Су топыраққа тікелей тамырға түсіп, арнайы капиллярлар арқылы енуі керек. Жоғарыдан суарудан аулақ болу керек. Бұл жағдайлар Өсімдіктердің өсуіне қолайлы емес, бірақ жұқтырған өсімдіктердің саны күрт төмендейді. Эксплантты оқшаулаудан бірнеше апта бұрын өсімдіктер пестицидтермен өңделеді, ал оның эксплант ретінде қызмет ететін бөлігі қоздырғыштардың жәндіктермен берілуіне жол бермеу үшін дәке сөмкесімен жабылады.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz