Бериллий: ашылуы, физикалық-химиялық қасиеттері, өндіру технологиялары мен қолданылуы


Мазмұны
Кіріспе
1. Бериллийдің ашылу және алудың негізгі қасиеттері мен технологиялары
1. 1Бериллийдің ашылу және берилийді алудың негізгі қасиеттері мен технологиялары
1. 2 Берилийдің табиғатта кездесуі
2. Берилийдің физикалық және химиялық қасиеттері, қосылыстары
2. 1 Физикалық қасиеті
2. 2 Химиялық қасиеті
2. 3 Бериллий қосылыстары
3. Бериллийді өндірісте алу, өндіру және оның биологиялық рөлі мен қасиеттері
3. 1 Бериллий қортпаларын алу, өндіру, өңдеу
3. 2 Бериллийдің өндірістегі биологиялық рөлі
3. 4 Бериллий қорытпалары, олардың қасиеттері және қолданылуы
4. Қауіпсіздік техникасы
4. 1Бериллиймен және оның қосындыларымен жұмыс істеу кезіндегі қауіпсіздік техникасы
Қорытынды
Қолданылған әдебиеттер мен мақалалар тізімі
Кіріспе
Өнеркәсіпте және күнделікті өмірде қолданылатын металл бұйымдары сирек таза металдардан тұрады, мысалы, шамамен 99, 9% металл пайызы бар алюминий немесе мыс сым, көптеген басқа жағдайларда қорытпалар туралы айтылады. Қорытпалар-екі немесе бірнеше металдардан, сондай-ақ металл күйіне тән қасиеттері бар металдар мен бейметалдардан тұратын жүйелер. Сонымен, темір мен Болаттың әртүрлі түрлерінде металл қоспаларымен қатар қорытпалардың механикалық және жылу әсеріне шешуші әсер ететін көміртектің аз мөлшері бар. Барлық қорытпалардың арнайы таңбалануы бар, өйткені бір атаумен қорытпалар (мысалы, жез) басқа металдардың әртүрлі массалық үлестеріне ие болуы мүмкін.
Қорытпаларды өндіру үшін әртүрлі металдар қолданылады. Барлық қорытпалардың ішіндегі ең маңыздысы әртүрлі құрамдағы болаттар. Легирленген болаттарды алу үшін қорытпаның негізгі компоненті болып табылатын темірге кремний, мыс, марганец, никель, хром, вольфрам, ванадий, молибден және басқа компоненттер қосылады.
Асыл тастар түріндегі бериллий қосылыстары ежелгі уақытта белгілі болған. Ұзақ уақыт бойы адамдар аквамарин, Изумруд және Берилл кен орындарын іздеді және игерді.
Бірақ тек 18 ғасырдың аяғында химиктер берриллде жаңа белгісіз элемент бар деп күдіктенді. 1798 жылы француз химигі Воклен бериллден алюминий оксидінен ерекшеленетін "La terree du beril" тотығын бөліп алды. Бұл оксид тұздарға тәтті дәм берді, алюминий түзбеді, аммоний карбонатының ерітіндісінде ериді және оксалат немесе калий тартратымен тұндырылмады. Бериллий металын алғаш рет 1828 жылы белгілі неміс ғалымы Велер және сонымен бірге француз ғалымы Блуссен ол бериллий хлоридін металл калийімен қалпына келтіру арқылы металл бериллий ұнтағын алған. алған,
Бериллийді өнеркәсіптік алу біздің ғасырдың 20-жылдарында ғана басталды. Қырықыншы жылдарға дейін бериллийді өндіру және қолдану ауқымы үлкен болған жоқ. Алайда, бериллийдің атомдық энергетикада қолданылуын анықтайтын қасиеттерінің ашылуымен оған деген сұраныс едәуір өсті. Бұл өз кезегінде осы саладағы зерттеу және геологиялық-барлау жұмыстарының кең дамуына себеп болды.
Бұл жұмыста бериллий металының және құрамында бериллий бар қорытпалардың қасиеттері мен қолданылуы қарастырылады.
Курстық жұмыстың мақсаты: Бериллийдің ашылуы, қасиеттері өндірісте қолдануы мен қауіпсіздігін қарастыру.
Курстық жұмыстың міндеті:
- Бериллийдің ашылу және бериллийді алудың негізгі қасиеттері мен технологиялары
- Берилийдің физикалық және химиялық қасиеттері, қосылыстары
- Бериллийді өндірісте алу, өндіру және оның биологиялық рөлі мен қасиеттері, қауіпсіздік техникасы
Курстық жұмыстың өзектілігі: Жыл сайын әлемдік өнеркәсіптің бериллияға қажеттілігі артады. Өндірілген бериллийдің көлемі (металға қайта есептегенде) 2008 жылдан 2018 жылға дейін 15% (2008 жылы өндіру көлемі 200 т құрады, 2016 жылы -230 т) . 2018 жылы бериллийдің жалпы әлемдік тұтынуы шамамен 250 т металға қайта есептегенде. Металл бериллийдің құны тазалыққа тәуелділік 30-дан 120 мың рубль/кг-ға дейін. Жоғары құны бериллий оны пайдалану салаларында қолданылады сыни және материалдарды қолдану-алмастырғыштар қолайсыз әкеледі техникалық-пайдалану сипаттамаларын төмендету. Өнеркәсіпте мұндай сыни салаларда мыс-бериллий қорытпаларын өндіру, металл Бериллий және бериллий керамикасы.
1. Бериллийдің ашылу және алудың қасиеттері мен технологиялары
1. 1Бериллийдің ашылу және бериллийді алудың негізгі қасиеттері мен технологиялары
Бериллий XVIII ғасырдың соңында ашылды, бірақ химиктер оның ерекше және өте пайдалы қасиеттерін бұрыннан білсе де, " жұмыссыз " элемент болып қала берді. Бұл элементтің қасиеттерін пайдалану үшін ғылым мен техниканың белгілі бір даму деңгейі қажет болды.
Бериллий ұзақ уақыт бойы ашыла алмады, дегенмен XVIII ғасырдың химиктері бериллді (бериллийдің негізгі минералы) талдады, бірақ олардың ешқайсысы бұл минералдан жаңа элементті таба алмады. 1798 жылы француз химигі Луи Николас Воклен Берилл мен изумрудқа салыстырмалы талдау жасау кезінде оларда белгісіз тотықты - "жерді"ашты, ол алюминий оксидіне өте ұқсас болды, бірақ айырмашылықтар да болды:
- оксид аммоний көмір қышқылында ериді (алюминий тотығы ерімейді) ;
- жаңа элементтің күкірт қышқылы тұзы калий сульфатымен алюминий түзбеді (және алюминий сульфатының тұзы осындай алюминий түзеді) .
Дәл осы айырмашылық алюминий оксидтері мен белгісіз элементті бөлу үшін пайдаланылды. Оксид тұздарға тәтті дәм берді және оны "глицин" деп атау ұсынылды, ал 1814 жылы Харьков профессоры ф. и. Гизе № 4 элементті бериллий деп атады. 1797 жылы Сібір қызыл қорғасын кенінде ол жаңа элемент - хромды ашып, оны еркін күйде бөлді. Бір жылдан кейін (1798 ж. ) бериллдің қымбат минералында Воклен бериллий деп аталатын тағы бір жаңа элементтің тотығын тапты
Тек 1898 жылы Лебо бериллиофторлы натрий электролизімен таза бериллийді ала алды.
Бериллий металын алғаш рет 1828 жылы белгілі неміс ғалымы Велер және сонымен бірге француз ғалымы Блуссен алған, ол бериллий хлоридін металл калийімен қалпына келтіру арқылы металл бериллий ұнтағын алған.
Бериллийді өнеркәсіптік алу біздің ғасырдың 20-жылдарында ғана басталды. Қырықыншы жылдарға дейін бериллийді өндіру және қолдану ауқымы үлкен болған жоқ. Атом энергетикасында қолданылатын бериллий қасиеттерінің ашылуымен оған сұраныс едәуір артты.
Бериллий-Д. И. Менделеев элементтерінің периодтық жүйесінің екінші тобының ашық сұр металы. Реттік нөмірі 4, атомдық массасы 9, 013. Be символы (лат. Beryllium) . Оның бір тұрақты 9Be изотопы бар, бериллийдің радиоактивті изотоптары 7be және 10be белгілі, жартылай шығарылу кезеңдері сәйкесінше 53, 29 күн және 1, 6•106 жыл. 1798 жылы Берилл минералынан Л. Воклен оқшауланған beo оксиді түрінде ашылды. Металл Ве алғаш рет 1828 жылы Ф. Велер мен А. Бусси бір-біріне тәуелсіз алды. Кейбір тұздар тәтті дәм болғандықтан, оны алдымен "глюциний" деп атады (грек тілінен. glykys-тәтті) немесе "глиций". Glicinium (gi белгісі) атауы тек Францияда қолданылады. Ve қолдану 20 ғасырдың 40 - жылдарында басталды, дегенмен оның қорытпалардың құрамдас бөлігі ретіндегі құнды қасиеттері бұрын табылған, ал керемет ядролық-30 ғасырдың басында.
Ve екі полиморфты модификацияда болуы мүмкін. 1250 °с дейін болатын төмен температуралы модификацияда (α-Ве) алтыбұрышты тығыз оралған тор, Жоғары температуралы (β-Ве) - көлемдік-центрленген текшенің торы бар.
1. 2 Берилийдің табиғатта кездесуі
Сирек кездесетін металл-жер қыртысында Ве мөлшері 5 • 10-4% (оған жақын литий мен бор сияқты, жер қыртысында салыстырмалы түрде аз кездеседі) . Қышқыл, сілтілі және сілтілі магмаларға тән литофильді элемент. Ол шашыраңқы емес, өйткені ол гранит күмбездерінде соңғы кристалданған пегматитті жыныстардағы бериллдің беткі қабаттарының құрамына кіреді. Ұзындығы 1 м-ге дейін және салмағы бірнеше тоннаға дейінгі алып бериллдер туралы мәліметтер бар.
Бериллий минералдарының 54-і белгілі-олардың ішінде Берилл 3beo•Al2O3•6sio2 практикалық маңызы бар, ол өңделгеннен кейін хлорид немесе фторид түрінде беріледі. Бұл минералдың көптеген түрлі-түсті сорттары бар: изумруд (Cr-нің шамамен 2%-ы оған жасыл түс береді), аквамарин (Fe(II) қоспасы оның көк түсіне әкеледі), воробьевит (mn(II) қосылыстарының қоспаларына байланысты қызғылт), және гелиодор (алтын сары - Fe(III) иондары) . Фенакит 2beo•SiO2, гельвин (Mn, Fe, Zn) 4[BeSiO4] 3s, хризоберил BeAl2O4, бертрандит 4beo•2sio2•H2O перспективалы және ішінара қолданылады.
Дүниежүзілік Табиғи ресурстар 80 мың тоннадан асады (ve мазмұны бойынша), олардың шамамен 65% - ы АҚШ-та шоғырланған (негізгі шикізат-бертрандит кені) . Расталған қорлар-әлемдегі негізгі көзі болып табылатын Spur Mountain кен орнында (Юта штаты) 2000 жылдың соңында шамамен 19 мың тоннаны құрады (металл құрамы бойынша) . Басқа елдердің ішінде ең көп қорларға Қытай, Ресей және Қазақстан ие. КСРО кезінде Ресейде Ве Малышевский (Свердлов облысы), Завитинский (Чита облысы), Ермаковский (Бурятия), Пограничный (Приморск өлкесі) кен орындарында өндірілген. УТК-нің қысқаруына және атом электр станцияларын салудың тоқтатылуына байланысты Малышев пен Ермаковта өндіріс тоқтатылды және Завитим кен орындарында айтарлықтай қысқарды. Сонымен қатар, өндірілген өнімнің едәуір бөлігі шетелге, негізінен Еуропа мен Жапонияға сатылады.
Әдетте сирек кездесетін элемент. Бір тонна жер заты орта есеппен 4, 2 г бериллийден тұрады. Теңіз суында 6 * 10-7 мг/л бериллий бар. Әдетте бериллий жер қыртысының әртүрлі минералдарында шамалы қоспа ретінде кездеседі, жер бериллийінің аз ғана бөлігі өзінің бериллий минералдарында шоғырланған. Олардың 30-дан астамы белгілі, бірақ олардың тек алтауы көп немесе аз таралған болып саналады (берилл, хризоберил, бертрандит, фенакит, гельвин, даалит) . Бериллалар гранит пегматиттерінде кездеседі-бұл кейде өте үлкен мөлшерге жететін жасыл түсті кристалдар; берилли - салмағы бір тоннаға дейін және ұзындығы 9 м-ге дейінгі алыптар белгілі, бериллийдің басқа көздері бар-пневматикалық-гидротермалды кен орындары (яғни Жоғары температуралы булардың және ерітінділердің белгілі бір тау жыныстарымен әрекеттесуі нәтижесінде пайда болған кен орындары) .
2. Берилийдің физикалық және химиялық қасиеттері, қосылыстары
2. 1 Физикалық қасиеті
Физикалық қасиеттері-басқа жеңіл материалдармен салыстырғанда, бериллий физикалық және механикалық қасиеттердің ерекше үйлесіміне ие.
Кристалдық тор Ве алтыбұрышты тығыз қаптамаланған кезеңдерімен а = 2, 855 Å және С= 3, 5840 Å.
Тығыздығы 1847, 7 кг / м3
Балқу температурасы 1551 °C
Қайнау температурасы 3243 оС
Жасырын балқу температурасы 250-275 кал/г (барлық металдардың ішіндегі ең жоғарғысы)
Сызықтық кеңею коэффициенті 10, 3-131 (25-100 °C)
Бойлық серпімділік модулі (Юнг модулі) 300гн/м2 (3. 104 кг•с/мм2)
Созылу беріктігі 200-550 МН/м2 (20-55 кг•с/мм2) )
Аққыштық шегі 250-600 МН/м2 (25-60 кг•с/мм2)
Созу бағытындағы беріктік шегі-400-800мн / м2 дейін (40-80 кг•с/мм2) салыстырмалы ұзаруы-4-12 дейін%
Соққы тұтқырлығы 10-50 кДж/м2 (0, 1 - 0, 5 кгс. * М / см2)
Сынғыш күйден пластикалыққа ауысу температурасы 200-400 °С
Қаттылығы НВ 60-85 (ыстықтай басылған Ве үшін)
Α-Ве үшін жылу сыйымдылығы 16, 44 Дж/(моль•К), β-Ве үшін - 30, 0 Дж / (моль * К)
Ве ие: барлық металдардың ең жоғары меншікті жылу сыйымдылығы - 1, 80 кДж / (кг. •К) немесе 0, 43 ккал / (кг•°С)
жоғары жылу өткізгіштік-178 Вт/(м•К) немесе 0, 45 кал / см * сек * °с) (50 °С)
төмен электр кедергісі-3, 6-4, 5 мкОм•см (20 °С)
Ve-нің кейбір қасиеттерін басқа материалдардың сипаттамасымен салыстырыңыз.
Материалдардың нақты беріктігі мен қаттылығы.
Температураның әртүрлі материалдардың серпімділік модуліне әсері
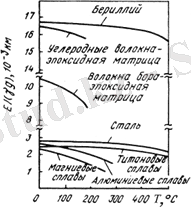
Ve қасиеттері металдың сапасы мен құрылымына байланысты және температурамен айтарлықтай өзгереді, механикалық - металдың тазалығына, дән мөлшері мен өңдеу сипатымен анықталатын құрылымға байланысты. Қысыммен өңдеу Ве кристалдарының белгілі бір бағытына әкеледі, анизотропия пайда болады, қасиеттерін едәуір жақсартуға болады. Сорғышқа перпендикуляр бағытта механикалық қасиеттер өзгермейді. Ве-бөлме температурасында сынғыш металл (әсіресе шойын), бұл оны құрылымдық материал ретінде кеңінен қолдануға кедергі болып табылады; материалдың одан да сынғыштығына тіпті шамалы қоспалардың құрамы әкеледі(мысалы, тазартылған Ве-ге тек 0, 001% Si енгізу) . Ол төмен икемділікке және коррозияға жақсы төзімділікке ие. Балқу температурасындағы будың икемділігі өте аз.
Құйылған және деформацияланған күйдегі ve механикалық қасиеттері сынақ бағытына байланысты өзгереді. Ең жақсы механикалық қасиеттер жылы қысыммен өңдеуден кейін пайда болады, ол қайта кристалдану температурасынан төмен температурада жүзеге асырылады. Ве қайта кристалдану температурасы деформация дәрежесіне және ұстау уақытына байланысты 700 °С-тан 900 °С-қа дейін өзгереді. Қайта кристалдануды тазарту икемділікті едәуір арттырады және be беріктігін төмендетеді.
Be беріктігінің тығыздыққа қатынасы Ti және Al негізіндегі авиациялық болаттар мен қорытпаларға қарағанда едәуір жоғары.
Ve-нің маңызды ерекшелігі оның рентген сәулелеріне жоғары өткізгіштігі болып табылады, ол алюминийден 17 есе жоғары.
Жоғары ядролық сипаттамалары металдардың ішіндегі ең төмен жылу нейтрондарының тиімді көлденең қимасы және олардың шашырауының ең жоғары көлденең қимасы болып табылады.
Al және Si-мен эвтектикалық қорытпалар береді. Қоспалық элементтердің ерігіштігі өте аз.
2. 2 Химиялық қасиеті
Химиялық қасиеттері +2 және +1 тотығу күйлері (соңғысы өте тұрақсыз), сыртқы электрондардың конфигурациясы 2s2.
Химиялық қасиеттері бойынша Be Al сияқты. Осы элементтер арасындағы ұқсастық валенттілік пен Ве атомдық массасы туралы айтарлықтай қате түсінікке әкелді-ұзақ уақыт бойы Ве салыстырмалы атомдық массасы 14 болатын үш валентті болып саналды (бұл Ве 3 × 4, 7 эквивалентінің үш есе массасына тең) ; Ве ашылғаннан кейін 70 жылдан кейін ғана орыс ғалымы Д. И. Менделеев өзінің периодтық кестесінде мұндай элемент үшін орын жоқ деген қорытындыға келді, бірақ салыстырмалы атомдық массасы 9 болатын екі валентті элемент (шамамен 2 × 4, 7 в эквивалентінің екі еселенген массасына тең) Li мен B арасында оңай орналастырылады.
Металл Ве бөлме температурасында салыстырмалы түрде аз реактивті (мысалы, оның бетінде пайда болған оксид пленкасының арқасында ауа оттегіне төзімді), бұл жағдайда F2 өзара әрекеттеседі. Ықшам түрде ол қызыл температура кезінде де сумен және су буымен әрекеттеспейді және 600° C-қа дейін ауамен тотықтырмайды, 1200 °C температурада металл Ве ақ ВеО ұнтағына айналады. Галогендер ve-мен 600° C-тан жоғары температурада әрекеттеседі, ал халькогендер одан да жоғары температураны қажет етеді. Ықшам Ве N2 - мен 1000 градустан жоғары температурада, ал ұнтақ күйінде-500 ° C-тан жоғары температурада қарқынды әрекет етеді. Аммиак Be3n2 нитридін қалыптастыру үшін 1200° C-тан жоғары температурада ve-мен әрекеттеседі, ал көміртегі 1700° C-та Ve2c карбидін береді. C H2 ve тікелей жауап бермейді және ВеН2 гидридін жанама жолмен алады (бериллийорганикалық қосылыстардың ыдырауы кезінде алынған, 240 °C дейін төзімді) .
Ве қышқылдардың сұйылтылған Сулы ерітінділерінде оңай ериді (тұз, күкірт, азот, гидрофтор), концентрацияланған күкірт және азот қышқылдарымен нашар әрекеттеседі, бірақ суық концентрацияланған азот қышқылы металды пассивті етеді. Сілтілердің Сулы ерітінділерімен Ве реакциясы Н2 бөлінуімен және пайда болуымен бірге жүреді:
Be + 2NaOH (p) + 2H2O = Na2 [Be (OH) 4] + H2
400-500° С кезінде сілті балқымасымен реакция жүргізген кезде диоксобериллаттар түзіледі:
Be + 2NaOH (ж) = Na2BeO2 + H2
Металл ve NH4HF2 сулы ерітіндісінде тез ериді. Бұл реакция сусыз BeF2 алу және ve тазарту үшін технологиялық мәнге ие:
Be + 2nh4hf2 = (NH4) 2 [BeF4] + H2
Ұсақ дисперсті ұнтақ S, Se, Te жұптарында жанады. Балқытылған Be көптеген оксидтермен, нитридтермен, сульфидтермен және карбидтермен әрекеттеседі.
2. 3 Бериллий қосылыстары
Ве, 2-топтың басқа элементтерінен айырмашылығы, негізінен иондық байланысы бар қосылыстар жоқ, сонымен бірге ол үшін көптеген координациялық қосылыстар, сондай-ақ көп орталықты байланыстар жиі пайда болатын органометалл қосылыстары белгілі.
Атомның аз мөлшеріне байланысты ve әрдайым аналитикалық химия үшін маңызды 4 координациялық санын көрсетеді.
Ве тұздары өте гигроскопиялық және аздап қоспағанда (фосфат, карбонат) суда жақсы ериді, тез гидролизденіп, анықталмаған құрылымның бірқатар гидроксокешендерін түзеді, ерітінді ортасы қышқыл болады. Жауын - шашын oh-:Be2+ > 1 қатынасында басталады. Сілтінің одан әрі қосылуы тұнбаның еруіне әкеледі.
Ve Ven2 гидридін алғаш рет 1951 жылы Lialh4 көмегімен Vecl2 қалпына келтіру арқылы алды. Аморфты ақ зат, 250° C дейін қызған кезде ВеН2 гидриді Н2 шығарады. Бұл қосылыс ауада және суда орташа тұрақты, бірақ қышқылдармен тез ыдырайды. ВеН2 Венвенің үш центрлі байланыстарына байланысты полимерленеді.
BeHal: сусыз BeHal [Be(H2O) 4] F2 және гидролиз сияқты гидраттардың пайда болуына байланысты Сулы ерітінділердегі реакциялар арқылы алынбайды. BeF2 алудың ең жақсы тәсілі-термиялық ыдырау (NH4) 2[BeF4], ал BeCl2 оксидтен алуға ыңғайлы - бұл үшін Cl2 BeO және CO2 қоспасына 650-1000° C температурада әсер етеді. Дәл осындай реакциялар сусыз бромид пен иодидті алу үшін қолданылады.
BeF2-бұл шыны тәрізді материал, оның құрылымы F атомдарының көпірлерімен байланысқан Ве (КЧ 4) атомдарының реттелмеген торынан тұрады және кварц шыны құрылымына ұқсас. 270° C-тан жоғары BeF2 өздігінен кристалданады. Кварц сияқты, ол төмен температуралы α түрінде болады, ол 227° C температурада β формасына өтеді, сонымен қатар Кристобалит пен тридимит формаларын алуға болады. BeF2 мен SiO2 арасындағы құрылымдық ұқсастық фтороберлаттарға да таралады (BeF2 сілтілік элементтер мен аммоний фторидтерімен әрекеттескенде пайда болады) және силикаттар.
BeF2-балқытылған тұздардағы ядролық реакторларда қолданылатын фторобиллат әйнектері мен тұз қоспасының құрамдас бөлігі.
Хлорид пен басқа Галогенидтерді ве координациялық саны 4-ке тең болатын көп ядролы күрделі қосылыстар ретінде қарастыруға болады. BeCl2 кристалдарында cl көпірлік атомдары бар шексіз тізбектер бар:
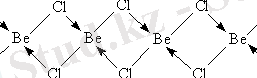
Қайнау температурасы 550° C болса да, газ фазасында Be2Cl4 димер молекулаларының шамамен 20% - ы болады.
BeCl2 тізбегінің құрылымы диэтил эфирі сияқты әлсіз лигандтармен оңай ыдырайды, молекулалық кешендерді [BeL2Cl2] :
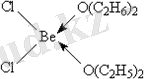
Су немесе аммиак сияқты күшті донорлар [BeL4] 2+(Cl-) 2 иондық кешендерін береді. Артық галогендік иондардың қатысуымен галогендік кешендер пайда болады, мысалы [BeF4] 2-.
Be beo оксиді табиғатта сирек кездесетін минералды бромелит түрінде кездеседі.
Қыздырылмаған ВеО гигроскопиялық, 34% суды сіңіреді, ал 1500° C температурада кальциленген - тек 0, 18%. 500° С - тан жоғары емес кальциленген ВеО қышқылдармен оңай әрекеттеседі, ал сілтілі ерітінділермен қиынырақ, ал 727° с - тан жоғары кальциленген-тек HF, ыстық концентрацияланған күкірт қышқылы және сілтілердің балқымалары. BeO балқытылған Li, Na, K, Ni және Fe әсеріне төзімді.
Жоғары тазалық өнімі негізгі ацетаттың [Be4O(OOCH3) 6] 600° C-тан жоғары ыдырауы кезінде пайда болады.
BeO өте жоғары жылу өткізгіштікке ие-100° C температурада ол 209, 3 Вт/(м•К), бұл кез-келген бейметалдарға, тіпті кейбір металдарға қарағанда көп. Veo жоғары балқу температурасын (2507° C) төмен температурада төмен бу қысымымен біріктіреді. Ол тигельдерді, Жоғары температуралы оқшаулағыштарды, құбырларды, термопараларға арналған қақпақтарды, арнайы керамиканы жасау үшін химиялық төзімді және отқа төзімді материал ретінде қызмет етеді. Инертті атмосферада немесе вакуумда ЖЕҚ тигельдерін 2000° с дейінгі температурада қолдануға болады.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz