Спирт өндірісінің крахмал шикізатын қанттандыру сатысына арналған амилолитикалық ферменттердің өндіріс технологиясын жетілдіру және технико-экономикалық негіздемесі


Аннотация
Беттер кесте сурет
Түйінді сөздер
Активатор, ингивитор, глюковаморин, амилолитикалық фермент.
Дипломды жұмыста крахмал шикізатының қанттандыру сатысына арналған амилолитикалық фермент өндірісінің дамуындағы мәселелер қарастырылған. Жұмыста оның негізгі бөлімдері кіреді. Крахмал шикізатының қанттандыру сатысына арналған амилолитикалық фермент өндірісінің технологиясын жаңарта отырып, крахмал гидролизін қанттандыруға арналған препараттарға салыстырмалы сипаттама қарастырылған. Осы пероцестерде қолданылатын штамдардың физико- химиялық ерекшелігі, үздіксіз культивирлеу әдістері мен фермент активаторымен ингивиторы, ферменттің микроорганизмдер продуцентін культивирлеудің өндірістік әдісі қарастырылған.
Технологиялық сызба- нұсқаға сипаттама жасалып, негізгі және көмекші аппарат таңдалынған. Сонымен қатар технологиялық есептер, материалдық, және жылу балансы орындалған. Микробиологиялық және санитарлық бақылаулар қарастырылған
Мазмұны
Нормативтік сілтеме
Белгілер мен қысқартылған сөздер
Анықтама терминдер
Кіріспе
1 Аналитикалық шолу
1. 1 Крахмал гидролизін қанттандыруға арналған препараттарға салыстырмалы сипаттама
1. 2 Ферменттердің әсер ету механизмі
1. 2. 1 Химиялық реакцияладың катализаторы - ферменттер
1. 2. 2 Ферменттің активаторлары мен ингибиторлары
1. 2. 3 Амилолитикалық ферменттердің механизмінің әрекеті
1. 3 Микробтық фермент препаратын алу
1. 3. 1 Ферменттің микроорганизм - продуценті
1. 3. 2 Фермент препаратының номенклатурасы
1. 3. 3 Ферменттің микроорганизм продуцентін культивирлеудің өндірістік әдісі
1. 4 Шикізатқа сипаттама
1. 5 Тазартылған фермент препаратын алу
1. 6 Патенттік ізденістер
2 Жұмыстың өндірісті технико-экономикалық негіздеу
2. 1 Құралыс ауданын және орнын таңдау
2. 2 Ғылыми -зерттеу бөлімі
2. 2. 1 Тәжірибе жасаудың мақсаты
2. 2. 2 Тәжірибені жүргізу жағдайы
2. 2. 3 Нәтижелерін талқылау
3 Технологиялық бөлім
3. 1 Культивирлеуге арналған қоректік орта және шикізаттар
3 . 2 Егіс материалын алу және көбейту
3. 3 Спирт тұнудағы амилолитикалық ферменттерді түптік культивирлеу әдісімен алудың технологиялық сызба - нұсқасы
3. 4 Гх 466 Глюкавамарин өндірістің технологиялық сызба нұсқасы
3. 5 Фермент ерітіндісін концентрлеу
3. 6 Қайнатылған массаны қанттандыру үшін микроорганизмдер культурасын қолдануға дайындау
3. 7 Негізгі аппаратқа сипаттама
3. 8 Қосымша аппаратқа сипаттама
3. 9 Технологиялық есебі
3. 91 Құрал - жабдықтардың санын және жұмыс істеу қорын есептеу
3. 9. 2 материалдық баланс
3. 9. 3 Ферменттердің конструктивтік есебі
4 Тіршілік -қауіпсіздігі
5 Қоршаған ортаны қорғау
6 Экономикалық бөлім
6. 1 Цехтың өндірістік қуатын анықтау
6. 2 Капиталды шығындарды есептеу
6. 3 Еңбек ақы және жалақы
6. 4 Дайын өнімнің өзіндік құнын есептеу
7 Бизнес - жоспары
Түйін
Қолданылған әдебиеттер
Спецификациясы
Анықтама терминдер
Ферменттер -табиғатында ақуыз болып табылатын биокатализаторлар.
Катализатор - химиялық реакцияны жылдамдата отырып, өзгеріске ұшырамайтын заттарды айтамыз.
Ферменттік активтілік -белгілі фермент бөлшегінің көмегімен нақты уақыт ішінде алынған субстрат шамасы.
Флавиндік дегидрогеназ- сутегі атомын бөліп алу жолымен субстратты тотықтырады.
Амилаза - спирт, сыра, шарап, нан, кондитер заттарын алуда қолданылады.
Глюкоамилаза - глюкоза алуда, сырадан декстринді жоюда.
Инвертаза - кондитерлі өнімді өндіруде.
Пуклулоназа - мальтоза өндірісінде .
Галактозидаза - балмұздақ дайындауда, сүт сары суын лактозадан босатуда.
Целюллоза - араласқан кофе, сәбіз цитрус өнімін өңдеуде.
Пектиназа - шарапты түссіздендіруде, жеміс секторын түссіздендіруде.
Микробты протеза - сыра қайнатуда, қамырдың жетілуін тездетуде, ет сапасын жақсартуда.
Пепсин, папаин - сыраны түссіздендіруде.
Пепсин, трепсин, бромелаин - балықты мориновать ету процесін тездетуде.
Липаза - жұмыртқа ақуызын езгенде сапасын жақсартады.
Глюкозаоксидаза, католаза - құрғақ сүтте, кофе, сыра, жеміс соктерін жақсартуда және ұзақ уақыт сақтауда оттегін жоюда қолданылады.
Белгілер мен қысқартылған сөздер
БТ - Биотехнология
МБ - Микробиология
М. О - Микроорганизм
ФАД -
ТПФ - Тиминпрофасфат
ТДФ - Тиминдифосфат
НАД - Никотинамиднуклеотид
НАДФ -
КО - Кофермент
ФМН - Флавинмононуклеотид
ПКО - Пиридоксиндік кофермент
Кіріспе
Зерттеудің өзектілігі: Крахмал шикізатының қанттандыру сатысына арналған амилолитикалық фермент өндірісінің дамуындағы мәселелердің бірі; Қазақстан Республикасының ферменттік заттар нарығын сапалы, эффективті, бәсекеге қабілетті отандық препараттармен қанықтыру болып табылады.
Ферменттер - бұл тірі жасушадан синтезделетін органикалық қосылыстар. Ферменттірдің өте аз концентрациялы микроорганизмдердің өсуін шапшаңдатуға қабілетті. Оларды тек микроорганиздер жасушасы ғана емес, өсімдіктер және жануарлар жасушасынан алады.
Жұмыстың қызметі мен мақсаты: бұл жұмыстың мақсаты фермент препаратын алу болып табылады. Алға қойған мақсатқа жету үшін келесі мәселелерді шешу керек:
-Әдебиеттерге патенттік ізденіс жасау;
-Технологиялық процесті толық сипаттау және тәжірибелер жүргізу;
-Фермент препаратын алуға аналитикалық шолу;
-Инженерлік есептерді шығару;
-Технологиялық процесті автоматтандыру;
-Қоршаған ортаны және тіршілік қауіпсіздігі шараларын шешу;
-Өндірістік ғимаратты жоспарлау;
-Жоспарланған өндірістің экономикалық эффективтілігін анықтау.
-Ғылыми жаңалық:
- Спирт өндірісінің қанттандыру сатысына арналған амилолитикалық ферменттер микроорганизмінің штамы алынды. Ол өзінің жоғарғы активтілігімен және көбею коэффициентінің жоғарлығымен ерекшеленеді.
- Активті ферменттер ретінде глюкоамилаза, α-амилазалар алынады. Олар ашытқылардың физиологиялық жағдайын жақсартады, өсіру процесінің ұзақтығын қысқартады.
Іс жүзінде бағалығы:
- Амилолитикалық фермент өндірісін жоспарлау;
- Фермент өндірісінің технологиясы;
- Спирт өндірісінің қанттандыру сатысында қолданылатын ферменттік препараттарды іс - жүзінде қолдану;
- Өндірісті жоба бойынша есептеу;
- Конструкциялы цилиндр - конусты ферментер аппараты;
- Өндірістің экономикалық эффективтілігіне анализ;
Тәжірибелік мәні мынадай мәселелерден тұрады:
- амилолитикалық ферменттер микроорганизмінің штамын қолдану арқылы қазіргі заманға сай теориялы және тәжірибелік фермент өнімдерін жобалау;
- Алынған нәтижелерді ТЭК құрастырған спирт зауытында қолдануға болады.
Биотехнологияның дамуы оны қолдануды эффективтілігін жоғарлатады.
Қорғауға қатысты ережелер:
- өндірістің технологиялық сызба нұсқасы;
- ғылыми зерттеудің нәтижелері;
- негізгі және қолданбалы құрылғының конструкциясы;
- цехтың негізі технологиялық көрсеткіштері;
Жұмыстың апробациясы және жариялануы. Жұмыстың нәтижелері жарияланбаған. Жұмыстың құрылымы және көлемі. Дипломдық жұмыс беттен тұрады, бірнеше суреті бар, кестесі, негізгі көзі болып отандық және шетелдік әдебиеттер тізімі кітап табылады.
1 Аналитикалық шолу
1. 1 Крахмал гидролизін қанттандыруға арналған препараттарға салыстырмалы сипаттама
Бидайды және картопты қайнату арқылы крахмал ерітіндісін, бидай солодының амилолитикалық ферменттермен немесе микроорганизм культурасымен гидролиздейді. Көбнесе микроскопиялық зең саңырауқұлақтарымен бактериялар қолданылады.
Амилолитикалық ферменттер көптеген жоғары сатылы өсімдіктердің құрамында кездеседі. Солод крахмалды қанттандырады. Ол өте ертеден қолданылып келеді, содан бері солод спирт алу үшін қолданылады. Сонымен бірге микроскопиялық саңырауқұлақтардың крахмалды қанттандыратын қасиеті де ертеден белгілі болған. Олардың көмегімен шығыс елдері хмельденген сусындар дайындайды.
Спирт өндірісінде микроскопиялық саңырауқұлақтың культуралары немесе фермент препараттары спирт өндірісінде жиі қолданылады. Олар концентрленген шырын түрінде немесе құрғақ ұнтақ түрінде пайдаланылады. Бірақ көбнесе културальды сұйықтық түрінде қолданылады.
Спирт өндірісінде микроскопиялық саңырауқұлақ културалары солодпен салыстырғанда бидай немесе қоректік орта құрамы ретінде кәдімгі жүгері ұнын қолданып өсіреді. Онда солодты дайындау үшін крахмал шикізатының массасына есеппен 14-20% шартқа сәйкес бидай, солдты өсіру үшін 16-18% крахмал жоғалады. Спирт өндірісіндегі процестерде солод крахмалының бір бөлігі қанттанбаған күйде қалады және ашымайды. Сонымен қатар суслоға солодпен бірге бөгде микроорганизм енгізілсе, олар спирттің шығуы кезінде теріс реакция көрсетеді. Крахмалды толық қанттандыру мақсатында әртүрлі дәндегі солод қоспасын қолдану процесті қиындатады.
Крахмалды толық гидролиздеу үшін микроскопиялық саңырауқұлақ культураларында солод ферменттерінен ерекше амилолитикалық ферменттер комплексі бар. Микроскопиялық саңырауқұлақтарда целлизиотикалық ферменттер активті және олар гемицнллюлозаны қантқа дейін ыдыратады. Олардың бір бөлігі ашытқыда ашиды да, спирттің шығуын жоғарлатады. Микроскопиялық саңырауқұлақтар культураларының көмігімен фермент концентрациясын жоғарлатуға болады. осы арқылы қанттандыру ұзақтығын сусланың ашуын 2- 3 рет қысқартады.
Микроскопиялық саңырауқұлақтар тез көбейеді. Беттік культураларды өсіру үшін1, 5 тәулік жеткілікті. Солодты алу үшін бидайды өсіру 9-10 тәуліккесозылады. Спирт ашу процесінде тазалықты қамтамасыз ету үшін түптік культураларды өсіру залалсызданған жағдайда орындалады.
Крахмалды қанттандыру үшін микроскопиялық саңырауқұлақ культураларымен солод әректә шектелмейді. Жасуша қабырғасындағы эндосперм қоспасының бір бөлігі және ашытқыны қоректендіру үшін органикалық азот сусланы қорландыруға қабілеті. Бұл процестердің жүруі үшін микроскопиялық саңырауқұлақтармен солодты өсіру үшін көптеген ферменттерлер қатысады. Сондықтан олардың химиялық табиғатын, құрылысын және механизм әрекетін білу қажет.
1. 2 Ферменттердің әсер ету механизмі
1. 2. 1 Химиялық реакцияладың катализаторы - ферменттер
Ферменттер-ақуыздар табиғаттың катализаторы. Бейорганикалық катализатор сияқты химиялық саңырауқұлақтардың жылдамдығын өзгертеді. Ферменттер жылдамдыққа әсер ету арқылы, соңғы өнім реакциясының құрамына кірмейді.
Ферменттер гомогенді және гетерогенді болып 2-ге бөлінеді. Олар өзінің активтілігін қоспада, молекулярлы массада көрсетеді. Ферменттер ақуыздардан тұрады. Полипептид тізбегінде аминқышқылдардың тізбектеп орналасуы тек қана генетикалық кодпен ғана сипатталмайды, бірақ сонымен қатар тізбектегі әртүрлі химиялық байланыстарды әрбір фермент құрылысы үшін анықтайды. Сондықтан ферменттердің бір ерекшелігі әрекет ету қабілеті жоғары. Әр фермент тек белгілі субстратқа ғана әсер етеді, кейде ұқсас құрылымы бар субстраттар тобына да әсер етеді. Молекуладағы белгілі бір химиялық байланыстарды ғана ажыратып бөледі.
Ақуыздар сияқты ферменттердің ерекшелігі жоғары лабильділік. Орта жағдайына байланысты қасиеті тез өзгереді. (рН, температура, активатор мен ингибитор қатысуымен және т. б. ) . Бейорганикалық катализаторлардың айырмашылығы -төменгі температурада, орта қысымда қолданады және химиялық реакцияны өте жеңіл жағдайда жүргізуге мүмкіндік береді.
Тірі ағзалар үшін фермент әрекеті өзгеше. Құрылысы бұзылған жағдайда (координация қатысуымен) ферменттер каталитикалық функциясын жоймайды.
Ферменттер бір және екі компонентті болады. Бір компонентті ферменттер (жай ақуыздар, протеиндер) олар тек ақуыздардан тұрады. Олар каталитикалық қасиетке ие. Оларда көбінесе серин, гистидин, триптофан, аргинин, тирозин, аспаргин және глутамин қышқылдары байқалады. Бос радикалдар (-NH 2 , -NH, -SH, -COOH және т. б. ) осы аминқышқылдарды активті орталық құрады. Осы орта құрамына кіретін аминқышқылдың қалдығы полипептидті тізбектің әр жерінде орналасады. Сондықтан ақуыздар молекуласының активті орталық пішіні шар тәрізді болағанда пайда болады.
Екі компонентті ферменттер (күрделі ақуыздар, протеидтер) . Олар ақуыз емес бөліктен тұрады. Каталитикалық активтілігіне қарай оларды простетикалық топ немесе кофермент деп атайды. Мысалы: қыздыру және диализдау арқылы оңай ажыратылады . Ақуызды бөлігінде активті топ (феррон мен апофермент) бар. Олар каталитикалық активтілікті тез көтереді (жоғарлатады) . Өз кезегінде простетиалық топ және кофермент ақуыздың бөлігін тұрақтандырады да денатурирлеуші агент жасайды.
Активті орталықтан басқа тағы 2 орталық бар: субстратты және аллостерикалық. Бірінші фермент молекуласы субстратпен қосылады да ферментативтілікке ие болады. Ал екіншісінде фермент молекуласы төмен молекулалы заттармен байланысып, ақуыз молекуласының үшіншілік құрылысын өзгертеді. Бұл кезде каталитикалық активтілігі жоғарлайды немесе төмендейді.
1. 2. 2 Ферменттің активаторлары мен ингибиторлары
Фермент активтілігі ортада әр түрлі химялық заттардың болуына байланысты болады. Фермент активаторларына (кофактор) көптеген металл иондары жатады. Олардың әрекет етуі әртүрлі. Ферменттердің активаторлары простетикалық топ құрамына кіреді. Сөйтіп коферменттердің апоферменттерге байланысу қабілеттерін арттырғанда, аллостеритикалық орталықта байланысқанда ақуыз молекулаларының үшіншілік құрылысында өзгертеді. Соңында ферменттердің каталитикалық және субстраттың орталығында, олардың функциясы үшін тиімді конфигурация пайда болады.
Ингибирлеуші әрекеттің механизмі әр түрлі болады. Олардың өзара тежелуі 2 топқа бөлінеді:бәсекелестік және бәсекелессіз. Бәсекелесті тежелу ингибиторы субстратқа ұқсайды. Ол сондықтан ферменттердің орталығымен байланыс жасайды да, ферменттердің әсерін шектеп тастайды.
Амилолитикалық ферменттерден мысалы: а- амилаза калций ионымен активтеленеді. Ол пептид гидролаза әрекетін және денатурацияға фермент макромолекулаларының үшіншілік құрылысының тұрақтылығын жоғарлатады. Саңырауқұлақтарда а -амилаза әрекеттерінің тұрақтылығын алюминий ионы жасайды. Барлық екі амилаза металл иондарымен инактивирленеді- күміс, хлор, галоидты иондары, иод, бром, фтор және т. б бар.
Реакцияның соңғы өнімдері фермент ингибиторлары болып табылады.
Ферменттердің активтілігін анықтау үшін алдымен молекулалы және каталатикалық активтілігін білу керек. Бірінші молекулада бір каталитикалық орталық болады, екіншісінде фермент пен бірге бірнеше активті орталықтар бар. Активтілік бір минут аралығында моль санымен анықталады.
Ферменттер солодта, микробты культурада және әр түрлі фермент препараттарында болады. Олар бір дей активтілікке ие болмайды. Гидролитикалық реакцияда гомогенді катализаторларды қолдану мыс; өндіріске арналған қышқылдар үшін сутегі ионының активті концентратын білу керек. Фермент препаратын қолданған кезде биологиялық материалда, активтілік бірлігі бағаланады.
Спирт өндірісінде қанттандырушы материалдың амилолитикалық, декстриндік,, глюкоамилаздық, протеолитикалық, қанттандырушы және инвертазды активтілігі анықталады.
Амилолитикалық активтілігі (А. А) (солодта а-β амилаза әрекеті, фермент препаратында- тек қана а -амилаза) иодпен бірге жоғары молекулалы декстриндер және крахмал реакциясының түсінің өзгеруі анықталады. 1 м. е (АА) мынаны білдіреді. 1г таза солод, 1г құрғақ беттік микробты культура, бір сағат аралығында 30 ◦ с температурада 1 мл түптік културамен 1 г крахмалды түссіз декстринге дейін катализдейді.
Декстринді активтілік (ДА) соңғы декстринді гидролиздеумен сипатталады. Құрамында негізінен а 1, 6- глюказидті байланыс болады. Активтілік бірлігіне субстратты милиграмм түрінде қолданады. 1 мл фермент қоспасын немесе 1 г гидролизденген препарат бір сағ аралығында 30 ◦С температурада катализденеді.
Глюкоамилазды (мальтазалы) активтілік (ГлА ) крахмалды немесе мальтозада еритін фермент әрекетімен сипатталады. Глюкоамилазды ферментпен бірдей етіп, мальтоза немесе анықталған крахмалда катализденеді, ол бір сағат аралығында жүргізіледі.
Протеолитикалық активтілік (ПА) - ақуыздардың ажырауын протеаздан катализдейді. Фермент санына сәйкес протеолитикалық активтілік стандартты жағдайда 1г казеин гидролизін катализдейді.
1. 2. 3 Амилолитикалық ферменттердің механизмінің әрекеті
Гидролаза - катаболизм және аноболизм процесі сияқты, процесті катализдейді. Бірінші жағдайда процесс сумен байланысу арқылы тасымалданады, екіншісінде оның бөлінуі жүреді.
Экстераза - ферменті, күрделі эфир синтезін ыдыратушы реакцияны катализдейді. Мысалы: майларды (липазаларға), күрделі эфирлерді фосфор қышқылымен (фосфстазаға), нуклиотидтерді (нуклеотазаға) және тағыда ыдыратып катализдейді.
Карбогираза - ферменті, қант және глюкозид синтезінің гидролизін катализдейді. Карбогидраз -С-О-С- байланыспен байланысады. Карбогиразалар олигаза мен полиазаға бөлінеді.
Олигазаға α және β - глюкозидаза, α және β - галактозидаза, β - фруктофуранозидаза жатады.
Α - глюкозидаза гентиобиозбен целлобиоздың гидролизі. Сонымен қатар глюкозиттер (амигдолин, арбутин және т. б. ), α - галактозидаза - мелибоза гидролизі (раффинозадан тек қана галактозаны ұстап жарады (отципляет) және қант қалады, β-галактозидаза (лактаза) - лактозаның гидролизі, β - фруктофурананозидаза (сахароза, интерфаза) - сахароза мен гидролизиді. Соңында фруктозаны ұсақтап жарады және дисахарид мелибиоза қалады.
Крахмал гидролизін катализдеуші полиаза өндірістік белгісі амилаза ферментінде бар.
α -β амилаза тек қана α 1, 4 -глюкозитті байланысты ажыратып катализдейді. α - амилаза әрекетімен (кф 3. 2. 1. 1: Asp. oryae А - амилаза) байланыстар тәртіпсіз ажырайды. Соңында төмен молекулалы декстриндер (йодпен боялмайтын) аз ғана мөлшерде мальтоза мен олигосахаридтер пайда болады.
α - амилазаларды эндоген немесе декстрогенді амилаза деп те атайды.
β - амилаза әрекеті (кф 3. 2. 1. 2) амилозбен амилопектиннің соңғы байланысына бағытталады. Мұнда соңғы тізбектен бастап глюкозаның екі қалдығы (мальтозаға) жинайды. Бұл 1 суретте көрсетілген.
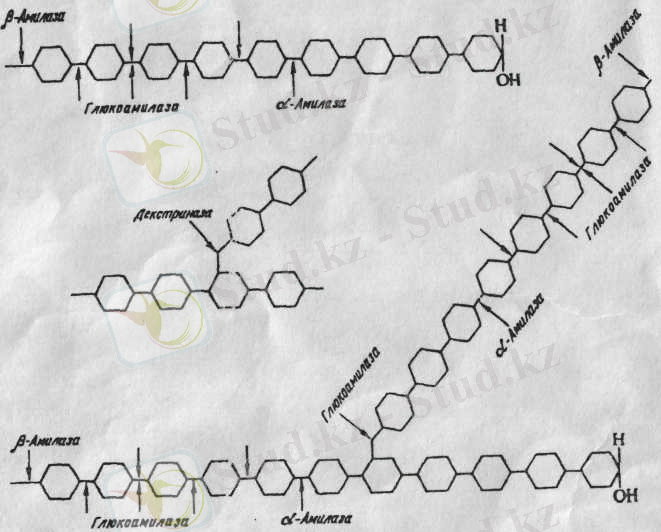
1 сурет- глюкозаның екі қалдығы (мальтозаға) жинайды
β - амилаза, амилозаны толығымен мальтозаға айналдырады, амилопектин тек қана 50-55% болады.
α және β амилаза әрекетінің соңында сахарид қоспасы пайда болады. Ол мальтозадан, аз ғана глюкозадан және төмен малекулалы декстриннен тұрады.
Бактериялар және микроскопиялық саңырауқұлақтарға β - амилаза жоқ, бірақ активті α - амилаза бар. α - амилазамен микроскопиялық саңырауқұлақтарды катализдегенде, яғни гиролиз алдында глюкоза мен мальтоза түзіледі. Бактериалды амилаз ортасында сахароген сияқты, декстрогенді заттар бар. алдымен крахмалды 60% гидролиздейді.
Амилозаны Bac. subtilis α - амилазаға гидролиздеу барысында алдымен СП 6 декстриндермен мальтотриоза түзіледі, ал процесс соңында глюкоза мен мальтоза (1:5, 45) түзіледі. Амилопектинді гидролиздеу барысында алдымен СП 6 декстриндер, ал соңында - глюкоза, мальтоза және сахаридтер түзіледі.
α - амилаза α - β - солод амилазасы сияқты шығу тегі микробты. α - 1, 6 - крахмалдың глюкозидті байланысын жауламайды.
Солод құрамында фермент бар. Олар α - 1, 6 глюзидті байланысты соңғы (шекті) декстриндерге дейін катализдейді. Мұнда фосфотаз түріндегі ферменттер бар деп есептейді. Себебі, амилопектинде картоп крахмалының фосфор қышқылы, күрделі эфирдің глюкоза қалдықтарымен байланысқан. Бірақ бұл дәл емес, шамамен күрделі эфир байланысы 6 және 1-ші глюкоза атомдарының қалдықтарымен пайда болады.
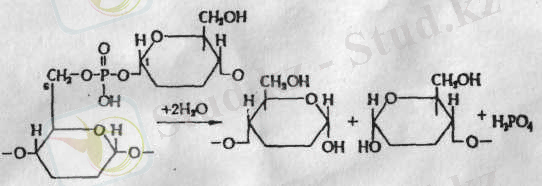
2 сурет- күрделі эфир байланысы 6 және 1-ші глюкоза атомдары
Декстриназа әрекетімен бұл фосфор қышқылын босатумен байланыс бұзылады.
Қорытындылай келе бұл фермент фосфотаза байланысы табылады. Бидай крахмаында фосфор олармен химиялық байланыспаған, бірақ бұл фермент α - 1, 6 глюкозитті байланысын ажыратып катализдейді.
Микробты ферменттерден крахмалды α - 1, 6 глюкозитті байланыспен ажыратып катализдеу яғни пллуланаза белгілі. Олар Aerobacter aerogenes бактериясынан табылған. Оған ферментпен крахмал солодын қосқанда толығымен гидролизденеді.
Глюкоамилаза (кф 3. 2. 1. 3 синоним - амилоглюкозидаза, γ - амилаза, така амилаза Б Asp. oryae) микроскопиялық саңырауқұлақтар құрамында бар. олар крахмалға, изомальтозаға және α - 1, 3 нигерозаға α - 1, 6 және 1, 4 глюкозитті байланысты ажыратып катализдейді. Бұл ферменттермен катализдегенде амилопектин мен амилоза соңында глюкоза қалдықтары қалады. Олар гидролиздің соңғы өнімі болып табылады.
Целлюлоза мен гемицелюлоза целлодекстриндер мен олигосахаридтерге дейін гидролизді катализдейді.
Пектиназа пектин заттарының гидролизін катализдейді. Пектиназа - фермент топтарын жинау деп табылады. Олардың негізгі үшеуі мыналар: ректинде күрделі эфир байланысының ажырауын катализдеуші пектинэстераза және басқа да полугалоктурониаза, пектинлиаза.
Протеаза (пептидгидролаза) полипептидтер және ақуыздарды ажырауын гидролитикалық катализдейді.
Ажырау байланысы -СО - NН -. Жай протеаза протеиназа және пептиназаға бөлінеді. Біріншісі ақуыздардың ажырауын катализдесе, екіншісі - полипептидтер мен дипептидтерді катализдейді. Мұндай протеиназалар папаин сияқты ақуыздағы пептидті байланыстармен қатар басқа да әртүрлі пептидтерді гидролиздейді.
Амилаза амидтердегі гидролизді катализдейді. Яғни уреаза - мочевинадан аммиакка дейін, көміртек диоксиді және су, аспарагиназа және глутаминаза - аспарагин және глутамин аммиакка дейін катализденеді.
1. 3 Микробтық фермент препаратын алу
Микоорганизмдер әртүрлі ферменттерді синтездеуге қабілетті. Қоректік орта құрамына және культивирлеу жағдайына байланысты, олар оңай бір фермент синтезін, келесі фермент синтезіне ауыстырып қосады. Жылына 100 деген астық алатын болса, микроорганизмдерде даму циклі (10 . . . 100 сағ) қысқа. Фермент продуценттері бактериялар, саңырауқұлақтар, ашытқылар және актиномицеттер болуы мүмкін. Өндірістік фермент препараттарын алу үшін микроорганизмдердің табиғи штамы қолданылады. Микроорганизмдер фермент комплексін бір уақытта синтездейді. Бірақ олардың кейбірі, әсіресе мутант штамы бір ферментті продуцирлейді.
Құрамында крахмалы бар шикізаттарды жақсарту үшін спирт өндірісінде қанттандырушы материалдар ретінде тек амилолитикалық ферменттер ғана емес, басқа да көмірсу шикізаттарын гидролиздеуші-целюлоза мен гемицелюлоза болуы керек. Ашытқыларда азотты қорекпен бірге протеолитикалық ферменттер де болуы қажет.
Қанттандыру процесі жақсы жүруі үшін фермент комплексі қажет. Микроорганизм продуцентін сұрыптау әлі де амилолитикалық ферменттердің (α-амилоза және глюкоамилазаның ) жоғарғы активтілігіне байланысты болады.
1. 3. 1 Ферменттің микроорганизм - продуценті
Спирт өндірісінде амилолитикалық фермент продуценті ретінде микроскопиялық саңырауқұлақтар қолданылады. Оларға: Asp. niger oryae, usamii, amamori, batatae, Rhizopus түрінне: delamar, tonkinensis, niveus, japonicum және т. б. жатады. Neurospora grassa және Mucor жеке штамдары да жатады.
Микроскопиялық саңырауқұлақтар табиғатта кеңінен таралған. Микроскопиялық саңырауқұлақтар көп түрлілігіне қарамастан барлығы қолданылады. Саңырауқұлақтардың денесін гифтер деп атайды. Олар қоректік субстраттың беткі жағында мицелия түзіп орналасады. Кейбір беткі қабатта орналасатын гифтердің құрлысы күрделі болады. Оларды кондида немесе спорангиеносцалар деп те атайды.
Бөлінген кондидалар мен споралар қолайлы ортаға түсіп дамиды. Олардың құрамында пигмент бар.
46 СУР микроскопиялық саңырауқұлақтардың морфологиясы көрсетілген. Спирт зауыттарында қанттандыру үшін көбнесе мынадай аспергил: Asp. oryzae және Asp. awamori - беттік культивирлеуде, Asp. awamori 466 және ВУД-Т2 - түптік культивирлеуде қолданылады. АҚШ спирт зауыттарында жоғары активті Asp. awamori NRRL- 3112 штамын қолданады.
Аспергиллус- аэрофилді типті. Сондықтан олар тек қана беттік қатты немесе сұйық ортададамиды. Ол үшін оптимальды температура 25-30◦ С, кейбіреуі 35◦С дейін өседі. Беттік культивирлеу кезінде саңырауқұлақтардың көпшілігінің температурасын аз ғана уақыт 40-45◦С дейін жоғарлатады. Олар үшін ортаның оптимальды ылғалдылығы 65 % болады.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz