Химиялық байланыс және донорлы-акцепторлы байланыстың түзілу механизмі


Қазақстан Республикасының Білім және Ғылым министерлігі
Қожа Ахмет Ясауи атындағы Халқаралық қазақ - түрік университеті
Факультет: Жаратылыстану
Кафедра: Экология және Химия
Пәні: «Бейорганикалық химия 2»
Оқу тәжірибесі
Тақырып: Химиялық байланыс. Донорлы-акцепторлы байланыстың түзілу механизмі.
Орындаған:
06В01512 мамандығының
1 курс студенті Шакаримова. Д. Д
Қабылдаған:
Техн. ғ. к ХҚТУ профессоры
Жылысбаева Гулхан
Түркістан - 2021
Жоспар:
- Химиялық байланыс туралы жалпы түсінік. (3 - 4. б)
- Донорлы-акцепторлы байланыстың түзілу механизмі (5. б)
- Донорлы-акцепторлы байланысқа мысалдар(6 - 8. б)
- Қорытынды ( 9. б)
- Пайдаланған әдебиеттер. (10. б)
Химиялық байланыс туралы ілім қазіргі кезеңдегі химияның негізі мәселелерінің бірі. Заттағы атомдардың әрекеттесу табиғатын білмейінше химиялық қосылыстардың түзілу механизімін, кұрамын, құрылысын, реакциялағыштық қабілетін түсіну қиын. Сондықтан химия ғылымының даму дәуірінде химиялық байланыс табиғатына зор көңіл бөлінеді.
Химиялық байланыстың табиғаты - химияның ең негізгі мәселелерінің бірі. Мүндағы негізгі сүрақ, не себептен атомдар бірігіп молекулалар түзеді? Атомдарды байланыстыратын күштің табиғаты қандай?
1852 жылы ағылшын ғалымы Франкланд химияға атомдылық деген түсінік енгізді. Көп кешікпей бұл түсінік валенттік деп аталды. Химияға валенттік туралы ұғымның енуі химияның ары қарай дамуына үлкен әсерін тигізді.
861 жылы орыстың ұлы ғалымы А. Н. Бутлеров заттардың химиялық құрылыс теориясын ұсынды. Химиялық құрылыс теориясы органикалық химия курсында қарастырылады. Бұл теорияның негізгі қағидалары:
1. Қай заттың болсын молекуласындағы атомдар бір-бірімен белгілі ретпен қосылысады.
2. Молекуланың құрамындағы атомдар өзді-өзі тікелей не болмаса басқа атом арқылы қосылысса да біріне-бірі әсер етеді.
3. Заттың қасиеті молекуладағы атомдардың қосылысу ретіне және олардың біріне-бірінің әсеріне, яғни химиялық құрылысына тәуелді.
4. Заттың химиялық қасиеттеріне сүйене отырып, оның молекуласының құрылысын анықтауға болады, керісінше, формуласы бойынша оның қасиеттерін болжауға болады.
Бутлеровтың құрылыс теориясы химиялық қосылыстардың сан түрлілігін және изомерия құбылыстарын түсіндіріп, молекуланың құрылысын анықтаудың нақты жолдарын көрсетті.
Кейінірек 1874 жылдары Голландия ғалымы Вант-Гофф пен Франция ғалымы Ло Бель Бутлеровтың құрылыс теориясын толықтыра түсті. Сонымен, ХІХ ғасырдың аяғында валенттілік күштерінің белгілі бір бағыты болатыны анықталды. Химиялық байланыс теориясы қосылыстардың әр түрлі қасиеттерін түсіндіреді. Екі бөлшектің электрон бұлттары бүркеліп, системаның толық энергиясы азайғанда болатын екі атомның әрекеттесуін химиялық байланыс дейді.
ВБ әдісі бойынша коваленттік байланыс қосылысатын атомдардың жалқы электронды орбитальдарының бүркесуі нәтижесінде жасалады. Жалқы электронды орбитальдар бүркескенде қосылушы екі атомның екеуіне де ортақ электрон жұбы түзіледі. Ортақ жұп қосылысатын атомдардың біреуінің қос электронды орбиталі екіншісінің бос орбиталімен бүркескенде де түзіледі. Бұның мысалы ретінде аммоний ионының түзілуін келтіруге болады:
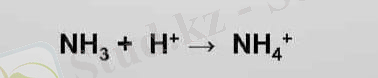
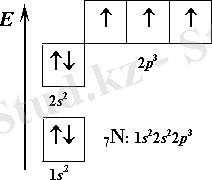
Аммоний ионы аммиак молекуласы сутек ионымен қосылысқанда түзілетіндіктен аммиак молекуласы мен сутек ионының электрондық құрылысын еске түсірейік. Аммиак молекуласы азот атомының (
 ) жалқы электронды 2p
x
, 2p
y
және 2p
z
орбитальдары үш сутек атомының 1s-орбитальдарымен бүркескенде түзіледі. Аммиак молекуласындағы азот атомының байланыс түзуге қатыспаған қос электронды 2s-орбиталі бар, Яғни пайдаланылмаған электрон жұбы бар, құрылысы мынадай:
) жалқы электронды 2p
x
, 2p
y
және 2p
z
орбитальдары үш сутек атомының 1s-орбитальдарымен бүркескенде түзіледі. Аммиак молекуласындағы азот атомының байланыс түзуге қатыспаған қос электронды 2s-орбиталі бар, Яғни пайдаланылмаған электрон жұбы бар, құрылысы мынадай:
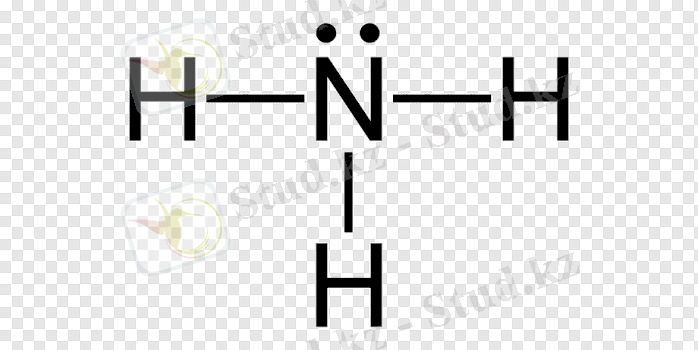
Сутек ионының 1s-орбиталі бос. Сутек катионының бос орбиталі аммиак молекуласындағы азот атомының қос электронды орбиталімен жұптасып, олардың арасында коваленттік байланыс түзіледі.
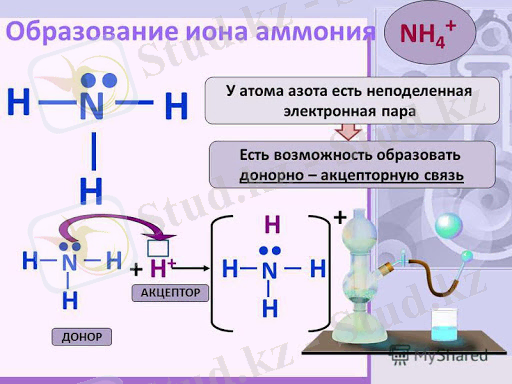
Сутек ионының алдындағы ұяшық сутек ионының бос орбиталі бар дегенді көрсетеді. Аммоний ионында төрт коваленттік байланыс бар: оның үшеуі жалқы электронды орбитальдардың, ал төртіншісі қос электронды орбиталь мен бос орбитальдың бүркесуі арқылы жасалған. Сонымен, аммоний ионындағы байланыстар әр түрлі жолдармен түзілген, бірақ олардың барлығының да беріктігі бірдей, бірінен-бірінің ешқандай айырмашылығы жоқ.
Бір атомның қос электронды орбиталі екінші атомның бос орбиталімен бүркескенде (жұптасқанда) түзілетін ковалентiк байланыс донорлы-акцепторлы, не болмаса координациялық байланыс деп те аталады. Байланыс түзуге қос электронды орбиталін, яғни электрон жұбын жүмсайтын атом донор деп, ал бос орбиталін жүмсайтын атом акцептор деп аталады. Менің мысалымыздағы донор - аммиак молекуласындағы азот, акцептор - сутек катионы.
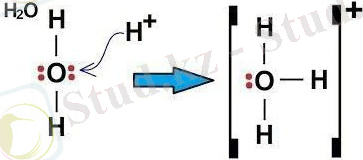
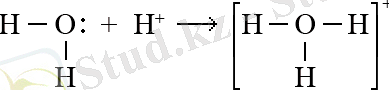
Дәл осындай оксоний ионының түзілуін мысал ретінде келтіруге болады:
Бор трифториді бор мен аммиактың қосылысуы да донорлы-акцепторлы байланыстың түзілуінен мысал болады.
BF 3 +NH 3 →F 3 BNH 3
↑
↑
↑
BF 3 молекуласы қозған күйдегі бор атомының (В*(
sp 2 - гибридті бұлттары (орбитальдары) фтор атомдарының
↑
↑↓
↑↓
↑↓
( F ) жалқы электронды 2p
z
орбитальдарымен
2p 2p
x
2p
y
2p
z
бүркескенде түзіледі. Сондықтан BF
3
молекуласындағы бор атомының бос орбиталі бар. BF
3
және NH
3
молекулалары бір-біріне жақындасқанда бор атомының бос орбиталі (2p
z
) азот атомының қос электронды орбиталімен жұптасып, донорлы - акцепторлы байланыс түзіледі:
:
BF 3 + :NH 3 → F 3 B NH 3 немесе F 3 B - NH 3
Бұл мысалымыздағы акцтептор - бор фториді молекуласындағы бор атомы да, донор - аммиак молекуласындағы азот атомы. Донорлы-акцепторлы байланыс комплексті қосылыстарда жиі кездеседі. Мысал ретінде кобальт катионы Со 3+ аммиак молекуласымен әрекеттескенде пайда болатын комплексті ионның [Co(NH 3 ) 6 ] 3+ түзілуін қарастырайық:
Со 3+ + 6NH 3 → [Co(NH 3 ) 6 ] 3+
Кобальт катионының кобальт атомынан Со-(3d 7 4s 2 ) үш электроны кем, сондықтан кобальт катионының валенттік қабатының электрон құрылысы мынадай:
↑
↑
↑
↑
↑↓
3d 4s 4p
Co +3 3d 6 4s 0 4p 0
Негізгі күйдегі кобальт катионының валенттік қауызында төрт бос орбиталь (бір “s” және үш "р” орбиталь) бар. Кобальт катионын қоздыру арқылы 3d-деңгейшесіндегі жалқы электрондарды өзара жүптастырып, бос орбитальдар санын алтыға дейін жоғарылатуға болады:
↑
↑
↑
↑
↑↓
3d 4s 4p
( Co +3 ) 3d 6 4s 0 4p 0 E
↑↓
↑↓
↑↓
3d 4s 4p
E( Co +3 ) *3d 6 4s 0 4p 0
Қозған күйдегі кобальт катионының алты: екі “d”, бiр “s” және үш “р” бос орбитальдары бар. Аталған бос орбитальдар азот атомдарының қос электронды орбитальдарымен бүркескендем комплексті катион [Co(NH 3 ) 6 ] 3+ түзіледі. Комплекстердің түзілуі негізінен донорлы-акцепторлы (координациялық) байланыс арқылы жүреді.
- Қорытынды:
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz