ЭДТА негізіндегі комплексонометрлік титрлеу және судың кермектігін анықтау


Жоспар
I Кіріспе
II Негізгі бөлім
2. 1. Комплексонометрлік титрлеу әдісінің негізі. Комплексондардың қасиеттері мен құрамы.
2. 2. Титрлеу қисығын тұрғызу.
2. 3. Комплексонометрлік титрлеу индикаторлары.
2. 4. Комплексонометрлік титрлеу әдісінің қолданылуы. Судың кермектілігін анықтау.
Қорытынды
Пайдаланылған әдебиеттер
Кіріспе
Комплексон деп кейбір органикалық реактивтермен комплексті қосылыстар түзетін иондар. Комплексонометрия комплексті қосылыстар түзетін иондарды анықтау реакцияларына негізделген. Комплексонометрлік титрлеу әдісінің сезімталдығы жоғары ( моль/ ), дәл, қарапайым және тез орындалады.
Комплексонометрлік титрлеу әдісінің негізі
Иондарды комплексондармен анықтағанда өте берік, суда жақсы еритін комплекстік қосылыстар түзіледі. Әдіс тездігімен және жоғарғы дәлдігімен ерекшеленеді.
Комплексондар дегеніміз аминополикарбон қышқылдарының туындылары болып табылады. Комплексонометрлік титрлеу әдісі бұрыннан белгілі. Алғаш иондарды бейорганикалық титранттарды қолдана отырып комплексонометрлік анықтаған.
Органикалық титранттар көп таралған, оларды комплексондар деп атаймыз. Келесі комплексондар кең таралған:
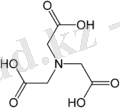
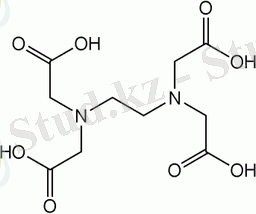

ONaa
NaO
Бұл қосылысты (кейде трилон Б деп аталатын) қысқартылған түрде Ү немесе ЭДТА деп атайды.
Олардың кешендерге қарағанда артықшылығы арнайылығында. Органикалық кешен түзушілерді қолданатын титриметрлік әдістерде эквивалент нүктесін металлохромдық индикаторлармен анықтайды.
Комплексонометрия реакцияларына қойылатын жалпы талаптар барлық титриметрлік әдістегілерге ұқсас:
- реакция қайтымсыз болуы кереол іс жүзінде соңына дейін жүретін болу керек;
- реакция қатаң эквиваленттік мөлшерде, жеткілікті түрде және жылдам жүруі қажет, өйткені баяу өтетін реакциялар кезінде эквиваленттік нүктені дәлме-дәл турақтандыру мүмкін емес;
- эквиваленттік нүкте дәл де оңай анықталуы қажет;
- титрлеу кезінде қосымша реакция жүрмеуі керек;
Негізгі бөлім
ЭДТА-ның құрамы, тұрақтылығы және жұмысшы ерітіндісін дайындау
Әртүрлі кешендердің саны бірнеше жүзге жетсе де "Комплексонометрия" және "хелатометрия" терминімен атағанда аналитикалық тәжірибеде кеңінен тараған қышқылының тұзымен, жиі "трилон Б немесе ЭДТА ( Ү*H₂O) деп аталатын оның қоснатрийлы тұзымен титрлеу реакциялары кең қолданылады.
қышқылы (ЭДТСҚ) төрт негізді болып табылады:
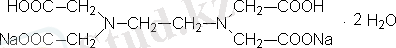
ЭДТСҚ- ның әртүрлі катиондармен әрекеттесу реакциясы мына теңдіктермен өтеді:
Ca 2+ + H 2 Y 2- = CaY 2- + 2H + ,
Bi 3+ + H 2 Y 2- = BiY - + 2H + ,
Zr 4+ + H 2 Y 2- = ZrY + 2H + .
Яғни катионның зарядына байланыссыз кешен түзілу реакциясына онымен бірге бір анион қатысады да, екі протонды ығыстырып шығарады. Титранттар және анықталатын катиондар эквиваленттерінің мольдік массалары олардың мольдік массаларына тең. ( f э =1) .
Қышқылдықтың әсері, әсіресе кешендерінің тұрақсыздық константасы аз катиондарды ( , ) титрегенде байқалады.
Магний, кальций және басқаларды тек сілтілік ортада титрлеуге болады. Көптеген катиондар аммиакты буферлі ерітіндіде титрленеді, , ) сияқты өте берік кешен түзетін катиондар қышқылдығы басым ерітіндіде титрленеді.
ЭДТСҚ-ның құрамы 6 функционалдық топ екі амин және төрт карбоксильдік, осыған орай хелат түзуші мүмкіндігі (алты дентатты лиганд) бар.
Екі валентті катионмен ЭДТА-ның ішкі кешенді қосылыс түзуі орынбасу арқылы өтеді, металл атомымен карбоксил тобының сутек атомы және бір уақытта аминотоптағы азот атомымен катион (координациялық байланыспен) әрекеттеседі.
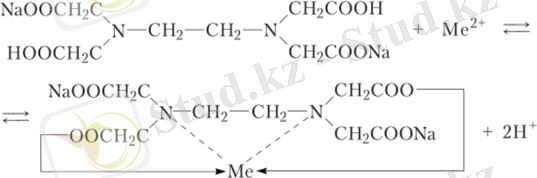
Мұнда сызықтармен жай байланыстар, ал бағдаршалы тілсызықпен (стрелкамен) координациялық байланыстар көрсетілген.
Кешенді қосылыстарға басқа тәсілдермен айналдыруы қиын сілтілік металдармен ( , ) комплексон III ішкі кешенді тұздар түзеді, сондықтан да химиялық талдауда кең қолданылады.
қышқылының қос натрийлы тұзы Ү*H₂O ерітіндісін комплексонометрлік титрлеуде жұмысшы ерітіндісі (титрант) ретінде қолданылады. Бұл тұз жақсы тазартылады, суда жақсы ериді, ерітіндісі уақытқа байланыссыз тұрақты. ЭДТА-ны мырыш тұзының ерітіндісі бойынша стандарттайды.
Әдетте комплексонометрлік титрлеу үшін 0, 01-0, 05 моль/л, сирек 0, 1 моль/л концентрациялы ерітінділері қолданылады.
Хелатометрлік титрлеу тәсілдері
ЭДТА-мен тікелей титрлеуді қалыпты әдіспен өткізеді: анықталатын катионы бар талданатын ерітіндіні титрлеуге арналған колбаға күяды, буферлік қоспа мен индикатор қосады да ЭДТА ерітіндісімен индикатор түсі өзгергенше титрлейді.
Кері титрлеу әдісін катионның ЭДТА-мен реакциясы жай жүргенде қолданады (мысалы, AI3+ ионымен), егер суда нашар еритін, бірақ ЭДТА-да еритін қосылыстарды талдағанда қажетті индикатор жоқ болса және басқа жағдайларда.
Талданатын ерітіндіге ЭДТА-ның стандартты ерітіндісінің артығымен өлшенген мөлшерін, содан соң буферлік қоспа және индикаторды қосамыз. ЭДТА-ның артық мөлшерін магний не мырыш сульфаты ерітіндісімен титрлейді.
Комплексонометриялық орынбасарды титрлеуді қалыпты әдіспен өткізеді. Талданатын ерітіндіге нің ЭДТА-мен түзетін кешенінен қосады (басқа кешендерге қарағанда ең түрақсыз кешен) . анықталатын катионмен ығыстырылады:
+ MgY 2- = + FeY
Бөлініп шыққан ЭДТА-мен титрленеді.
Y 2- Mg Y 2- +
Егер титрлегенде буферлік қоспа пайдаланылмаса, онда бұл жағдайда басқа вариантты ұсынады, металл тұзының бейтарап ерітіндісіне ЭДТА-ның артық мөлшерін қосады да бөлініп шыққан сутек иондарын (немесе гидроксоний) сілтінің стандартты ерітіндісімен титрлейді.
Титрлеу қисығын тұрғызу
ЭДТА катиондары әрекеттескенде екі протон бөлініп шығуына байланысты, оларды байланыстыру үшін талданатын ерітіндіге, әдетте, аммиак буферін немесе сілті қосады.
Титрлеу қисығын құру үшін, әдетте координаталар ретінде рМ шамасын және ЭДТА көлемін таңдайды. Есептеулер үшін α-коэффициентін пайдаланамыз, ол протондану бәсекелі реакциясын есепке алады:
Комплексонометриялық титрлеудің индикаторлары
Комплексометрияда титрлеудің соңғы нүктесі көзбен де, құралмен де анықталады. Титрдің соңғы нүктесі құрудың көрнекі әдісінде металл көрсеткіштері қолданылады. Металл көрсеткіштері - бұл металл ионының концентрациясына байланысты түсін өзгертетін қосылыстар. Әдетте бұл металл иондары бар түрлі түсті күрделі қосылыстар түзетін органикалық қосылыстар.
Металл көрсеткіштері екі топқа бөлінеді.
1-топ - индикаторлардың өздері боялмайды, бірақ металл иондары (салицил немесе сульфосалицил қышқылдары) бар түрлі түсті кешендер құрайды. Мұндай комплекстердің түс қарқындылығы онша үлкен болмағандықтан, титрленген металдың концентрациясы титрленген металдың концентрациясына қарағанда шамамен 10 есе көп болуы керек.
2-топ - олардың молекулаларында хромофор топтары бар органикалық қосылыстар, яғни түсті. Бұл қосылыстар металл иондары бар металл комплекстерін құрайды, олар индикаторлардан өзгеше болады. Мұндай көрсеткіштер металлхромды деп аталады. Молекулалардың құрылымына байланысты металлхромды көрсеткіштер 3 топқа бөлінеді:
1) құрамында азо тобы бар - N = N- (қара түсті эриохром, арсеназо III) ;
2) трифенилметанды бояғыштар (ксиленол апельсин, метилтимол көк) ;
3) басқалары (мурексид, дитизон, ализарин) .
Бұл индикатордың алғашқылары мурексид болды - пурпур қышқылының аммонийлі тұзы. Мурексидтің формуласын былай көрсетуге болады:
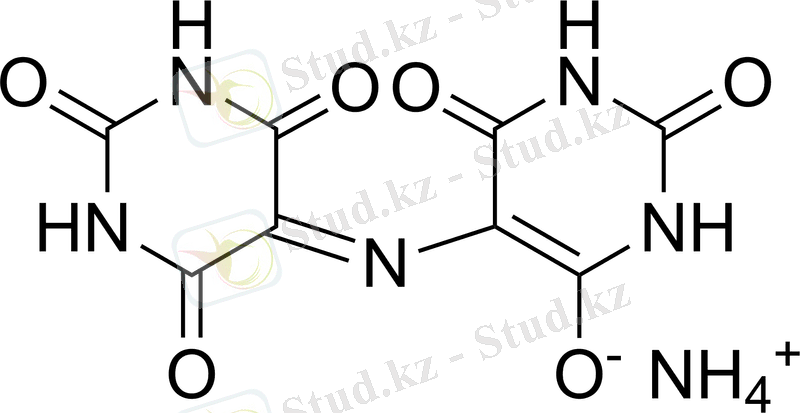
Кальций тұздарымен сарғыш-қызыл түсті кальций пурпуреаты түзіледі. Пурпур қышқылы үш негізді оның константалары: pK1=0; pK2=9, 2 және pK3=10, 9. 0, 1M пурпуреат аммонийдің сулы ерітінділері 12-15 күнде ыдырайды. рН өскен сайын ыдырау жылдамдығы артады. Ерітінділердің тұрақсыздығына байланысты, оларды талдаудың алдында ғана даярлайды. Мурексид сынамасын өлшеу ыңғайлы болу үшін оны натрий хлоридімен араластырады, талданатын ерітіндіде оның концентрациясы жоғары болмауы қажет, себебі бұл индикатордың түсі ауысу анықтығы жағдайда нашарлайды. Мурексид ерітіңдісіндегі тепе-теңдікті сызбанұсқа түрінде жазамыз.

Co2+, Ni2+, Сu2+ сары түсті комплекстер түзеді және оларды индикатор түсі сарыдан көгілдір өткенше аммиакты ортада комплексонмен титрлейді.
Реакцияны жылдамдату үшін титрлеуді жоғары температурада (=40°C) жүргізеді. Металдың мурексидпен комплекстердің құрамы ерітіндінің рН-на байланысты. Мысалы, мырыш әлсіз сілтілік ортада 1: 1 комплексін, ал сілтілік ортада 1:2 (Znlnd2) түзеді.
Комплексонометрияда эриохром қара Т-ны кеңінен қолданады (арнайы хромоген қара ET=00), бұл азобояғыш және оның молекуласында хелат түзуші топтар бар:
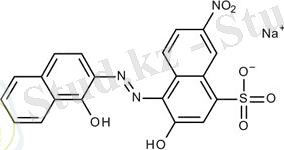
Сульфатоптың протоны ерітіндіде толық диссоциацияланады, ОН тобынан протондардың әрі қарай үзілуі индикатор түсінің өзгеруіне алып келеді, ол ерітіндінің рН-на тәуелді:

Аммиакты ерітіндіде басым анион металл иондарымен әрекеттеседі де қызыл немесе күлгін түсті бояулы қосылыс түзеді.
Эриохром қарамен боялған қосылысты 20 әртүрлі катиондардың түзуіне қарамастан, комплексонометриялық әдіспен титрлегенде тек жеке катиондар ғана ашылады, себебі кейбір жағдайларда реакция жай жүреді.
Бұл индикатормен тәжірибеде тек қана магний, кадмий, мырыш, қорғасын және басқаларды титрлейді.
Эриохром қара Т-ның сулы ерітінділері және сақтағанда ыдырайды. Оған жақын аналогы- кальмагиттің ерітіндісі әлде қайда тұрақты. Оның молекуласының құрамында -NO2 тобы жоқ, ал олардың индикаторлық қасиеттері бірдей.
Комплексонометрлік титрлеу үшін қышқыл хромоген көк және қышқыл хромоген қою көк индикаторлары ұсынылған. Олар кальций және магний иондарымен сарғыш қызыл түсті комплекс ішілік қосылыстар түзеді және оларды титриметриялық анықтау үшін қолданады.
Қышқыл ортада олар сарғыш қызыл, ал сілтілік ортада көгілдір сұрлау. Индикаторлар сүрыпталмайды, себебі көптеген металл иондарымен босылыстар береді.
Ацетатты буферлік ортада мыс, мырыш, қорғасын, никель, марганецті титрлеу үшін 4-(2-пиридиазо) - резорцин-ПАР қолданылады. Комплекс қызыл түске, ал бос индикатор сарыға боялған.
Комплексонометрлік анықтау үшін индикатор ретінде кейбір трифенилметандық бояғыштарды қолданады: Көптеген катиондарды (Zr++, Th++ Bi3+ Fe3+ және басқалар) ксиленолды сарғыш қызыл, металфталеин, метилтимолды көк, пирокатехинді күлгін бар болғанда титрлейді.
Комплексонометрияда сондай-ақ арнайы реактивтерді қолданады, олар талданатын иондармен боялған қосылыстар түзеді, мысалы, сульфосалицил қышқылы немесе Fe3+ үшін тиоцианат, үшін тиомочевина және басқалар.
Қорытынды
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz