Судың молекулалық құрылысы және физикалық-химиялық қасиеттері


Қазақстан Республикасы Білім және Ғылым министрлігі
Е. А. Бөкетов атындағы Қарағанды мемлекеттік университеті
Химия факультеті
Органикалық химия және полимерлер кафедрасы
Реферат
Тақырыбы:Су құрылымы және физикалық, химиялық қасиеттері
Орындаған ТФП-116 топ студенті Калымбетова Аружан
Тексерген: Сағынтаева Акмаржан Дарханқызы
Қарағанды, 2022
Қарағанды, 2022
Мазмұны
I. Кіріспе
II. Негізгі бөлім
2. 1. Су құрылымы
III. Судың қасиеттері
3. 1. Физикалық қасиеті
3. 2. Химиялық қасиеті
VI. Қорытынды
Пайдаланылған әдебиеттер тізімі
Кіріспе

Су - таныс және әдеттен тыс зат. Белгілі кеңес ғалымы академик И. В. Петрянов су туралы өзінің ғылыми-көпшілікке толы кітабын «Әлемдегі ең ерекше зат» деп атады.
Ал биология ғылымдарының докторы Б. Ф. Сергеев «Көңілді физиология» атты кітабын су туралы тарау - «Біздің планетаны жаратқан зат» деп бастады. Ғалымдар дұрыс айтады: жер бетінде біз үшін кәдімгі судан маңызды бірде-бір зат жоқ және сонымен бірге қасиеттерінде оның қасиеттеріндегідей көптеген қарама-қайшылықтар мен ауытқулар болатын бір текті зат жоқ.
Су - сутегі мен оттегінің қалыпты жағдайларда тұрақтылығын сақтайтын қарапайым химиялық қосылыс. Ауыз су, тіршілік көзі, ол Жер шарының 3 / 4 бөлігін алады, тірі ағзалардың 60-70%-ы, ал өсімдіктердің 90 % -ы судан тұрады. Қатты су - қар мен мұз - жердің 20%-ын алып жатыр.
Су тек гидросферада ғана емес, жер литосферасында, атмосферада, биосферасында тараған. Жер шарында тіршілік ең алғаш сулы ортада пайда болды. Су - бүкіл тіршілік иелерінің негізгі құрамдас бөлігі. Бұдан басқа судың тіршілік үшін физикалық-химиялық қасиеттердің: жоғары жылу өткізгіштік және жылу сыйымдылық, жоғары тығыздық, ауа тығыздығының шамамен 800 есе артуы, мөлдірлік, тұтқырлық, қатқан кезде мұздың көлемін ұлғайтуы және тағы басқа қолайлы қасиеттері болады.
Біржасушалы және көпжасушалы ағзалар жасушаларының биохимиялық үдерістерінің барлығы сулы ортада өтеді. Су әр түрлі климаттық жағдайлардағы физиологиялық үдерістердің қалыпты өтуіне себепкер болады. Ол сондай-ақ көптеген минералдық және ағзалық заттардың жақсы еруіне себепкер бола алады. Табиғи су құрамында сан алуан тұздың болатыны да сондықтан. Ағзалар жұғымды заттарды тек еріген түрінде сіңіреді.
Табиғи су құрамындаәр түрлі еріген тұздар, қоспалар болады. Тұрмысқа пайдалану үшін оны түрлі әдістермен тазартады, хлорлап залалсыздандырады. Химияда, лабораторияда қолданылатын суды қайта айдайды. Сонымен қатар, су өнеркәсіпте өте қажет шикізат болып табылады. Одан сутегін, оттегін алады, ол өте жақсы еріткіш. Одан әртүрлі қышқыл, тұз, сусындар даярлайды. Жер бетінде жүріп жатқан процестер, оның ішінде биохимиялық процестер суда не су ерітінділерінде жүреді. Өсімдік өсу үшін су қажет. Ол өзіне қажет қоректік затты топырақтан судағы ерітінді түрінде сіңіреді. Ауыл шаруашылығы дақылдарынан мол өнім алу үшін топырақ ылғалдылығын дұрыс пайдалану керек. Ол үшін әр түрлі агротехникалық, гидромелиорация шаралары.
Су құрылымы
Егер біз осы көрсеткіштерді қарастыратын болсақ, онда бұл таңғажайып зат көрсететін қасиеттер бірден анық болады. Сонымен, су молекуласы екі сутегі атомынан және бір оттегі атомынан тұрады, сондықтан оның эмпирикалық формуласы H2O болады. Сонымен қатар, екі элементтің электрондары молекуланың өзін құруда маңызды рөл атқарады. Судың құрылысы және оның қасиеттері қандай екенін білеміз.
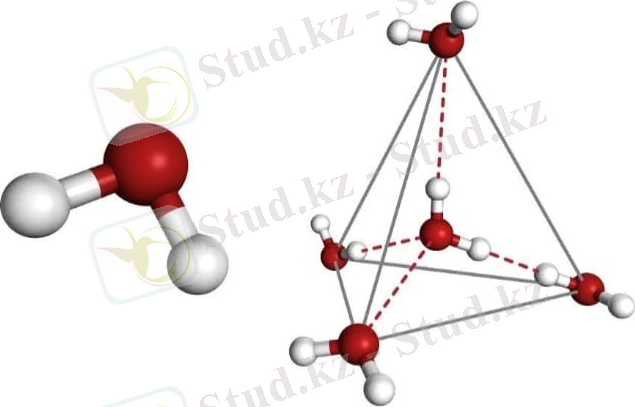
Әлбетте, әрбір молекула бір-біріне бағытталған және олар бірге ортақ кристалдық торды құрайды. Бір қызығы, оксид тетраэдр түрінде - орталықта оттегі атомы, ал оның екі жұп электроны мен екі сутегі атомы асимметриялы түрде салынған. Егер сіз атомдар ядроларының орталықтары арқылы сызықтар жүргізіп, оларды байланыстырсаңыз, онда сіз дәл тетраэдрлік геометриялық пішінді аласыз.
Оттегі атомының центрі мен сутегі ядроларының арасындағы бұрыш 104, 5 0С. O-H байланысының ұзындығы = 0, 0957 нм. Оттегі электронды жұптарының болуы, сондай-ақ оның сутегімен салыстырғанда жоғарырақ электронға жақындығы молекулада теріс зарядталған өрістің пайда болуын қамтамасыз етеді. Керісінше, сутегі ядролары қосылыстың оң зарядталған бөлігін құрайды. Осылайша, су молекуласы диполь болып табылады. Бұл судың қандай болуы мүмкін екенін анықтайды және оның физикалық қасиеттері де молекуланың құрылымына байланысты. Тірі тіршілік иелері үшін бұл ерекшеліктер маңызды рөл атқарады.
Судың молекулалық құрылымы ерекше. Таңғажайып түрде бұл жерде үйлесімсіз нәрсе біріктірілген: сұйық заттың қозғалғыштығы және біз мұз деп атайтын күшті кристалды материал. Әрине, молекулалар агрегацияның әртүрлі күйінде өзгереді: газ тәрізді, қатты және сұйық. Ол планетадағы барлық тіршілікке және біздің өміріміздің сапасына маңызды әсер етеді.
Коваленттік байланыстың негізгі сипаттамалары бағыттылық, қанығу, полярлық, полярлану сияқты ұғымдармен өрнектеледі. Бұл параметрлер қосылыстардың химиялық және физикалық қасиеттері болып табылады. Су молекуласының пішіні негізінде екі сутегі атомы (әр бұрышта бір атом) бар тең қабырғалы үшбұрышқа ұқсайды. Оттегі мен сутегі атомдарының арасында полярлық байланыс байқалады, бұл оттегінің электрондарды күштірек тарту қасиетімен түсіндіріледі (сутегімен салыстырғанда) .
Ядроаралық O-H арақашықтығы 0, 1 нм-ге жақын, сутегі атомдарының ядроларының арақашықтығы 0, 15 нм, Н-О-Н байланыстары арасындағы бұрыш - 104, 5°.
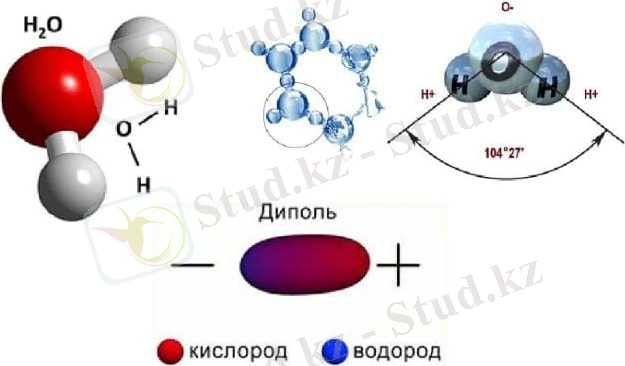
Судың молекулалық құрылымы екі оң және екі теріс зарядталған полюстердің болуын білдіреді, бұл оның диполь ретіндегі көрінісін түсіндіре алады (көп жағдайда) . Атомдардағы тиімді зарядтардың көрсеткіштері электрон зарядының ±0, 17-ге тең.
Сонымен қатар сутектік байланыс судың заттарды еріту қабілетіне тікелей әсер етеді, өйткені ерігіштік сипаттамалары сутегі байланыстарының еріткішпен байланысуына байланысты. Бұл сутектік байланыстардың құрамында ОН топтары бар заттармен (қант, глюкоза, спирт, карбон қышқылдары) әрекеттесуі олардың суда еруінің тамаша деңгейін түсіндіре алады.
Димер - екі H2O молекуласы арасындағы сутектік байланыс.
Әрбір молекуланың төрт сутегі байланысын құру мүмкіндігі бар: екеуі оның оттегі атомының жалғыз жұптары мен көрші молекулалардың сутегі атомдары арасында және тағы екеуі көршілес екі молекуланың сутегі атомдары мен оттегі атомдары арасында.
Сутегі байланысының энергия шектері 17-ден 33 кДж/мольге дейін өзгеруі мүмкін.
Судың бірнеше күйлері бар:
Сұйықтық. Қалыпты жағдайдағы негізгі жағдай.
Қатты. Бұл мұз, сонымен қатар кристалдар түрінде - аяз немесе қар.
Газ тәрізді - су буы.
Судың көптеген биологиялық қасиеттері оның құрылымымен, яғни сұйық күйдегі мономерлі (дара) және байланысты (топтық) су молекулаларының қатынасымен анықталады.
Ионизация. Су молекулаларының диссоциациялануы нәтижесінде сутегі иондары (Н+) және гидроксил иондары (ОН) түзіледі. 25 °C температурада таза судағы сутегі немесе гидроксид иондарының концентрациясы 1 ∙ 10-7 моль/л, бұл рН 7-ге сәйкес келеді.
Құрылымдық су - бұл
Бұл молекулалық құрылымы, кристалдық торларының орналасуы (мұзда байқалатын сияқты) сәл өзгеше су, бірақ ол әлі де сұйық (еріту де осы түрге жатады) . Бұл жағдайда судың құрамы мен оның қасиеттері, ғылыми тұрғыдан алғанда, кәдімгі сутегі оксидіне тән қасиеттерден ерекшеленбейді. Сондықтан құрылымдық су эзотериктер мен балама медицинаны жақтаушыларға жатқызатындай кең емдік әсерге ие бола алмайды.
Судың физикалық қасиеті
Таза су - түссіз, иіссіз, дәмсіз сұйықтық. Судың қабаты 5 м асқанда көгілдір түсті болып көрінеді.
Қалыпты қысымда 100°С-та қайнайды да, 0°С-да мұзға (р=0, 92 г/см3) айналады, сондықтан мұз су бетінде қалқып жүреді. Сонда оның көлемі 9 %-ға артады. Судың беткі қабатының мұзбен қапталып жатуы ондағы тіршілік иелерінің қыс мезгілінде де өмір сүруіне жағдай жасайды.
Температурасы 4°С болғанда, тығыздығы 1г/см3 (судың ерекшелігі) . Судың жылу сыйымдылығы өте жоғары, оны мына мысалмен түсіндірейік. Жаздың аптап ыстық күндерінде су жылуды сіңіріп, өзеннің маңайын салқындатып тұрады, сондықтан адамдар оның жағалауына дем алуға көптеп барады.
Осылайша жиналған жылуды су қыс мезгілінде біртіндеп ауаға береді, сондықтан қатты аязды күндерде өзеннің беті тұманданып тұратынын сендер сан дүркін кердіңдер. Су жер бетінен тараған жылудың 60%-ын ұстап қалып, оны суынудан сақтап тұрады. Табиғи сулар әдетте таза болмайды, онда еритін және ерімейтін заттардың қоспалары болады. Теңіз суында еріген тұздар кептеп кездессе, (3, 5 %) ағын және жер асты суларында кальций мен магний тұздары болады, ал жауын мен еріген қар суларында көбінесе шаң мен еріген күйдегі газдар (02, N2, С02, S02, т. б) кездеседі.
Су - сутек оксиді, Н2О - қалыпты жағдайда сутек пен оттек 1:8 көлемдік қатынаста болатын тұрақты қарапайым химия қосылыс. Табиғатта ең көп таралған, бүкіл гидросфера Судан тұрады, Судың тіршілік үшін маңызы өте зор. Аристотель өз еңбектерінде (біздің заманымыздан IV ғасыр) Суды төрт құбылыстың (от, ауа, топырақ, су) біріне жатқызса, ғалымдар XVIII ғасырдың аяғына дейін Суды жеке элемент ретінде қарастырды.
Суды алғаш ағылшын ғалымы Г. Кавендиш (1731-1810) зерттеді (1781-1782), ал француз ғалымы А. Лавуазье (1743-1794) сутек жанғанда Су түзілетінін дәлелдеп (1783), Ж. Млньемен бірге сандық құрамын анықтады (1785) .
Судың құрамында массасы бойынша 11, 19 % сутек, 88, 81 % оттек болады; молекуласы 2 атом сутек пен 1 атом оттектен тұрады, молек. м. 18, 0160, иіссіз, дәмсіз, түссіз (терең жері көгілдір) сұйықтық. Құрамында 2Н (дейтрий) бар Су - ауыр су (D2O) деп аталады. ауыр судың физиқалық қасиеттері өзгешелеу болады. Су 0С-та қатып, 100С-та қайнайды.
20 °С-тағы тығыздығы 0, 99823 г/см3,
0 °С-тағы тығыздығы 0, 9168 г/см3 (мұзда) .
Судың физиқалық қасиеттерінде, балқу жылуында, меншікті жылу сыйымдылығында, тұтқырлығында, жылу өткізгіштігінде ерекшеліктер бар. Мысалы:, мұз жеңіл болғандықтан Суда қалқып өзендер мен көлдердің түбіндегі тіршілік сақталады. Су қалыпты температурада көптеген заттармен әрекеттеседі. Сілтілік және сілтілік-жер металдармен әрекеттескенде гидроксид пен сутек түзеді (2Na+2H2O=2NaOH+H2↑) . Су әр түрлі жағдайда бейметалдармен (фтор, хлор, бром, фосфор, көміртек) әрекеттесіп, қышқылдар (HCl, HClO, HPO3, HF, HBr) және оксид (СО) түзеді.
Атмосферада Су бу, тұман, бұлт, тамшы және қар кристалдары түрінде кездеседі. Су оттек, сутек, азот қышқылын, спирт, альдегидтер, сілтілер, т. б. аса маңызды химиялық өнімдерді өндіруде қолданылатын химиялық реагентер. Оның катализатор ретінде маңызы зор.
Жылу сыйымдылығы. Судың жылу сыйымдылығының мәні (яғни температураны 1 ° C-қа көтеру үшін қажет жылу мөлшері) басқа заттарға қарағанда 5-30 есе жоғары. Тек сутегі мен аммиактың жылу сыйымдылығы жоғары. Сонымен қатар, тек сұйық су мен сынап үшін меншікті жылу сыйымдылығы температура 0-ден 35 ° C-қа дейін жоғарылағанда төмендейді (кейін өсе бастайды) . Құмның жылу сыйымдылығы сұйық судан 5 есе аз болғандықтан, күннің бірдей қыздыруымен су қоймасындағы су жағадағы құмға қарағанда 5 есе әлсіз қызады, бірақ жылуды бірдей мөлшерде ұзақ сақтайды. . Судың жоғары жылу сыйымдылығы өсімдіктерді жоғары ауа температурасында температураның күрт көтерілуінен сақтайды, ал буланудың жоғары жылуы өсімдіктерде терморегуляцияға қатысады.
Жоғары балқу және қайнау температуралары, жоғары жылу сыйымдылығы көрші молекулалар арасындағы күшті тартылысты көрсетеді, нәтижесінде сұйық су үлкен ішкі когезияға ие.
Беттік керілу және адгезия. Су бетінде оның молекулаларының компенсацияланбаған адгезиясы (конгезиясы) салдарынан беттік керілу пайда болады. Судың адгезия (жабысу) қасиеті де бар, ол тартылыс күштеріне қарсы көтерілгенде кездеседі. Капиллярларда шекаралық қабаттағы су молекулаларының ауамен жабысу күштері оның капилляр қабырғаларының материалына адгезиясымен біріктіріледі. Нәтижесінде капиллярда бастапқы деңгейден жоғары судың ойыс беті пайда болады.
Негізгі физикалық қасиетері
Оларға кристалдық тор, қайнау және балқу температуралары және ерекше жеке сипаттамалар жатады. Біз олардың барлығын қарастырамыз.
Сутегі оксидінің кристалдық торының құрылымы агрегация күйіне байланысты. Ол қалыпты жағдайда қатты - мұз, сұйық - негізді су, судың температурасы 100 0С жоғары көтерілгенде газ тәрізді - бу болуы мүмкін. Әдемі өрнекті кристалдар мұздан қалыптасады. Тор тұтастай бос, бірақ байланыс өте күшті, тығыздығы төмен. Оны снежинкалардың немесе шыныдағы аязды үлгілердің мысалында көруге болады. Кәдімгі суда тордың тұрақты пішіні болмайды, ол өзгереді және бір күйден екінші күйге өтеді.
Ғарыштағы су молекуласы доптың дұрыс пішініне ие. Бірақ жердің тартылыс күшінің әсерінен ол бұрмаланып, сұйық күйде ыдыс пішініне ие болады.
Сутегі оксидінің құрылымының диполь болуы келесі қасиеттерді анықтайды: жоғары жылуөткізгіштік пен жылу сыйымдылығы, оны затты тез қыздыру және ұзақ салқындату кезінде байқауға болады, иондарды да, жеке электрондарды да айнала бағдарлау қабілеті, қосылыстар. Бұл суды әмбебап еріткіш етеді (полярлық және бейтарап) .
Судың құрамы мен молекуласының құрылымы бұл қосылыстың көптеген сутегі байланыстарын, соның ішінде ортақ емес электрон жұптары бар басқа қосылыстармен (аммиак, спирт және т. б. ) түзу қабілетін түсіндіреді.
Сұйық судың қайнау температурасы 1000С, кристалдану +40С-та жүреді. Бұл көрсеткіштің астында - мұз. Қысымды арттырсаңыз, судың қайнау температурасы күрт көтеріледі. Сонымен, жоғары атмосферада онда қорғасынды балқытуға болады, бірақ сонымен бірге ол тіпті қайнамайды (3000С жоғары) .
Судың қасиеттері тірі ағзалар үшін өте маңызды. Мысалы, ең маңыздыларының бірі - беттік керілу. Бұл сутегі оксидінің бетінде ең жұқа қорғаныс қабықшасының пайда болуы. Біз сұйық су туралы айтып отырмыз. Бұл пленканы механикалық әсермен бұзу өте қиын. Ғалымдар оған 100 тонна салмаққа тең күш қажет екенін анықтады. Оны қалай байқауға болады? Су краннан баяу тамшылағанда пленка айқын көрінеді. Белгілі бір шек пен салмаққа дейін созылып, тартылыс күші әсерінен аздап бұрмаланған дөңгелек тамшы түрінде шығып жатқан қандай да бір қабықшаға ұқсайтынын байқауға болады. Беттік керілу әсерінен көптеген заттар су бетінде қалқып жүре алады. Арнайы бейімделген жәндіктер оның бойымен еркін қозғала алады.
Су және оның қасиеттері аномальды және ерекше. Органолептикалық көрсеткіштері бойынша бұл қосылыс түссіз, иіссіз және дәмсіз сұйықтық болып табылады. Судың дәмі деп оның құрамында еріген минералдар мен басқа компоненттерді айтамыз.
Сутегі оксидінің сұйық күйдегі электр өткізгіштігі онда қанша және қандай тұздар ерігеніне байланысты. Құрамында ешқандай қоспасы жоқ тазартылған су электр тогын өткізбейді.
Климатқа және организмдердің тіршілік әрекетіне әсер ететін планетаның қалыпты өмір сүруін қамтамасыз ететін су. Бірақ бұл зат шын мәнінде бірегей. Өмірді қамтамасыз ететін судың осы таңғажайып қасиеттері. Мысалы, мұз бен судың тығыздығын алайық. Көп жағдайда мұздату кезінде заттардың молекулалары бір-біріне жақындайды, олардың құрылымы жинақы және тығыз болады. Бірақ бұл схема сумен жұмыс істемейді.
Бұл таңғажайып қасиетті Галилео алғаш рет сипаттаған. Температураны баяу төмендетіп, судың қатуын бақылап отырсаңыз, алдымен схема өте стандартты болады - зат тығыз және ықшам болады. Температура +4 градусқа жеткеннен кейін өзгерістер болады. Осы қарқынмен су кенет жеңілдей түседі. Сондықтан мұз су бетінде қалқып жүреді, бірақ батпайды. Айтпақшы, бұл қасиет су флорасы мен фаунасының өмір сүруін қамтамасыз етеді - су сирек толығымен қатып, оның тұрғындарын тірі қалдырады.
Айтпақшы, мұздату кезінде зат шамамен 9% кеңейеді. Судың бұл қасиеті тау жыныстарының табиғи коррозиясын тудырады. Екінші жағынан, күтпеген жерден суыған кезде су құбырларының жарылуы да осыдан. Бірақ бұл судың барлық қызықты қасиеттері емес. Тағы бір ерекше ерекшелігі - оның аномальды жоғары жылу сыйымдылығы. Мысалы, бір грамм суды бір градусқа қыздыру үшін қажет жылу мөлшері шамамен 10 г мысты немесе 9 г темірді қыздыруға жеткілікті.
Бүкіл дүниежүзілік мұхит күнделікті және жылдық температура ауытқуларын тегістейтін жаһандық термостат. Айтпақшы, сол қасиеттер атмосферада болатын су буымен де берілген. Жасыратыны жоқ, шөл температураның күрт өзгеруімен сипатталады - ол күндіз тым ыстық, ал түнде өте суық. Бұл құрғақ ауаға және су буының қажетті мөлшерінің болмауына байланысты
Химиялық қасиеті
Сутек пен оттектің химиялық қосылысы.
Массалық құрамы: Н -11, 19 %, О - 88, 81 %.
Молекулалық массасы 18, 0153. Су планетамыздағы ең көп тараған заттардың бірі; ол үш түрде - бу, су және мұз күйінде ұшырасады; күшті еріткіш.
Су айдауыш мұнара- елді мекендерді сумен қамтамасыз ету жүйесіндегі су өтімі (шығыны) мен қысымын реттеп отыруға арналған құрылыс. Ол цилиндр тәрізді етіп арнайы болаттан немесе темір-бетоннан жасалған шаннан және оны көтеріп тұратын тіреуіш құрылымнан тұрады. Мұнараның биіктігі 25-30 м-ге, шанының сыйымдылығы ондаған текшелерге жетеді. Тіреуіш кірпіш не ағаштан жасалады. Шан ішіндегі судың қыста катып қалмауы және ластанбауы үшін ол жылу өткізгіштігі төмен жеңіл материалдармен қапталып, үсті шатырмен жабылады
Судың сапалық құрамы сутек пен оттектен тұратыны, ал сандық құрамы екі сутек атомы мен бір оттек атомынан тұратындығы мәлім.
Судың айырылуы электр тогының әсерінен жүреді, бұл реакциямен сендер сутекті алу әдісі бойынша таныссыңдар:
2H2O→2H2↑+O2↑
Күрделі заттың құрамдас бөліктеріне айырылуы - анализ деп аталады.
Жай заттармен әрекеттесуі:
I. Судың металдармен әрекеттесу реакцияларын сутегін ал әдістерінде қарастырған болатынбыз:
2Na + 2НОН = 2NaOH + Н2↑
Са + 2НОН = Са(ОН) 2+ Н2↑
Белсенділігі тым жоғары емес металл сумен әрекеттескенде оның оксиді түзіледі:
Mg + НОН = MgO + H2
Белсенділігі төмен металдар сумен әрекеттеспейді.
I. Бейметалдармен әрекеттесуі: Су кейбір бейметалдармен де әрекеттесе алады. Қыздырға көмірге су қоссақ екі түрлі газ қоспасы түзіледі - ол «су газы» деп аталады:
С + НОН=СО↑+Н2↑
Көмірді жағарда оған су қосып шылайтынын білесіңдер, сонда түзілген екі газ да жанғыш екен. Хлорды суға жібергенде екі қышқылдың қоспасы түзіледі.
Сl2 + НОН = НСlO + HCl
Күрделі заттармен әрекеттесуі:
I. Активті металдардың оксидтерімен әрекеттесіп гидроксидтер (негіздер) түзеді.
Na20 + Н20 = 2NaOH
Әктасқа су қосқанда оның қайнай бастағанын көреміз, реакция жылу бөле жүреді: СаО + Н20 Са (ОН) 2 + Q
Металл оксидтері + су = негіз
II. Кейбір бейметалдардың оксидтері сумен әрекеттескенде қышқыл түзеді. Күкірттің бір түйірін алып жақсак оның оксиді түзіледі:
S + O2 =SO2
Жану өнімін суға жіберсек: S02 + Н20 = H2S03 күкіртті қышқыл түзіледі, көк лакмус қызарады. Дәл осындай реакциялар басқа бейметалдардың да оксидтерімен жүреді. Сl20 + H20 = 2HCl0 N2O3 + H20 = 2HN02
Бейметалл оксидтері + су = қышқыл
III. Белсенділігі жоғары металдардың гидридтері де сумен әрекеттесіп гидроксидтер береді.
NaH + НОН = NaOH + Н2↑
IV. Кейбір тұздар сумен химиялық әрекеттесіп кристаллогидраттар түзеді:
CuS04 + 5H20 = CuS04 * 5H20 мыс купоросы;
FeS04 * 7H20 темір купоросы;
Na2S04 * 10H20 глаубер тұзы.
Кристаллогидраттардың молекулалық массасын - тұздың молекулалық массасына су молекулаларының массаларын қосып табамыз.
Mr(Na2C03*10H20) =106+180=286
Су басқа заттармен «еркімен» әрекеттеседі:
су сілтілік және сілтілі жер металдарымен әрекеттеседі:
2Na+2H2O = 2NaOH+H2↑
Белсенділігі аз металдармен және бейметалдармен су тек жоғары температурада әрекеттеседі:
3Fe+4H2O=FeO → Fe2O3+4H2↑
C+2H2O → CO2+2H2↑
негізгі оксидтермен n. o. су реакцияға түсіп, негіздер түзеді:
CaO+H2O = Ca(OH) 2
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz