5-ші және 6-шы топтардың р-элементтері: құрылымы, таралуы және химиялық қасиеттері


‘‘Қазақ ұлттық қыздар педагогикалық университеті’’
СӨЖ Тақырыбы: 5-ші және 6-шы топтың р-элементтері.
Орындаған:Қуанбек Арайлым
Тобы:107 химия
Қабылдаған: Азимбаева Гулбайра
ЖОСПАР
- Кіріспе бөлім
- Негізгі бөлім
1. 1. 5, 6 топтың элементтеріне жалпы сипаттама?
1. 2. 5-ші топ элементтеріне сипаттама
1. 3. 5-6 топ элементтерінің табиғатта таралуы
1. 3. 6-топ элементтеріне сипаттама
Қорытынды
Қолданылған әдебиеттер
КІРІСПЕ
Бесiншi негiзгi топшаға немесе V А тобына азот N, фосфор Р. мышьяк As, сурьма Sb, висмут Вi жатады. Бесiншi топтын р-элементтерiнiн және жай заттарынын кейбiр физикалык турақтылары 18-таблицада берілген. 5 топ болып табылады элементтер ішінде периодтықкесте. 5топтабар ванадий (V), ниобий (Nb), тантал (Ta) және дубний (Db) . Бұл топ d-блок периодтық жүйенің Топтың өзі a тривиальды атау; ол кеңірек топтастыруға жатады өтпелі металдар.
5-топтың үш жеңіл элементтері табиғи түрде кездеседі және ұқсас қасиеттерге ие; үшеуі де қиын отқа төзімді металдар стандартты жағдайларда. Төртінші элемент, дубний, зертханаларда синтезделді, бірақ табиғатта кездеспеді, ең тұрақты изотоптың дубнии-268 жартылай ыдырау кезеңі небары 29 сағатты құрайды, ал басқа изотоптар одан да көп радиоактивті. Осы уақытқа дейін а суперколлайдер жүргізілді синтездеу топтың келесі мүшесі, не пепцептиум (Ups) немесе unpentennium (Upe) . Пенцепций мен біржылдықтың екеуі де кеш кезең 8 элементтер жақын арада бұл элементтердің синтезделуі екіталай.
Бесiншi негiзгi топша элементтерiнiң реттік нөмірлерінің өсуіне байланысты занды турде олардын атомдарынын, иондарынын ра диустары еседi және соларға сәйкес атомдарынын иондарга айналу энергиялары да бiртiндеп азаятынын көруге болады. Бесіншi негiзгi топша элементтері атомдарынып сырткы кабатында 5 электроннан (s2p3) болады. Сондықтан олар уш электрон косып алып уш теріс зарядты ионга айналуға мүмкіндігі бар
5 топ элементтері:
Азот- азоттың негізгі қоры екі атомнан тұратын молекулалар түрінде атмосфераның құрамында болады, Ауаның 75, 6 массалық проценті 78, 1 көлемдік проценті азоттың үлесіне тиеді, жер қыртысында азот натрий нитраты калий нитраты түрінде кездеседі, қоысылыс күйдегі азоттың үлесіне жер қыртысы массасының 0, 01% тиеді, сонымен бірге азот барлық тірі организмдердің белоктарының құрамына кіреді, ал белоксыз тіршілік болмайды, ФЭнегельстің анықтамасы бойынша *тіршілік дегеніміз белокты заттардың өмір сүру тәсілі*.
Лабораторияда аммоний нитритінің концентрациялы ерітіндісін қыздыру арқылы азот алады:
NH4NO2=N2+2H2O
Құрғақ натрий азидін қыздыру 300 0 арқылы да азот алады:
2NaN3=2Na+3N2
Аммоний дихроматын қыздырғанда азот, хром оксиді жіне су түзіледі
(NH4) 2 Cr 2 O 7 =N2+Cr2O3+4H2O
Аммиакты оттегінде жаққанда азот және су түзіледі:
4NH3+3O2=N2+6H2O
Қыздырғанда азот көптеген металдармен әрекеттесіп сәйкес нитридтер түзеді, мысалы:
3Ca+N2=Ca3N2
Аммиак және аммоний тұздары
Азот сутегімен көптеген қосылыстар түзеді, Азоттың қарапайым сутекті қосылыстарына аммиак азотты сутек қышқылы гидразин N2H4 жатады. Осы қосылыстарының ішіндегі ең маңыздысы аммиак және оның туындылары.
Алынуы - Аммиакты әр түрлі әдістермен алады
Лабораторияда аммиакты аммоний тұздарына сілті қосу арқылы алуға болады:
(NH4) 2SO4+2NaOH=Al(OH) 3+3NH3
Техникада аммиакты синтездік әдіспен өндіреді, Азот пен сутегінен аммиак синтездеу молекулалардың активтеу энергиясын арттыру үшін жоғары температурада және жоғары қысыммен катализатор қатысында жүреді:
N2+3H2O=CaCO3+2NH3
Бұл қайтымды реакцияның тепе-теңдігін аммиак алу жағына қарай ығыстыру үшін температураны оптимальдық жағдайда ұстау қысымды жоғарылату және азот пенсутегінің концентрациясын көбейту, ал аммиактың концентрациясын азайтып отыру керек.
Кальций цинамидіне сумен әсер ету арқылы да аммиак алуға болады:
CaCN2+3H2O=CaCO3+2NH3
Физикалық және химиялық қасиеттері - Аммиак түссіз өзіне тән тұпшықтырғыш өткір иісі бар, суда өте жақсы еритін ауадан жеңіл газ.
Аммиак молекуласындағы азоттың бір жұп электроны болады. Аммиакты суда немесе қышқылда еріткенде осы пайдаланылмаған дайын жұп электронды сутегі катионына берудің нәтижесінде аммиак пен сутегінің арасында донорлы акцепторларды байланыс пайда болып комплекс ионы-аммоний ионы түзіледі.
Аммиакты суда еріткенде ол сутегі ионын қосып алып оң зарядты аммоний катионын түзеді, ал гидроксид ион ерітіндідегі сілтілік қасиет береді, яғни аммиакты суға ерітуден әлсіз тұрақсыз негіз аммоний гидроксиді түзіледі және ол негіздер сияқты гидроксид ионын түзе ыдырайды.
Формуладан әр элементтiң сырткы кабатында уш дара р-электрон дар бар екенi көрiнедi. Осыған сәйкес олардын калыпты (козба ран) жағдайдағы валенттігі үшке тең болады. Азоттан басқа элементтердiн сырткы кабатында бос турган бес d-орбитальдар бар. Сондықтан олардын з-орбиталындагы жуп электрондарды коз дырып бiреуiн d-орбиталына көшiруге болады. Осының нәтиже сiнде элементтердiн сырткы кабатынык орбиталдарына бес дара электрондар пайда болып олар бес валентті күйге көшедi. Азоттын сырткы кабатында бос тұрған d-орбитальдары жок болгандыктан онын жуп электрондарын коздыруға болмайды. Ол тек 5-электрон дардын бiреуiн баска бiр элементке берiп жiберiп сырткы кабатындагы дара электрондар санын төртке жеткізе алады және сонын нәтижесінде төрт валенттi куйге көшеді, ал өзi бiр он зарядты ионға айналады (N+) . Азот қышқылында азот осындай төрт валентті. Негізгі топша элементтері косылыстарда 3-тен 5+ке дейін тотығу дәрежесін көрсетеді.
Азоттын негiзгi коры екi атомнан тұратын молекулалар турiнде атмосферанын курамында болады. Ауанын 75, 6 массалык процен ті, 78, 1 көлемдiк процентi азоттыц улесiне тиеді. Жер кыртысында азот натрий нитраты (Чили селитрасы), калий нитраты (Ундi се литрасы) турiнде кездеседі. Қосылыс күйдегi азоттың үлесіне жер кыртысы массасынын 0, 01% тиеді. Сонымен бірге азот барлык тiрi организмдердiн белоктарынын курамына кiредi, ал белоксыз тiр шiлiк болмайды. Ф. Энгельстiн анықтамасы бойынша тiршiлiк дегенiмiз белокты заттардын емiр сүру тәсiлi. Лабораторияда аммоний нитритiнiн концентрациялы ерiтiндiсiн қыздыру арқылы азот алады. Өнеркәсіпте азотты ауаны суйылту аркылы алады.
Физикалық және химиялык касиеттері. Калыпты температурада азот туссiз, әмсіз газ, жануды, тыныс алу ды колдамайды, кәдiмгi жагдайда 1 л суда 23 мл азот ериді. Азот молекуласындагы атомдардын арасында бiр сигма, екi пн байланыс болатыны бұрын айтылды (§ 34) . Бұл үш байланыс узi лу ушiн кеп энергия керек ететiндiктен молекулалык азот кәдiмгi жагдайда турақты болады да жай және курделі заттардын ешкай сысымен әрекеттеспейді, тек литий мен гана косылыс тузедi. Кызлырганда азот коптеген металдармен әрекеттесіп сәйкес нитридтер тузеді, мысалы:
3Ca+N₂-CasN
Нитридтер, әсіресе сілтілік және сiлтiлiк жер металдарынын нитридтерi химиялык активті қатты заттар, олар кышкылдармен немесе сумен әрекеттесіп аммиак түзеді, мысалы:
CaN2+6H2O=3Ca(OH) 2+2NH3
Бейметалдармен азот жоғары температурада гана әрекеттеседі Мысалы, опын оттегiмен реакциясы 1500°С шамасында басталады.
N2+O2=2NO
Баска кейбір бейметалдармен жоғары температурада нитрид тәріздес косылыстар тузедi, мысалы:
2B+N=2BN
3Si+ 2N - Si2N4
Азотты катты кыздырылган кальций карбидi аркылы өткізгенде кальций цианамиді түзіледі:
N 2 +CaC 2 =CaCN 2 +C
Аммиак және аммоний туздары
Азот сутегiмен көптеген косылыстар түзеді. Азоттың қарапайым сутектi косылыстарына аммиак NH, азотты сутек кышкылы HN,, гидразин N2Н. жатады. Осы косылыстарынын iшiндегi ең маныз дысы аммиак және онып туындылары. Алынуы. Аммиакты ар турлі әдістермен алады. Лабораторияда аммиакты аммоний туздарына сiлтi косу аркы лы алуға болады:
(NH, ) =SO =2NaOH=2NH, {+Na, SOq+H, O
Аммиакты әр түрлі нитридтерге сумен әсер ету арқылы да алады
AIN+3HOH
Al(OH) 3+3NH₂
Техникада аммиакты синтездік әдiспен өндiредi. Азот пен су тегiнен аммиак синтездеу молекулалардын активтену энергиясын арттыру үшін жоғары температурада және жоғары қысыммен катализатор катысында журеді:
N2+3H + 2NH,
Бұл кайтымды реакциянык тепе-тендiгiн аммиак алу жағына карай ығыстыру үшін температураны оптимальдык жагдайда ус тау кысымды жоғарылату және азот пен сутегiнiн концентрациясын көбейту, ал аммиактын концентрациясын азайтып отыру керек. Кальций цианамидiне сумен әсер ету аркылы да аммиак алуга болады:
CaCN₂+3H₂O=CaCOst+ 2NH
Физикалық және химиялық қасиеттері . Аммиак түссіз өзіне тән тұшшықтырғыш өткi iсi бар, суда ете жаксы ери тiн (1 келем суда 700 келем ериді), ауадан женіл (D-0, 59) газ. Аммиак молекуласындағы азоттын бiр жуп электроны болады.
Химияның көп бөлігі тек топтың алғашқы үш мүшесінде байқалды, дубний химиясы онша анықталмаған, сондықтан қалған бөліктер тек ванадий, ниобий және танталмен айналысады. Топтың барлық элементтері - балқу температурасы жоғары реактивті металдар (1910 ° C, 2477 ° C, 3017 ° C) . Реактивтілік тұрақты оксидтік қабаттың тез пайда болуына байланысты әрдайым айқын бола бермейді, бұл одан әрі реакцияларға жол бермейді, 3 немесе 4 топтағы үрдістерге ұқсас. Металдар әртүрлі оксидтер түзеді: ванадий формалары ванадий (II) оксиді, ванадий (III) оксиді, ванадий (IV) оксиді және ванадий (V) оксиді, ниобий формалары ниобий (II) оксиді, ниобий (IV) оксиді және ниобий (V) оксиді, бірақ тек тантал оксидтерінен тантал (V) оксиді сипатталады. Металл (V) оксидтері, әдетте, реактивті емес және негіздерге қарағанда қышқылдар сияқты әрекет етеді, бірақ төменгі оксидтер онша тұрақты емес. Алайда олар оксидтерге ерекше электрлік өткізгіштік сияқты ерекше қасиеттерге ие.
Азоттың осксидтері - азоттың оттекпен қосылыстары. Азот тотығы (монооксид), NO - түссіз газ; қайнау t - 151, 8 o С, балқу t - 163, 6С; қосып алу, тотығу реакцияларына бейім. Азоттың шала тотығы (гемиоксид), N 2 O - түссіз газ; қайнау t - 89, 5 o С, балқу t - 102, 4 o С. Сумен, қышқылмен, сілті ерітінділерімен әрекеттеспейді, тотықпайды. Медицинада наркоз (“шаттандырғыш газ”) ретінде пайдаланады. Азоттың қос тотығы (диоксид), NO 2 - қоңыр түсті газ, қайнау t - 21, 15 o C, балқу t - 11, 2 o С. Ол азот қышқылын өндіру үшін және сұйық ракета отыны мен қопарылғыш заттардың тотықтырғышы ретінде пайдаланылады. Азотты ангидрид, N 2 O 3 - қоңыр қызғылт түсті газ, қайнау t - 13, 5 o C; балқу t - 102 o С; сумен азотты қышқыл (HNO 2 ), сілтілермен нитриттер түзеді. Азот ангидриді, N 2 O 5 - түссіз кристалл, сумен қосылып азот қышқылын (HNO 3 ) түзеді. Жалпы азот оксидтері - физиологиялық актив заттар. Сондықтан ағза үшін зиянды. Азот әр түрлі оксидтер түзеді:
N 2 O, NO, N 2 O 3 , NO 2 , N 2 O 5
N(I) және N(II) оксидтері тұз түзбейтін оксидтер, қалғандары қышқылдық оксидтер.
Физикалық қасиеттеріАзот (II) оксиді - түссіз, иіссіз, оңай тотығып, азот (IV) оксидіне айналатын газ.
АлынуыTабиғатта найзағай отында мына реакция жүреді:
N 2 + О 2 = 2NО; құрылымдық формуласы: N = 0
Өндірісте аммиакты тотықтыру арқылы алады:
4NH 3 + 5O 2 = 6Н 2 O
Зертханада :
3Cu + 8HNO 3 = 3Cu(NO 3 ) 2 + 2NO↑ + 4Н 2 O
Химиялық қасиеттері1) 3NО 2 + Н 2 О = 2HNО 3 + NO
2NО 2 + H 2 О = HNО 2 + HNО 3
Азот (IV) оксиді сумен әрекеттескенде екі түрлі қышқыл түзіледі: азотты және азот қышқылдары.
2) 2NО 2 + 2NaOH → NaNО 3 + NaNО 2 + Н 2 О
Сілтімен әрекеттескенде осы қышқылдардың тұздары - нитрит, нитрат түзіледі.
Азот (IV) оксиді оттегінің қатысында сумен әрекеттесіп, азот қышқылын береді:
4NО 2 + О 2 + 2Н 2 О = 4HNО 3 .
Фосфордың оттекті қосылыстары
Фосфор (V) оксиді Р206 - ак түсті үнтақ зат. Кәдімгі жағдайда ылғал тартатын қасиетіне сөйкес оны газдар мен сүйыктарды ылғалдан құрғату үшін колданады. Фосфор (V) оксиді Р205 қыш- қылдык касиет көрсетіп, сумен, сілтілермен және негіздік оксидтермен реакцияға түседі.
Фосфор қышқылыСу мен фосфор (V) оксиді өрекеттескенде, судың мөлшеріне қарай өртүрлі фосфор кышқылдары түзіледі:
Фосфор қышқылдарының ішіндегі аса маңыздысы, ортофосфор қышқылы Н3Р04, оны көбіне фосфор қыіиқылы деп те атайды. Ол - күші орташа қышқыл. Оның күрылымдык формуласы
Фосфор қышқылы - түссіз кристалды, улы емес зат. Суда жақсы ериді. Фосфор қышқылы H3Р04 орташа қышқыл катарына жатады. Алынуы. Лабораторияда фосфор (V) оксидіне су қосып, фосфор кышкылын алуға болады:
Өнеркәсіпте кальций фосфатына күкірт қышқылын қосып, қыздыру арқылы алады
Фосфор қышқылы суда ерігенде, сатылап диссоциацияланады:
Ортофосфор қышқылының алғашқы сатысына қарағанда келесі сатыларында иондарға ыдырау мүмкіндігі біртіндеп төмендейді. Сондықтан ерітіндіде басқа иондарға қарағанда дигидрофосфат Н2Р04 ионы көбірек болады.
Химиялық қасиеттері.Ортофосфор кышқылы тотыктырғыш қасиет көрсетпейді. Фосфор қышқылының судағы ерітіндісі барльщ басқа қышқылдарға тән қасиеттерді керсетеді. Негіздік оксидтермен, негіздермен өрекеттесіп тұздар түзеді. Негіздік оксидпен әрекеттеседі
Ерітіндідегі фосфор қышкылы сілтімен сатылап әрекеттескенде, бір орта және екі қышқыл тұз түзеді:
Табиғи фосфаттар суда ерімейді. Оларды фосфор қышқылымен өңдеп, ерімтал тұздарға айналдырады да, минералдық тыңайтқыш ретінде пайдаланады. Мысалы:
Фосфат ионға Р04 сапалық реакция: күміс нитратының 3- 4 мл ерітіндісін HgP04, Na3Small textP04 немесе Na2HP04 ерітінділеріне тамызса, сары түсті күміс (I) фосфаты түнбаға түседі:
Қолданылуы.Фосфор қышқылы дәрі-дәрмек жасайтын өнеркәсіпте пайдаланылады. Кальций дигидрофосфаты Са(Н2Р04) 2 нан пісіруде пайдаланатын және алкогольсіз сусындар алуға арналған ұнтақтар ретінде қолданылады. Ал сілтілік металдардың фосфаттарынан жуғыш заттар алынады. Фосфор қышқылы және оның тұздары көбінесе минералдың тыңайтқыш алуға жүмсалады
Фосфор (Ү) оксиді ақ түсті, су тартқыш қасиеті бар қатты I зат. Ол - қышқылдық оксид. Ортофосфор қышқылы - көпнегізді қышқыл, ол қышқыл және орта тұздар түзеді. Қазақстанда табиғи фосфаттардың ірі бай кен орны бар. Табиғи фосфаттардан фосфор қышқылы мен минералдық тыңайтқыштар алынады. Барлық үш элемент әртүрлі бейорганикалық қосылыстар, негізінен +5 тотығу дәрежесінде болады. Төменгі тотығу дәрежелері де белгілі, бірақ олар аз тұрақтылыққа ие, атомдық массаның өсуімен тұрақтылық азаяды.
Жер қыртысында ванадийдің миллионына 160 бөлік бар, бұл оны 19-шы элемент. Топырақ құрамында ванадийдің миллионына шаққанда орта есеппен 100 бөлік бар, және теңіз суы ванадийдің миллиардына шаққанда 1, 5 бөлік бар. Әдеттегі адамда ванадийдің миллиардына шаққанда 285 бөлік бар. Оның ішінде 60-тан астам ванадий кендері белгілі ванадинит, патронит, және карнотит.
Жер қыртысында ниобийдің миллионына шаққанда 20 бөлік бар, ол оны ең көп таралған 33-ші элементке айналдырады. Топырақта ниобийдің орта есеппен 24 бөлігі, ал теңіз суында 900 бөлік болады квадриллион ниобий. Әдеттегі адамда ниобийдің миллиардына 21 бөлік бар. Ниобий минералдар құрамында колумбит және пирохлор.
Танталдың миллионына шаққанда 2 бөлік бар, бұл жердегі 51-ші элемент. Топырақта орта есеппен 1-ден 2 танталға дейін, ал теңіз суында 1 триллион танталға 2 бөлік бар. Әдеттегі адамда бір миллиард танталдың 2, 9 бөлігі бар.
Ванадий- Ванадий (лат. Vanadium; V ) - элементтердің периодтық жүйесінің 5 топ элементі. 1801 жылы алғаш рет Мексика минерологы А. М. дель Рио ашқан, 1830 жылы швед химигі Н. Г. Сефстрем темір рудаларынан жаңа элемент алып, оны скандинавия мифологиясындағы сұлулық құдайы Ванадистің құрметіне ванадий деп атаған.
1869 жылы ағылшын химигі Г. Роско хлорлы ванадиді (VCL2 ) сутекпен әрекеттестіріп, таза 95%- дық ванадий бөліп алады. Ванадий - ашық сұр түсті металл. Қалыпты жағдайда химиялық активтігі өте нашар, ал жоғары температурада ұнтақ күйіндегі ванадий оттек, азот, хлор, күкірт т. б. элементтер мен оңай әрекеттеседі, болатқа қосқанда оның мықтылығы артады.
Ол көбіне автомашиналар өндірісінде мотор, цилиндр, білік т. б. жасауға жұмсалады. Ванадийдің темірмен қоспасы - феррованадий түрінде өндіріледі. Өндірісте Ванадий қосылыстарының маңыздысы Ванадий ангидриті V2O5 - қызғылт түсті, суда, сілтілерде жақсы еритін қатты зат.
Қолданылуы- Ванадий ниобий тантал арнаулы болаттар алуға қолданылады. Аздаған ванадий қосылған болат соққыға үйкелуге үзілуге төзімді болады Мұндай болаттар механикалық күш түсіп тұратын машина бөлшектерін жасауға жұмсалады Ниобий мен тантал коррозияға төзімді болғандықтан медициналық құрал жабдықтар химиялық ыдыстар жасауға қолданылады
Ванадий қосылыстары химия өнеркәсібінде күкірт қышқылын контакт әдісімен өндіргенде катализатор ретінде медицинада антисептик жасауға ауыл шаруашылығында қолданылады
Қосылыстары- Ванадий мен ниобий ЭО Э 2 О 3 ЭО 2 типтес оксидтер ал тантал Та 2 О 5 оксидін түзедіВанадий шашыраған элементтерге жатады және табиғатта еркін түрде кездеседі. Жер қыртысындағы ванадий мөлшері 1, 6⋅10-2%, мұхиттар суда 3⋅10-7%. Магмалық жыныстардағы ванадийдің ең жоғары орташа құрамы габбро мен базальттарда (230-290 г/т) байқалады. Шөгінді жыныстарда ванадий биолиттерде (асфальттарда, көмірлерде, битуминозды фосфаттарда), битуминозды тақтатастарда, бокситтерде, сондай-ақ оолитті және кремнийлі темір кендерінде кездеседі. Ванадийдің ионды радиустарының жақындығы және темір мен титанның магмалық жыныстарында кеңінен таралған гипогенді процестерде ванадий толығымен шашыраңқы күйде болуына және өз минералдары құрмауына әкеледі.
6 топтың элементтері -Халькогендер - периодтық жүйенің VI A-тобы элементтерінің топтық атауы. Топқа оттегіО, күкірт S, селен Se, теллур Te, полоний Po элементтері жатады. Бұл элементтер атомдарының валенттік деңгейлерінің электрондық формуласы ns2np4. Оттегі қосылыстарда көбінесе теріс жирек - II, сирек - I тотығу дәрежелерін көрсетеді. Басқа халькогендерге +IV және +VI, сонымен бірге -II тотығу дәрежелері тән. Электртерістіктері бойынша О және S -бейметалдар, ал Se, Te және Po - амфотерлі элементтер; Se мен Te бейметалдық, ал Po металдық қасиеттерді басымырақ көрсетеді. Бос күйінде оттегі O2 - газ, ал күкірт және оның аналогтары- қатты заттар. Оттегіден полонийға қарай жай заттардың тотықтыру мүмкіндіктері азаяды.
Халькогендердің қасиеттері[өңдеу қайнарын өңдеу]Оттегі
Оттегі - екінші периодтың, VI- топтың элементі. Электртерістілігі жоғары, типтік бейметалдық қасиеттерді көрсетеді. He, Ne, Ar элементтерден басқа элементтермен қосылыстар береді, көптеген оксидтер, гидроксидтер, оттекті қышқылдар тұздарының құрамына енеді. Жер қабатында 55% және табиғи суларда ең көп таралған элемент, бос және байланысқан түрде кездеседі. Минералдар мен тау жыныстары (алюмосиликаттар, құм, балшыққұмдақтар т. б. ) құрамына енеді. Бос оттегі ауа құрамында болады. Барлық организмдердің тіршілігіне өте қажетті элемент, органикалық заттар көбінің құрамында болады, сан алуан биохимиялық процестерге қатынасады, тіршілікті қамтамасыз етеді. Оттегін 1769-1771 жылдары швед химигі К. В. Шееле ашты және одан тәуелсіз 1774 жылы ағылшын химигі Дж. Пристли қоса ашты. Олар оттегін HgO мен KNO3-ті қақтау арқылы алды.
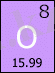
Оттегі O
Оттегінің алынуы
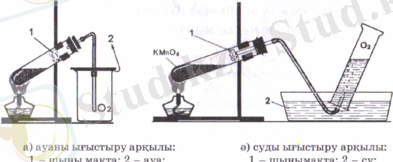
Оттегін өнеркәсіпте ауаны қысып сұйылтады да, азот пен оттегінің қайнау температураларының айырмашылығына қарай буландырып бөліп алады. Осылайша алынған оттегі көгілдір түсті баллондарда сақталады, себебі сұйық оттегі ашық-көгілдір түсті болады. Ал зертханалық алу әдістері кейбір оттегіге бай күрделі қосылыстарды айыруға негізделген (8-сурет) .
- Тұрмыста жиі қолданылатын «марганцовканы» айыру. Ол үшін құрғақ сынауыққа аздаған түйірлерін салып, оның аузын газ шығатын түтігі бар тығынмен жауып қыздырамыз. Сонда мына реакция жүреді:

Шоқтанған шырпыны түтіктің аузына апарсақ, ол лап етіп жанады, себебі оттегі жануды қолдайтынын сендер бұрыннан білесіңдер.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz
