Металлургиялық өндірістің физика-химиялық негіздері


АЙТБАЕВ Н. Б., АБДРАХМАНОВ М. С., КӨБЕГЕН Е
МЕТАЛЛУРГИЯЛЫҚ ӨНДІРІСТІҢ
ФИЗИКА-ХИМИЯЛЫҚ НЕГІЗДЕРІ
Қарағанды 2021
4 АГЛОМЕРАЦИЯ
4. 1 Негізділік балансы . . .
5 ДОМНАЛЫҚ ПРОЦЕСС
5. 1 Домна пешінің көрігіндегі процестер .
6 БОЛАТ ӨНДІРУ
6. 1 Мартен процесі . . . . . .
8 ЗЕРТХАНАЛЫҚ ЖҰМЫСТАР
8. 1 Көміртекті көмір қышқыл газбен газдандыру реакциясының тепе-теңдігін зерттеу . . .
КІРІСПЕ
Ғылым ретінде металлургия негізін физика-химиялық металлургиялық процестер теориясы құрайды. Металлургиялық өндірістің физика-химиялық негіздері пәні күрделі металлургиялық жүйелердің және оларда өтетін процестердің физика-химиялық талдауын атқарды. Бұл салада эксперименттермен қатар теориялық зерттеу әдістері аса кең пайдаланылады, бәрінен бұрын термодинамикалық және молекула-кинетикалық. Талдаудың бұл әдістерін сәтті меңгеру инженер-металлургтарды даярлауда негізгі міндеттердің бірін құрайды.
Оқу құралында металлургиялық өндірістің физика-химиялық негіздері ұсынылған. Металлургия (грек. metallurgeo - руда өндіремін, металл өңдеймін, metallon - рудник, металл және ergon - жұмыс) - ғылымның, техниканың, өнеркәсіптің кеннен немесе басқа да материалдардан металл алу процестерін, сондай-ақ металл қорытпаларға олардың химиялық құрамы мен құрылымын өзгерту арқылы қажетті қасиеттер беру процестерін қамтитын саласы.
Қара металлургия - металлургияның ғылымы мен техникасының қара металдар өндіруде кен шикізатын қазып алудан бастап, оны өңдеп шойын, ферроқорытпа, болат, илек, құбыр, рельс, т. б. өнімдерді алуға дейін қамтитын саласы.
Дүниежүзінде өндірілетін барлық металдардың 95%-ға жуық үлесі қара металдардың еншісіне тиеді.
Металлургиялық агрегаттарда газ фазасының термодинамикалық өзара әрекеттесуінің заңдылықтары қозғалды. Термиялық диссоциация және қосылыстардың пайда болуы, оксидтер мен металдардың қалпына келтіру газ атмосферасымен өзара әрекеттесуі, күрделі гетерогенді жүйелердегі процестер, металл фазаларды тазартудың кристаллизациялық әдістері, буландыру және конденсациялау мәселелері қарастырылды. Қарапайым және күрделі металлургиялық жүйелерде болып жатқан реакциялардың механизмдері сипатталған. Оқу құралы «Металлургия» модульдік білім беру бағдарламасы бойынша оқитын жоғары оқу орындарының студенттеріне арналған, сондай-ақ, металлургиялық мамандықтардың басқа техникалық жоғары оқу орындарының студенттеріне пайдалы болуы мүмкін.
1 Металлургиялық процестердің физико-химиялық негіздері
Металлургия (грек. metallurgeo - руда өндіремін, металл өңдеймін; metallon - рудник, металл және ergon - жұмыс) - ғылымның, техниканың, өнеркәсіптің кеннен немесе басқа да материалдардан металл алу процестерін, сондай-ақ металл қорытпаларға олардың химиялық құрамы мен құрылымын өзгерту арқылы қажетті қасиеттер беру процестерін қамтитын саласы.
Химиялық реакциялардың өту жылдамдығы түрлі факторларға тәуелді-әрекеттендіруші заттардың концентрациясына, қысымға, үдеткіштер, катализаторлар және т. б. әсеріне, ал кейбір гетерогендік түрленулер кезінде басқа да жағдайларға-беттің күйіне, жылу және масса алмасу жағдайларына тәуелді. Химиялық реакциялар мен гетерогенді үрдістердің жылдамдығы жөніндегі оқудың дамуына Я. Вант-Гофф,
Н. А. Меншуткина, Н. А. Шилова, Н. Н. Симинов және т. б. ғылымдардың еңбектері үлкен үлес қосты.
Химиялық реакцияның үдемелі жүретіндігі үлкен теорияға және қолданбалы маңызға ие. Соңғы жылдары қара және түсті металлургияда оттегі металлургиялық үрдістердің үдеткіші ретінде кеңінен қолданылады. Температуралық фактор технологиялық үрдістерді үдетуші ретінде үлкен маңызға ие болып келеді.
Реакция компоненттерінің бір немесе бірнеше фазада болуына байланысты гомогенді және гетерогенді химиялық реакциялар кинетикасын айырады. Гомогендер деп бастапқы заттармен әрекеттесу өнімдері бір фазада болатын (газ немесе сұйық) және де молекулалар, атомдар, иондар алынған барлық көлемде әсерлесетін химиялық реакцияларды айтады. Бұл реакция типінің мысалы ретінде конвертерленген табиғи газ құрамына кіретін СО мен Н 2 жану реакцияларын қарастыруға болады:
Гетерогенді деп реакцияға қатысатын заттар әртүрлі фазада (катализаторларда) болатын, ал химиялық түрлену үрдісінің өзі осы фазалардың шегінде өтетін химиялық реакцияларды атайды. Гетерогенді химиялық реакцияға мысал ретінде газ регенераторларында аса қыздырылған қатты отын түйірлерінің бетінде жүретін реакцияны қарастыруға болады:
Гетерогенді химиялық реакцияға мартен пешінің ваннасында көміртегінің тотығу реакциясы да жатады. Схемалық түрде оны келесідей суреттеуге болады:
(FeO) {CO}
↓ ↑
[Fe] + [C] = [Fe] + [CO]
Бұл реакция үш сатыда өтеді:
1. Оттегінің қождан металға диффузиялануы;
2. Металдағы көміртегі мен оттегі арасындағы химиялық реакция;
3. Металдан көміртегі тотығының бөлінуі.
Күрделі гетерогенді химиялық реакцияның жылдамдығы үрдістің ең баяу өтетін сатысының жылдамдығымен анықталады. Қарастырылып отырған реакцияда (1. 6) мұндай саты-оттегінің шлактан металға диффузиясы.
Диффузия деп ерітінді немесе балқыма көлемінде концентрациясының біркелкі таралуына әкелетін ерітілген зат концентрациясының өздігінен теңесу үрдісін атайды.
Гетерогенді үрдістер кинетикасында диффузияның ролі-әр үрдіс жеткілікті жылдамдықпен жүруі үшін реакция өнімдері фазалардың бөліну бетінен әкетіліп отыруы керек, ал бұл диффузия арқылы жүзеге асады.
Диффузияның қорғаушы күші - диффузия бағытындағы жол кесіндісіне dx сәйкес келетін ерітілген зат концентрациясынан өзгерісімен dc анықталатын концентрация градиенті dc/dx болып табылады.
Диффузия жолымен тасымалданатын зат массасы dm концентрация градиентіне, диффузия өтетін ортаның көлденең қима ауданына S және уақытқа dτ тура пропорционалды. Онда
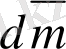 =
=
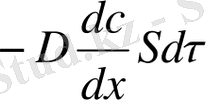 ,
,
мұнда D -диффузия коэффициенті, ал диффузия жылдамдығы
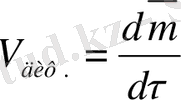 =
=
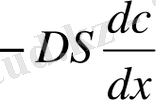 .
.
Фиктің I заңы: Молекулалық диффузия жүйе қимасына және концентрация градиентіне тура пропорционал.
(8) теңдік стационарлы диффузияны сипаттайды және Фиктің бірінші заңы деп аталады. Фик теңдігіне минус таңбасы заттың концентрациясының келуі бағытында тасымалданатынын көрсетеді, яғни dc/dx<0.
Диффузия коэфициентінің өлшем бірлігі 1 см²/сек. Бұл коэффициент диффузия өтетін ортаның және диффузияланған заттың табиғатына, температураға және аз дәрежеде концентрация мен қысымға тәуелді.
Ең жоғарғы диффузия жылдамдығы:
- газдарда (D≈1 см²/сек)
- сұйықтарда (D≈10 ²/сек)
- қатты денелерде (D≈1 см²сек)
Атомарлық диффузия коэффициентінің түзетілген (қозғалыссыз) темірдегі мәні 1500-1600ºC -де 10 -4 -10 -5 см²/сек тең. Мартен пештерінде көміртегінің тотығуы кезінде және осының нәтижесінде туындайтын араласу салдарынан масса тасымалдану жылдамдығы күрт өседі- турбулентті диффузия коэффициенті көміртегінің тотығу жылдамдығына байланысты 25-82 см²/сек шектерінде жатады. Мартен пештерімен салыстырғанда көміртегі тотығуының жоғары жылдамдығымен ерекшеленетін оттекті-конвертерлерде металл мен қождың араласуы тек көміртегі тотығының түзілуімен ғана емес, сонымен қатар оттегі ағымының энергиясы есебінен де орындалатынын ескерсек, турбулентті диффузия коэффициентінің мәні 2-25000 см²/сек дейін жетуі мүмкін. Келтірілген мәндерден көріп отырғанымыздай, оттекті-конвертер ваннасындағы масса тасымалдану жылдамдығы атомарлық диффузиядан миллиондаған есе, ал мартендік пештегіден мыңдаған есе жоғары.
1. 1 Домналық балқытудың шикізат материалдары
Домналық балқыма үшін темірлі-кендік материалдар (темір, марганец кендері, агломерат, жұмаршақтар), флюстер (көбнесе әктас), сондайақ отын (кокс) шикізат болады. Домна пештерінің жинақ құрамы шамамен қорытып алынатын шойынның құрамымен анықталынады, сонымен шихтада әр түрлі қатынаста әр түрлі компаненттер (сыңарлар) болуы мүмкін.
Дұрысын айтқанда шойын түзілуге қажетті темірді пешке темірлікендік материалдар (оксидтер түрінде, ал кейде металдық түрде) әкеледі. Кеннің пйдалы бөлігі болып саналатын темірлі-кен қосылыстары әрдайым балласт қосылыстармен-маңызсыз (бос) жыныспен бірге болады. Маңызсыз жыныс көбінесе кремнеземнан - SiO 2 , шамалы мөлшерде глиноземнан - Al 2 O 3 , әктен - CaO және магнезиядан - MgO тұрады.
мұндағы: CaO, MgO, SiO 2 , Al 2 O 3 - кендегі сәйкес тотықтардың мөлшері, %.
В < 1 - болғанда кен қышқылды бос жынысқа, В > 1 - болғанда қышқылды жынысқа ие болады. Егер В = 1 болса, онда кеннің бос жынысын өзіндік қорытпа деп атайды (пустая порода руды называется самоплавкой) . Кейбір темір кендерінің химиялық құрамы 1. 1-кестеде келтірілген.
1-мысал.
Теміртастағы темір мөлшері 57% құрайды. Бос жыныстың мөлшерін анықтаңыз.
ШЕШУІ:
Қызыл теміртастағы гематит мөлшерін анықтаймыз:
Fe 2 O 3 = (57 × 160) :112 = 81, 4%.
мұндағы: 160 - Fe 2 O 3 молекулалық салмағы, г/моль;
112 - молекуладағы Fe 2 O 3 темірдің екі атомының салмағы, г/моль.
Бос жыныстың мөлшері тең болады:
100 - 81, 4 = 18, 6%.
2-мысал.
Құрамы келесідей [C] = 4%; [Si] = 0, 8%; [Mn] = 0, 7%; [S] = 0, 04%; [P] = 0, 2% 56% Fe тұратын 1т шойындағы гематитті кен шығынын анықтаңыз.
ШЕШУІ:
Бірлік шойынға темірлі кеннің шығыны темір балансы бойынша анықталады:
Р × Fe общ = Ч × [Fe],
мұндағы Р - т/т шойынға кеннің шығыны;
Fe жалпы -кендегі темір мөлшері %;
[Fe] - шойындағы темір мөлшері %.
- Шойындағы Fe мөлшерін анықтаймыз:
Fe ч = 100 - [C] - [Si] - [Mn] - [S] - [P] = 94, 26%.
1. 1-кесте-Темір кендері мен концентраттарының химиялық құрамы
18. Мандыбаш
конц-т
2. Онда кен шығыны құрайды:
Р = 94, 26 : 56 = 1, 68 т/т шойын.
3-мысал.
Екі кен (а) және (б) берілген. Әрбір кендегі темірден тұратын минералдардың пайыздық мөлшерін анықтау, егер химиялық талдау мәліметтері бойынша (а) кенде Fe общ = 46, 0%, FeO = 13, 0% болса, ал (Б) кенінде: Fe общ = 50, 4%, FeO = 23, 0%.
ШЕШУІ:
FeO байланысқан темір мөлшері
а) Fe FeO = 56 ⋅ FeO/72 = 56 ⋅13, 0/72 = 10, 11%,
б) Fe FeO = 56 ⋅ FeO/72 = 56 ⋅23, 0/72 = 17, 89%.
(а) кені
Тотығу коэффициенті
К = Fe жалпы / Fe FeO = 46, 0/10, 11 = 4, 55 > 3, демек (а) кенінде Fe 2 O 3 және Fe 3 O 4 минералдар болады, яғни барлық FeO Fe 3 O 4 -да байланысқан.
Fe 3 O 4 мөлшері
Fe 3 O 4 = 232 ⋅ Fe Fe3O4 /72 = 232 ⋅ 13/72 = 41, 89%.
Fe 2 O 3 жалпы мөлшері
Fe 2 O 3Σ = 160⋅(Fe жалпы - 56⋅ FeO/72) /112 = 160⋅(46 - 56⋅13/72) /112 = 51, 27%.
Fe 3 O 4 -да байланысқан Fe 2 O 3 мөлшері
Fe 2 O 3 Fe3O4 = 160 ⋅ FeО Fe3O4 /72 = 160 ⋅ 13/72 = 28, 89%.
(а) кеніндегі Fe 2 O 3 мөлшері
Fe 2 O 3 = Fe 2 O 3Σ - Fe 2 O 3 Fe3O4 = 51, 27 - 28, 89 = 22, 38%.
(б) кені
Тотығу коэффициенті
К = Fe жалпы / Fe FeO = 50, 4/17, 89 = 2, 82 < 3, демек (б) кенінде Fe 3 O 4 және FeO минералдары болады, яғни барлық Fe 2 O 3 -да байланысқан.
Fe 3 O 4 байланысқан Fe 2 O 3 мөлшері
Fe 2 O 3 Fe3O4 = 160⋅(Fe жалпы - 56⋅FeO/72) /112 = 160⋅(50, 4 - 56⋅23/72) /112 = 46, 44%.
(б) кендегі Fe 3 O 4 мөлшері
Fe 3 O 4 = 232 ⋅ Fe 2 O 3 Fe3O4 /160 = 232 ⋅ 46, 44/160 = 67, 34%.
Fe 3 O 4 байланысқан Fe 2 O мөлшері
FeO Fe3O4 = 72 ⋅ Fe 2 O 3 Fe3O4 /160 = 72 ⋅ 46, 44/160 = 20, 90%.
(б) кендегі FeO мөлшері
FeO = FeO Σ ⋅ FeO Fe3O4 = 23, 0 - 20, 9 = 2, 1 %.
Сонымен (а) кенінде: Fe 2 O 3 = 22, 38%,
Fe 3 O 4 = 41, 89%,
FeO = 0% .
(б) кенінде: Fe 2 O 3 = 0%,
Fe 3 O 4 = 67, 34%,
FeO = 2, 1%.
Өзіндік жұмысқа арналған тапсырмалар:
1-тапсырма. Кенде 3970 т гематит болады. Осы кен мөлшерінде қанша пайыз темір болады?
2- тапсырма. Кеннің бір үлгісін талдауда кеннен 2, 8 г темір табылды. Ол темір тотығының қандай мөлшеріне (III) сәйкес келеді?
3-тапсырма. Магнитогор темір кен үлгісінде магнетит минералы түрінде 62% темір бар. Берілген кенде магнетит мөлшері қанша (пайызда) ?
4-тапсырма. 5 кг магнетитте темір мөлшері қанша?
5-тапсырма. Темір кенінде 80% Fe 2 O 3 және 10% SiO 2 , қалғаны - қоспалар. Осы кенде темір мен кремний қанша (пайызда) ?
6-тапсырма. Магнитті, қоңыр және шпаттық теміртаста темір мөлшері сәйкесінше 63%, 50% және 41% құрайды. Әрбіреуіндегі бос жыныстың мөлшерін анықтаңыз.
7- тапсырма. 1 кг Fe 2 O 3 және 1 кг Fe 3 O 4 темір мөлшері бірдей бола ма?
8-тапсырма. 4640 т магнитті теміртастан тұратын Fe 3 O 4 зауытқа кен жеткізілді. Осы мөлшердегі кенде қанша темір болады?
9-тапсырма. Құрамы келесідей [C] = 4%; [Si] = 1%; [Mn] = 0, 6%; [S] = 0, 03%; [P] = 0, 1%; 94, 27% Fe 1т шойынға кен шығынын анықтаңыз.
Әртүрлі темір кендерінің және концентраттарының химиялық құрамдары 1. 1-кестеде көрсетілген.
10-тапсырма. 1. 1-кестеде темір кендерінің және оларды байытатын концентраттардың құрамы келтірілген. Кендегі немесе сіздің нұсқаңызға сәйкес концентраттағы темірден тұратын минералдардың пайыздық мөлшерін анықтаңыз.
11-тапсырма. 1. 1-кестедегі мәліметтерге сәйкес кен түрін және бос жыныс мөлшерін анықтаңыз.
- 1. 2 Домнада балқыту отыны
Домнада балқыту үшін пайдаланылатын жағармай (отын) тек шихтаны қыздыру мен балқытуға ғана емес, сонымен бірге, пештегі тотықсыздандыратын процестерде және темірді көміртектендіруге негізгі химиялық реагентті атқарады.
Домналық балқытуда отынның негізгі түрі кокс. Металлургиялық кокстың сапасын бағалау үшін оның химиялық құрамын, физика-химиялық және физика-механикалық қасиеттерін білу керек.
Кокстың химиялық құрамы оның органикалық массасымен сипатталады. Коксты органикалық зат әдетте келесілерден тұрады: 96, 5 - 97, 5% С; 0, 5 - 0, 8% Н 2 ; 0, 3 - 0, 4% О 2 және S және N 2 кейбір мөлшерінен.
Органикалық массаның талдауын кейде элементарлы талдау деп те атайды. Осы талдаудың негізгі көрсеткіші ұшардан және ұшпайтын көміртектен құралатын көміртек мөлшері табылады. Тәжірибелік есептерді жүргізу үшін С ұшпайтын мөлшерін білу керек. Осы көміртектің мөлшерін техникалық талдаудан анықтауға болады.
Техникалық талдауда күлдің (А), ылғалдың (W), ұшқыш заттардың (L) және күкірттің (S) мөлшері, яғни кокстың жұмыс массасы анықталады. С ұшпайтын мөлшері төмендегі теңдеу бойынша кокстың құрғақ массасынан анықталады:
 = 100 - (А
С
+ L
C
+ S
C
) .
= 100 - (А
С
+ L
C
+ S
C
) .
Әдетте металлургиялық коксттарда күлдің мөлшері 8…13% шектерде түрленіп тұрады. Кокс күлінің құрамы маңызды, себебі қож домна пешінде қож түзілу процесіне әсер етеді. Күлдің негізгі компоненттері SiO 2 , Al 2 O 3 , Fe 2 O 3 . Бұдан өзге, күлде СаО, MgO, SO 3 , P 2 O 5 , Mn 3 O 4 компоненттер және т. б. кездеседі. Күлдегі SiO 2 және Al 2 O 3 мөлшері әдетте 50…70%, ал СаО және MgO барлығы 4…6%. Бұл бос жынысты қождауға жетпейді. Кокстағы ылғал мөлшері көп емес - 1…3% жуық. Ұшар заттардың мөлшері де аз- 0, 8 - 1, 2% және кокстау технологиясына байланысты, яғни кокстау температурасы неғұрлым жоғары және кокстау кезеңінің ұзақтығы үлкен болса, соғұрлым кокста ұшқыш заттар аздау болады. Ұшар заттар 300 - 350 0 С жоғары қыздырғанда бөліне бастайды, бұл домна пешінің шахта үстіне сәйкес келеді және домна процесіне қатыспайды.
1-мысалы.
Кокстың техникалық құрамы берілген, %:
күл - 9, 5; күкірт - 1, 7; ұшар заттар - 1, 0; ылғал - 3, 0. Кокстың органикалық массасында Н 2 , N 2 және О 2 мөлшері 1, 0%.
Күлдің талдауы %:
SiO 2 - 43, 00; Al 2 O 3 - 23, 00; Fe 2 O 3 - 22, 50; CaO - 6, 10; MgO - 1, 36; P 2 O 5 - 0, 39; SO 3 - 3, 32; Mn 3 O 4 - 0, 33.
Кокстағы ұшар заттардың құрамы, %:
СО 2 - 29, 0; СО - 34, 0; СН 4 - 1, 0; Н 2 - 4, 0; N 2 - 32.
Кокстың элементарлық құрамын және ондағы ұшпайтын көміртек мөлшерін анықтау.
ШЕШУІ:
Кокстың элементарлық құрамын анықтау үшін төмендегі теңдеу бойынша кокстағы қож компоненттерін (К А ) және (К К ) кокс құрамындағы (K L ) ұшар заттарды есептеу керек:
К К = К А ⋅ 0, 01А; К К = K L ⋅ 0, 01L.
1. Кокс қожында SO 3 түрінде болатын күкірт мөлшерін анықтаймыз:
9, 5 × 0, 0332
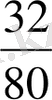 = 0, 126%,
= 0, 126%,
мұндағы: 32 - молярлық салмағы S;
80 - SO 3 молярлық салмағы.
2. SO 3 өзге, басқа қосылыстарда байланысқан күкірт мөлшерін анықтаймыз:
1, 7 - 0, 126 = 1, 574%.
3. Кокстың күл компоненттерін және ұшар заттарын кокс құрамына есептейміз, %.
Күл: SO 3 - 9, 5 ⋅ 0, 0332 = 0, 3150 ұшар заттар: СО - 1, 00 ⋅ 0, 34 = 0, 34
Al 2 O 3 - 9, 5 ⋅ 0, 2300 = 2, 1850 CO 2 - 1, 00 ⋅ 0, 29 = 0, 29
CaO - 9, 5 ⋅ 0, 610 = 0, 5795 N 2 - 1, 00 ⋅ 0, 32 = 0, 32
Mn 3 O 4 - 9, 5 ⋅ 0, 0033 = 0, 0313 CH 4 - 1, 00 ⋅ 0, 01 = 0, 01
SiO 2 - 9, 5 ⋅ 0, 4300 = 4, 0850 H 2 - 1, 00 ⋅ 0, 04 = 0, 04
Fe 2 O 3 - 9, 5 ⋅0, 2250 = 2, 1375
MgO - 9, 5 ⋅ 0, 0136 = 0, 1292
P 2 O 5 - 9, 5 ⋅ 0, 0039 = 0, 0390
Кокстың органикалық массасында 1, 0% Н 2 , N 2 және О 2 болады.
Ұшпайтын көміртек мөлшерін анықтаймыз:
С ұшпайтын = 100 - (1, 574 + 9, 5 + 1, 0 + 1, 0) = 86, 926%.
- Кокстың элементарлық құрамын анықтаймыз, %:
С ұшпайтын - 86, 926; S - 1, 574; SO 3 - 0, 315; SiO 2 - 4, 085; Al 2 O 3 - 2, 185; Fe 2 O 3 - 2, 1375; CaO - 0, 5795; MgO - 0, 1292; Mn 3 O 4 - 0, 0313; P 2 O 5 - 0, 039; CO 2 - 0, 29; CO - 0, 34; CH 4 - 0, 01. Ұшатын заттарға кіретін компоненттерді біріктіріп (СО 2 , СО СН 4 , Н 2 және N 2 ), есептеуде пайдаланылатын кокстың әдеттегі химиялық құрамын аламыз. Бұл кезде барлық компоненттер қосындысы 100% құрайды.
Өздігінен шешуге арналған есептер
1 - 16 тапсырма. 1. 2, 1. 3 және 1. 4-кестелерде келтірілген кокстың, оның күлінің және ұшар заттарының берілген техникалық құрамында кокстың элементарлық құрамын анықтау.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz