Химия: жоғарғы оқу орындары студенттеріне арналған оқу құралы және есептер мен жаттығулар жинағы


А. Қ. Б а е ш о в а
Х И М И Я
Алматы 2011
ӘЛ-ФАРАБИ АТЫНДАҒЫ ҚАЗАҚ ҰЛТТЫҚ УНИВЕРСИТЕТІ
А. Қ. Баешова
Х И М И Я
Оқу құралы
Алматы
«Қазақ университеті»
2011
Баспаға әл-Фараби атындағы Қазақ ұлттық
университеті химия факультетінің Ғылыми кеңесі
және Редакциялық-баспа кеңесі ұсынған
П і к і р ж а з ғ а н д а р :
химия ғылымдарының докторы, профессор С. М. Тәжібаева
химия ғылымдарының докторы, профессор У. Ж. Джусипбеков
химия ғылымдарының докторы, профессор Г. С. Полимбетова
Баешова А. Қ.
Химия: Оқу құралы. - Алматы: Қазақ университеті, 2011. -
Оқу құралында жоғарғы оқу орындарында білім алатын студенттерге арналған химия пәні бойынша есептер және жаттығулар жинағы келтірілген. Әрбір тараудың басында есептерді шығаруға қажет ережелер, заңдар, формулалар және есептердің шығару әдістері, мысалдар келтірілген. Оқу құралы студенттердің өзіндік жұмысын орындауда көп пайдасын келтіреді.
1 ХИМИЯНЫҢ НЕГІЗГІ ТҮСІНІКТЕРІ МЕН НЕГІЗГІ ЗАҢДАРЫ
1. 1 Химияның негізгі түсініктері
Атом дегеніміз − жай және күрделі заттардың молекулаларының құрамындағы химиялық элементтердің ең кіші бөлігі. Атомдар бір-бірімен әрекеттескенде молекулалар түзіледі
Молекула дегеніміз - заттың химиялық қасиетін сақтайтын ең кішкене бөлшегі. Молекулалар әртүрлі атомдардан және тек бірдей атомдардан құрылады. Егер зат атомдардың бір түрінен құрылса, оны жай зат дейді. Ал әртүрлі атомдардан құрылған зат - күрделі зат деп аталады. Мысалы, О 2 - жай зат, СаСО 3 - күрделі зат.
Химиялық элемент дегеніміз - ядроларының заряды бірдей болатын атомдардың жиынтығы. Мысалы, оттек - элемент. О - атом, ядро заряды «плюс» 8.
Әрбір элементтің символы болады (Сu - мыс, Н - сутек, О - оттек, Ве - бериллий, Ті - титан, Ғе - темір, S - күкірт, Р - фосфор, Са - кальций) .
Заттардың құрамын химиялық формуламен белгілейді. Химиялық формула жазу үшін заттың құрамындағы элементтердің символын жазып, оның санын көрсетеді: Na 2 O, CaO, H 2 SO 4 , NaOH. Атом біреу болса, индекс жазылмайды. Атом сандарын көрсетіп жазған формуланы заттың шынайы немесе молекулалық формуласы дейді, ал атом санын көрсетпесе, эмпирикалық немесе қарапайым формуласы дейді.
Ал егер элементтер арасындағы байланыстарды сызықтармен көрсетсе, графикалық немесе құрылымдық формула түзіледі:
Н - О - Н
Са = О
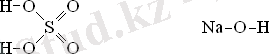
Валенттілік. Заттардың молекулалары оларды құрастыратын элементтердің валенттілігіне сәйкес құрылады. Валенттілік дегеніміз - элемент атомының химиялық байланыс түзу қабілеті. Екі элементтің арасында түзілетін химиялық байланыстың саны осы элементтің валенттілігі болып табылады. Мысалы, сутек атомы әрқашанда бір байланыс түзе алады. Ол - бір валентті. Сондықтан мынадай қосылыстарда: NH 3 - азот 3 валентті, H 2 S - күкірт 2 валентті. Кейбір элементтер сутекпен қосылыс түзе алмайды, сондықтан оның валенттілігін оттекпен түзген қосылысы бойынша анықтайды. Оттек атомы әрқашанда екі байланыс түзеді. Ол - әрқашанда 2 валентті. Сонда, Na 2 O, СаО, SiО 2 деген қосылыстарда натрий - 1 валентті, кальций - 2 валентті, кремний - 3 валентті.
Химиялық формулалар күрделі заттардың құрамын көрсетеді. Химиялық формуладан заттың атын, оның бір молекуласын, молекуланы қандай атомдар құрайтынын, әр элементтің қанша атомдары құрайтынын, молекуланың молярлық массасын және әрбір элементтің қандай масса мөлшерінде қосылатынын білуге болады. Мысалы, H 3 PO 4 формуласы бұл зат фосфор қышқылы екенін, оның бір молекуласын, құрамы сутек, фосфор, оттектен және осы элементтердің атомдарының санын және молярлық массасы - М (H 3 PO 4 ) = 98 г/моль екенін көрсетеді.
Химиялық теңдеулер. Химиялық реакцияларды химиялық теңдеулер арқылы көрсетеді. Теңдеудің сол жағына реакцияға түсетін заттардың таңбалары мен формулалары, ал оң жағына реакция нәтижесінде түзілетін заттардың таңбалары мен формулалары жазылады. Теңдеудің сол жағы мен оң жағындағы әр элементтің атом сандары тиісті коэффициенттер қойылу арқылы теңестірілуі керек.
Салыстырмалы атомдық масса. A r - табиғи изотоптық құрамы бар элемент атомының орташа массасының 12 С көміртек атомының 1 / 12 массасына қатынасы. Мысалы, A r (Н), А r (O), (r - relative -салыстырмалы) .
Салыстырмалы молекулалық масса. M r - табиғи изотоптық құрамы бар элемент молекуласының орташа массасының 12 С көміртекі атомының 1 / 12 массасына қатынасы. Салыстырмалы атомдық массаның және салыстырмалы молекулалық массаның өлшем бірлігі жоқ.
Моль
- бұл 0, 012 кг көміртек
12
С изотобында болатын атомдар санына тең құрылымдық бірліктер (молекулалар, атомдар, иондар, электрондар немесе басқалары) болатын заттың мөлшері. Зат массасының зат мөлшеріне қатынасындай шаманы
молярлық масса
дейді.
, сонда: M= г/моль,
m - зат массасы, г, кг;
n - зат мөлшері, моль.
ЖАТТЫҒУЛАР МЕН ЕСЕПТЕР
- Төменде келтірілген қосылыстардың шынайы химиялық формулаларын жазыңыздар.
а) алюминий оксиді, күкірт диоксиді, көміртек оксиді, күкірт қышқылы, литий оксиді, темір (ІІ) сульфаты, темір (ІІІ) хлориді, кремний диоксиді, титан (ІV) сульфаты, қорғасын (ІІ) оксиді, қорғасын (ІV) сульфаты.
ә) висмут (ІІІ) хлориді, кобальт (ІІІ) гидроксиді, никель (ІІ) оксиді, калий гидроксиді, натрий гидроксиді, хром (ІІІ) оксиді, берилий хлориді, фосфор пентаоксиді, фосфор қышқылы, марганец хлориді, мыс (ІІ) гидроксиді, мыс (ІІ) сульфаты, азот (І) оксиді, натрий сульфаты, хлорсутек қышқылы.
2. Төмендегі қосылыстардың құрылымдық (графикалық) формулаларын өрнектеңіздер.
а) күкірт қышқылы, тұз қышқылы, фосфор қышқылы, фторсутек қышқылы, күкірт диоксиді, фосфор диоксиді, көміртек диоксиді, көміртек оксиді, көмір қышқылы, марганец қышқылы, селен қышқылы.
ә) бор оксиді, азот (І) оксиді, мырыш сульфаты, кальций гидроксиді, кремний диоксиді, темір (ІІ) хлориді.
3. Төменде келтірілген бейорганикалық қышқылдардың формулаларын жазып, олардың құрамындағы элементтердің валенттіліктерін анықтаңыздар.
а) күкірт қышқылы; ә) тұз қышқылы; б) азот қышқылы; в) хлор қышқылы;
г) бромсутек қышқылы; д) селен қышқылы.
4. Төменде келтірілген негіздердің салыстырмалы молекулалық массаларын және молярлық массаларын анықтаңыздар.
а) натрий гидроксиді; ә) калий гидроксиді; б) кальций гидроксиді;
в) берилий гидроксиді; г) темір (ІІ) гидроксиді; д) кобальт (ІІ) гидроксиді.
5. Массасы 18 грамға тең СО 2 газындағы зат мөлшерін есептеңіздер.
6. Массасы 42 грамға тең күкірт қышқылындағы зат мөлшерін есептеңіздер.
7. Төменде келтірілген тұздардың молярлық массаларын есептеңіздер және құрылымдық формулаларын жазыңыздар.
а) Алюминий сульфаты, калий сульфаты, натрий сульфаты, барий сульфаты;
ә) хром (ІІІ) хлориді, висмут (ІІІ) хлориді, титан (IV) хлориді, натрий хлориді.
б) натрий карбонаты, калий карбонаты, кальций карбонаты, магний карбонаты, литий карбонаты.
8. Төменде келтірілген кристаллогидраттардың молярлық массаларын есептеңіздер: MgSO 4 ∙7H 2 O, Na 2 CO 3 ∙10H 2 O, CuSO 4 ∙5H 2 O, Na 2 SO 4 ∙10H 2 O.
9. Калий гидроксиді мен тұз қышқылы арасында жүретін реакцияның теңдеуін жазыңыздар. Реакцияның типін атап көрсетіңіздер.
10. Күкірт қышқылы мен натрий гидроксидінің арассында жүретін реакцияның теңдеуін жазыңыздар. Реакцияның типін атап көрсетіңіздер.
11. Мырыш пен тұз қышқылының әрекеттесу реакциясының теңдеуін жазыңыздар, реакцияның типін атап көрсетіңіздер.
1. 2 Химиялық эквивалент. Эквиваленттер заңы
Эквиваленттің молярлық массасы дегеніміз - заттың 1 эквивалентінің г/мольмен алынған массасы - М (Э), өлшем бірлігі - г/моль.
Эквиваленттік фактор (f экв. ) - қышқылдық-негіздік реакцияларда сутектің 1 ионымен әрекеттесетін, ал тотығу-тотықсыздану реакцияларында 1 электронды беретін немесе қосып алатын заттың бөлігін көрсететін сан:
f экв (Х) = 1/n,
n - сутек атомдарының немесе электрондардың саны.
Эквиваленттің өлшем бірлігі − моль, эквиваленттік массаның өлшем бірлігі - г/моль.
Эквиваленттік фактордың өлшем бірлігі жоқ.
Эквиваленттер заңы: Бір-бірімен әрекеттесетін заттардың массалары (көлемдері) олардың эквиваленттік массаларына (көлемдеріне) тура пропорционал. Эквиваленттер заңының математикалық өрнегі:
m 1 /m 2 = M(Э 1 ) /М(Э 2 ), V 1 /V 2 = V(Э 1 ) /V(Э 2 )
Күрделі заттардың эквиваленттік массасын есептеу жолдары:
Оксид үшін: М(Э окс. ) =
M - молярлық масса;
В - металдың валенттілігі;
n - металл атомдарының саны.
Гидроксид үшін: М (Э гидроксид ) = М/n
М - молярлық масса;
n - гидроксил топтарының саны.
Қышқыл үшін:
М(Э қышқыл ) =
M - молярлық масса;
n - cутек атомдарының саны
Тұздар үшін: М (Э тұз ) =
M - молярлық масса;
В - металдардың валенттілігі;
n - металл атомының саны.
1. 3 Эквиваленттік массаны анықтау жолдары
а) Эквиваленттік массаны тура жолмен анықтау
Таза магнийді күйдіргенде оксид түзіледі. Мысал үшін 0, 506 г Мg-ді күйдірсе, 0, 840 г оксид түзіледі:
0, 506 г Мg → 0, 840 г МgО
2Мg + О 2 = 2МgО.
Оксид түзілу үшін жұмсалған оттектің массасын табамыз:
(0, 840 - 0, 506) = 0, 334 г.
Оттектің эквиваленттік массасы − 8 г/моль. Эквиваленттер заңы бойынша:
m 1 : m 2 = M(Э 1 ) : M(Э 2 ) .
Сонда: М (Э 2 ) = М (Э Mg ) = (m 2 : m 1 ) · M (Э 1 ) = 0, 506:0, 334∙8=12, 12 г/моль.
Жауап: магнийдің эквиваленттік массасы − 12, 12 г/моль.
ә) Формула бойынша: М (Э) , А - атомдық масса; В - валенттілік.
б) Аналитикалық әдіс.
Эквиваленті белгісіз заттың эквиваленті белгілі затпен түзілген қосылысына анализ жасаймыз, содан кейін эквиваленттер заңы бойынша эквиваленттік массаны есептейміз.
Мысал. Күміс хлоридін алып, хлор мен күміске анализ жасаймыз. Сонда 75, 26 % күміске 24, 74 % хлор келіп тұр. Күмістің эквиваленттік массасы 108, 88 г/моль-ге тең екендігі белгілі. Сонда эквиваленттер заңы бойынша:
m 1 : m 2 = M (Э 1 ) : M (Э 2 )
M (Э 2 ) = 107, 88 · 24, 74 / 75, 26 = 35, 46 г/моль
Жауап: 35, 46 г/моль - хлордың эквиваленттік массасы.
в) Сутекті ығыстыру әдісі.
Сутекті судан, қышқылдан ығыстыра алатын металдардың эквивалентінің массасын эксперимент арқылы табамыз.
Мысал. Темір мен күкірт қышқылы әрекеттескенде бөлінетін сутектің көлемін өлшейміз.
0, 0936 г Fe − 37, 3 мл сутек
х г Fe − 11200 мл сутек.
х = 0, 0936 · 11200 / 37, 3 = 27, 9 г/моль - темірдің эквиваленттік массасы.
Ескерту: сутектің көлемі V(H 2 ) = 37, 3 мл-ге тең, ол қалыпты жағдайда алынған.
г) Электр химиялық әдіс.
Тұз ерітіндісінің электролизін жүргіземіз. Электродта түзілген заттың массасын өлшейміз. Фарадей заңы бойынша:
I - ток күші, А;
τ - уақыт, с;
96500 кулон - Фарадей саны.
Мысалдар
1. HBr, H 2 O және NH 3 қосылыстарындағы элементтердің эквивалентін және эквиваленттерінің молярлық массасын табу керек.
Шешу жолы.
Берілген қосылыстарда сутек атомдарының 1 молімен бром атомының 1 молі, оттек атомының
 молі және азот атомының
молі және азот атомының
 молі қосылып тұр. Сондықтан бромның, оттектің, азоттың эквиваленттері, сәйкесінше, 1 мольге,
молі қосылып тұр. Сондықтан бромның, оттектің, азоттың эквиваленттері, сәйкесінше, 1 мольге,
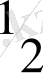 мольге,
мольге,
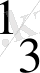 мольге тең.
мольге тең.
Енді осы элементтердің атомдарының мольдік массасына қарап, әрқайсысының эквивалентінің молярлық массасын табамыз:
М (Э бром ) = 79, 9 г/моль,
М (Э
оттек
) = 16 х
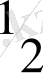 = 8 г/моль,
= 8 г/моль,
М (Э
азот
) = 14 х
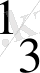 = 4, 67 г/моль.
= 4, 67 г/моль.
Ескерту: эквивалентті және эквиваленттің молярлық массасын табу үшін элементтің тек қана сутекпен қосылысы алынбайды. Ол үшін осы элементтің басқа бір эквиваленті белгілі элементпен қосылысын алуға болады.
2. 5, 6 г темір мен күкірт қосылғанда 8, 8 г темір сульфиді түзіледі. Күкірттің эквивалентінің молярлық массасы − 16 г/моль.
Темірдің эквивалентін және эквивалентінің молярлық массасын табу керек.
Шешу жолы. Берілген есепте темір сульфидіндегі 5, 6 г темірге 3, 2 г
күкірт келетіні көрініп тұр:
(8, 8 - 5, 6) = 3, 2 г
Эквиваленттер заңы бойынша әрекеттесуші заттардың массалары олардың эквиваленттерінің молярлық массаларына пропорционалды.
Сондықтан 5, 6 г темір -- 3, 2 г күкіртке эквивалентті,
М (Э Fe ) г/моль -- 16 г/моль.
Сонда:
= 28 г/моль.
Темір атомының мольдік массасы оның салыстырмалы атомдық массасына тең және мұның мәні − 56 г/моль. Темірдің эквивалентінің молярлық массасы (28 г/моль) оның атомының мольдік массасынан 2 есе кіші болғандықтан, темірдің 1 молінде 2 эквивалент бар деп айтамыз. Сондықтан темірдің эквиваленті
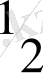 мольге тең.
мольге тең.
Эквиваленттер заңын қолдана отырып, әртүрлі қосылыстардың эквиваленттерінің молярлық массаларын табуға болады.
3. Ерітіндіде 16 г NaOH бар. Осы ерітіндіні күкірт қышқылымен нейтралдағанда түзілетін натрий гидросульфатының массасын табыңдар.
Шешу жолы. Натрий гидроксидінің эквивалентінің молярлық массасын табамыз:
 М(Э
NaОН
) = М(NaOH) /1 = 40 г/моль.
М(Э
NaОН
) = М(NaOH) /1 = 40 г/моль.
Cодан кейін мынадай пропорция құрамыз. Натрий гидроксидінің 1 эквивалентінің молярлық массасы 40 г болғанда, 16 грамға неше эквивалент сәйкес болады?
1 экв. --- 40 г х = 0, 4 моль.
х экв. --- 16 г
Натрий гидросульфатының эквивалентінің молярлық массасын табамыз:
М (Э
NaHSO
4
) =
 = 120 г/моль.
= 120 г/моль.
Эквиваленттер заңы бойынша әрекеттесетін заттардың эквиваленттік массалары олардың массаларына тура пропорционал. Сондықтан натрий гидроксидінің 0, 4 молі реакцияға түскендіктен пропорция құрамыз:
1 экв. NaOH - 1 экв. NaHSO 4 немесе:
40 г. - 120 г.
16 г. - х,
сонда түзілген гидросульфаттың массасы - 48 г.
Кейбір есептерде газ күйіндегі заттардың көлемі қолданылады. Сондықтан «эквиваленттік көлем» деген ұғымды пайдаланған жөн.
Қалыпты жағдайда заттың 1 эквивалентінің алатын көлемін эквиваленттік көлем деп атайды. Бір атомнан тұратын кез келген газдың мольдік көлемінде 1 моль атом болатынын және екі атомнан тұратын газдың мольдік көлемінде 2 моль атом болатынын ескере отырып, эквиваленттік көлемді табуға болады. Сутектің 22, 4 литрінде қалыпты жағдайда 2 моль сутек атомы болады. Ал сутектің эквиваленті 1 мольге тең болғандықтан, оның 22, 4 литрінде 2 эквиваленттік көлем болады, ал оның эквиваленттік көлемі - 11, 2 л/моль.
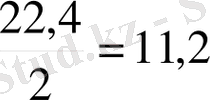 л/моль.
л/моль.
4. Белгісіз металдың эквивалентінің молярлық массасы − 28 г/моль. Қалыпты жағдайда осы металл қышқылдан 0, 7 л сутекті ығыстырып шығарады. Металдың реакцияға түскен массасын табу керек.
Шешу жолы. Сутектің эквиваленттік көлемінің 11, 2 л/моль екенін ескере отырып, пропорция құрамыз:
28 г (металл) -- 11, 2 л (сутек)
х г -- 0, 7 л
х
=
 = 1, 75 г. Металдың массасы - 1, 75 г.
= 1, 75 г. Металдың массасы - 1, 75 г.
ЕСЕПТЕР
1. 10, 00 г металл жанғанда 18, 88 г оксид түзіледі. Металдың эквиваленттік массасын анықтаңыздар.
2. Белгісіз металдың бірдей массасы 0, 400 г оттекпен және 6, 34 г галогенмен қосылыс түзеді. Галогеннің эквиваленттік массасын анықтаңыздар.
3.
2 л оттектің массасы 2, 8 г-ға тең. Магнийдің эквивалентінің
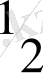 мольге тең екенін ескере отырып, 42 г магний жанғанда жұмсалатын оттектің көлемін табыңыздар.
мольге тең екенін ескере отырып, 42 г магний жанғанда жұмсалатын оттектің көлемін табыңыздар.
4. 6, 48 г металл 6, 96 г оксид немесе 7, 44 г сульфид түзеді. Металл мен күкірттің эквиваленттік массасын анықтаңыздар.
5. Қалыпты жағдайда 4, 17 г металл 0, 34 л оттекпен әрекеттеседі. Металдың валенттілігі екіге тең. Бұл қандай металл және оның атомдық массасы қандай?
6. Мышьяктың бірінші оксидінде 65, 2%, ал екінші оксидінде 75, 7% мышьяк бар. Осы оксидтердегі мышьяктың эквиваленттік массасын анықтаңыздар.
7. Белгісіз металдың 1, 00 грамы 8, 89 грамм броммен және 1, 78 грамм күкіртпен қосылыс түзеді. Күкірттің эквиваленттік массасы 16 г/моль екенін ескере отырып, бромның және металдың эквиваленттік массасын анықтаңыздар.
8. Хлордың эквиваленттік массасы − 35, 5 г/моль, мыс атомының мольдік массасы − 63, 5 г/моль, ал мыс хлоридінің эквиваленттік массасы − 99, 5 г/моль. Мыс хлоридінің формуласы қандай?
9. 16, 8 г металды еріту үшін 14, 7 г күкірт қышқылы қажет. Металдың эквиваленттік массасын және қалыпты жағдайда бөлінген сутектің көлемін анықтаңыздар.
10. 1, 80 г металл оксидін тотықсыздандыру үшін 883 мл сутек жұмсалады. Металдың және оксидтің эквиваленттік массасын есептеңіздер.
11. Белгісіз металдың эквиваленттік массасы 27, 9 г/моль екенін және осы металл қышқылдан 700 мл сутекті бөліп шығаратынын ескере отырып, реакцияға түскен металдың массасын есептеңіздер.
12. Кальцийдің эквиваленттік массасы − 20 г/моль. 1, 60 г кальций және 2, 61 г мырыш қышқылдан сутектің бірдей көлемін бөліп шығарады. Мырыштың эквиваленттік массасын есептеңіздер.
13. Күкірт және фосфор қышқылдарының молекулалық массалары бірдей. Бейтараптану реакциясының нәтижесінде сульфат және дигидрофосфат түзіледі. Негіздің бірдей мөлшерін бейтараптандыру үшін жұмсалған қышқылдар мөлшерлерінің арақатынасы қандай?
14. Мыс екі түрлі оксид түзеді. Бірінші оксид түзілгенде мыстың белгілі бір мөлшеріне жұмсалатын оттектің көлемі, екінші оксид түзілгенде жұмсалатын оттектің көлемінен екі есе артық. Мыстың екі оксидтегі валенттіліктерінің арақатынасын анықтаңыздар.
15. Фосфор қышқылы гидроксидпен әрекеттескенде Na 2 HPO 4 түзіледі. Фосфор қышқылының осы реакциядағы эквиваленттік массасы қандай?
16. 4, 90 г қышқылды нейтралдау үшін 4, 00 г натрий гидроксиді жұмсалады. Қышқылдың эквиваленттік массасы қандай?
17. Белгісіз заттың 2, 875 грамы 1, 375 грамм хлорлы сутекпен әрекеттескенде 8, 80 грамм тұз түзіледі. Осы заттың және тұздың эквиваленттік массасы қандай?
18. Қалыпты жағдайда 0, 752 г алюминий қышқылмен әрекеттескенде 0, 936 л сутек бөлініп шықты. Алюминийдің эквиваленттік массасының 8, 99 г/мольге тең екенін ескере отырып, сутектің эквиваленттік көлемін есептеңдер.
19. Химиялық элементтердің эквиваленті қандай шамаға тәуелді?
а) валенттілікке тәуелді;
ә) әрқашанда тұрақты шама.
20. Осы формулалардың қайсысы эквиваленттер заңын дұрыс өрнектейді?
а)
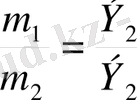 ; б) m
1
∙M(Э
2
) = m
2
∙M(Э
1
) .
; б) m
1
∙M(Э
2
) = m
2
∙M(Э
1
) .
ә) m 1 Э 2 = m 2 Э 1 .
21. Фосфор құрамы әртүрлі екі хлорид түзеді. Осы екі хлоридте қай элементтің эквиваленті тұрақты болып қала береді?
а) фосфордікі; ә) хлордікі.
22. Осы келтірілген көлемдердің ішінде сутек пен оттектің қандай көлемдері қалыпты жағдайға сәйкес келеді?
а) 11, 2 л О 2 және 22, 4 л Н 2 ;
ә) 11, 2 л О 2 және 11, 2 л Н 2 ;
б) 5, 6 л О 2 және 11, 2 л Н 2 .
23. Металдың эквиваленттік массасы − 12 г/моль. Осы металдың оксидінің эквиваленттік массасы қандай?
а) 24 г/моль; ә) анықтауға болмайды; б) 20 г/моль.
24. Белгісіз металдың эквиваленттік массасы оттектің эквиваленттік массасынан екі есе артық. Сонда оксидтің массасы металл массасынан неше есе артық?
а) 1, 5 есе; ә) 2 есе; б) 3 есе.
25. Күкірт S 2 Cl 2 және SCl 2 деген хлоридтер түзеді. SCl 2 -де күкірттің эквиваленттік массасы - 16 г/моль. Күкірттің S 2 Cl 2 -дегі эквиваленттік массасы қандай?
26. СrCl 3 және Cr 2 (SO) 3 деген тұздарда хромның эквиваленті бірдей бола ма?
27. FeCl 2 және FeCl 3 деген тұздарда темірдің эквиваленті бірдей бола ма?
1. 4 Химияның негізгі заңдары
Зат массасының және энергияның сақталу заңы: 1758 жылы М. В. Ломоносов табиғаттың негізгі заңын шығарды. Бұл зат массасының сақталу заңы: Химиялық реакцияға қатысатын заттардың массасы реакция нәтижесінде түзілетін заттардың массасына тең.
Эйнштейн теңдеуі. Масса мен энергияның байланысы: E = mc 2 , бұл формулада Е - энергия, m - масса, с - жарық жылдамдығы.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz