IV тобының p-элементтері (C, Si, Ge, Sn, Pb): құрылымы, физико-химиялық қасиеттері және қолданылуы


Қазақ Ұлттық қыздар педогогикалық университеті. ҚАеҚ

СӨЖ
Тақырыбы: 4-ші топтың p-элементтері.
Орындаған:Кеңесова Жібек Азамат қызы
Қабылдаған: Азимбаева Гулбайра Ералиевна
Алматы қаласы 2022 ж
Жоспар
- Кіріспе
- Негізгі бөлім
2. 1 Жалпы сипаттамасы
2. 2 Көміртегі
2. 3 Көміртегі оксидтері, көмір қышқылы және оның тұздары
2. 4 Қөміртегінің және оның қосылыстарының қолданылуы
2. 5 Кремний
2. 6 Германий
2. 7 Қалайы
2. 8 Қорғасын
III. Қорытынды
Ⅳ. Қолданылған әдебиеттер
Кіріспе
Д. И. Менделеевтің периодтық жүйесінің IV тобының негізгі топшасын бес элемент - көміртегі, кремний, германий, қалайы және қорғасын құрайды. Атомның радиусы көміртегіден қорғасынға дейін ұлғаюына байланысты атомдардың мөлшері ұлғаяды, электрондарды қосу қабілеті, демек, металл емес қасиеттері әлсірейді, ал электрондарды беру жеңілдігі артады. Металлдық қасиеттер германийде қазірдің өзінде көрінеді, ал қалайы мен қорғасында олар металл еместерге қарағанда басым. Осылайша, көміртегі мен кремний бейметалдарға, германий металдарға да, бейметалдарға да, қалайы мен қорғасын металдарға жатады.
Германий сыртқы түрі бойынша металдарға ұқсас, бірақ сынғыш. Кремний сияқты, германий жартылай өткізгіштерге жатады, яғни электр тогын өткізбейтін заттар немесе оқшаулағыштар (көптеген бейметалдар) мен өткізгіштер (металдар) арасында аралық орынды алатын заттарға жатады. Жартылай өткізгіш ретінде германий радиоэлектроникада кеңінен қолданылады.
Қалайы мен қорғасыннан түзілген қарапайым заттар, кіші топтың келесі элементтері қазірдің өзінде металдарға тән барлық қасиеттерді көрсетеді: металл жылтырлығы, жоғары электр және жылу өткізгіштік, пластикалық. Әдетте қалайы мен қорғасын +2 және +4 тотығу дәрежесін көрсететін қосылыстар түзеді. IV топтың негізгі топшасы элементтерінің атомдарының сыртқы энергетикалық деңгейі төрт электроннан тұрады: екі жұп s-электрон және екі жұптаспаған p-электрон. Сондықтан қосылыстардың түзілуінде бұл элементтердің атомдары ең жоғары тотығу дәрежесін +4 көрсете отырып, барлық төрт электронды бере алады немесе -4 тотығу дәрежесін көрсете отырып, төрт электронды қабылдай алады.
2. 1 Жалпы сипаттамасы
Төртінші негізгі топшаға кәміртегі С, кремний Si, германий Ge, қалайы Sn, қорғасын Pb жатады. Бастапқы екі элемент-көміртегі мен кремний бейметалдарға, ал қалғандары металдарға жатады.
Ⅳ А тобы элементтерінің тұрақты шамалары
Элементтердің реттік нөмірлерінің өсуіне байланысты олардың атомдарының және иондарының радиуыстары да өседі және соған сәйкес иондану энергиялары кеміп олардың металдық қасиеттері артады.
Бұл элементтердің химиялық байланыс түзуге екі s-электрондары және екі дара р-электрондары қатысады. Сондықтан олар 4 электрон қосып алып тотығу дірежелерін 4- дейін кеміте алады.
Э⁰+4е=Э⁴⁻
Сонымен қатар бұл элементтер төрт электрон беріп жіперіп тотығу дәрежелерін 4+ дейін өсіре алады:
Э⁰-4е=Э⁴⁺
Формуладан элементтердің екі дара р-электрондары бар екенін көруге болады. Сондықтан олардың қалыпты жағдайдағы валенттілігі екіге тең. Қозған кезде элементтердің s-орбиталындағы жұп электрондарының біреуі бос тұрған р-орбиталына көшеді де валенттіліктерінің саны 4-ке дейін өседі. Химиялық қосылыстарда топша элементтері 4 +, 2 +, 4 - тең тотығу дәрежелерін көрсетеді. Металдармен және сутекпен қосылыстарында элементтердің (қорғасыннан басқаларының) тотығу дәрежелері 4 -, ал күшті металеместермен қосылыстарындағы тотығу дәрежелері 4 + болады.
Төртінші негізгі топша элементтерінің қатысуымен түзілген молекулалардыц пішіндері тетраэдр тәрізді болады .
Топша элементтері (қорғасыннан басқасы) сутекпен ЭН4 типтес қосылыстар түзеді: СН4 - метан, SiН 4 - силан, GeН4 - германсутек, SnН 4 - станнан. СН4- SnН4 бағытында қосылыстардың беріктігі кемиді.
Топша элементтері оттекпен ЭО, ЭO2 типтес қосылыстар түзеді. СО, SіО тұз түзбейтін оксидтер, ал GеО, SnО, РbО амфотерлі оксидтер. ЭO2 типтес қосылыстардың барлығы да қышқылдық оксидтер. Бүл оксидтерге Н2ЭO3 типтес қышқылдар сәйкес келеді.
Топша бойынша элементтердің реттік нөмірлерінің өсуіне байланысты металеместік қасиеттері кемиді де, металдық қасиеттері арта береді. СН4-тен Sn Н 4 сутекті қосылыстардың тұрақтылығының кемуі осы қасиеттерінен түсіндіріледі.
Электрондық конфигурациясы осы элементтердің ұқсас, барлығы құрамында 4 электрона сыртқы қабатындағы ns 2 np 2 :
С - 2s 2 2p 2
Si - 3s 2 3p 2
Ge - 4s 2 4p 2
Sn - 5s 2 5p 2
Pb - 6s 2 6p 2
Көміртек және кремний
2. 2 Көміртегі
Табиғатта таралуы. Жер қыртысының 0, 14%-і көміртектің үлесіне тиеді. Көміртек табиғатта бос күйінде алмаз, графит түрінде, қосылыс күйінде бордың, мрамордың СаСОз магнезиттің МgСОз, доломиттің СаСO3*МgСO3, сидериттің ҒеСO3, малахиттің Сu( OН ) 2-СuСO3 қүрамына кіреді. Ауада 0, 03% шамасында көміртек (IV) оксиді болады. Көміртек қосылыстары тірі табиғаттың негізгі құрамды бөлігі. Сондықтан көміртек тас көмірдің, мұнайдың, табиғи газдардың қүрамында болады.
Физикалық қасиеттері. Көміртек табиғатта бар түрінде бірнеше аллотропных модификациялары: алмаз, графит, карбин, фуллерен.
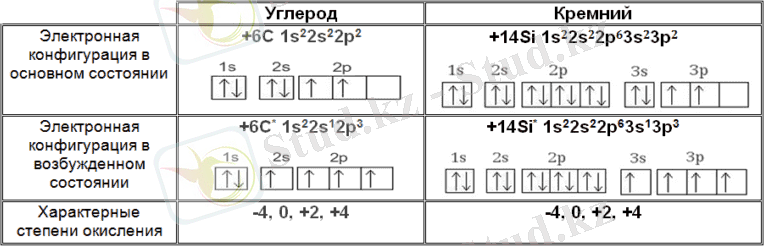
Алмаз - бұл түрлендіру көміртегі атом кристалдық тормен. Алмаз - ең қатты минералды кристаллическое вещество, мөлдір, нашар өткізеді, электр тогы мен жылу. Атомдар көміртек алмазе күйде sp 3 -будандастыруды.
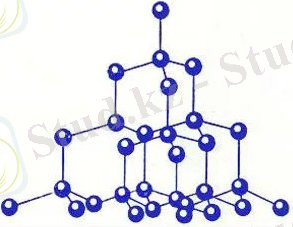

Графит - бұл аллотропная модификациясы, онда атомдар көміртек күйде sp 2 -будандастыруды. Атомдары байланысты жазық қабаттар тұратын шестиугольников ретінде бал ара ұялары соты. Қабаттар удерживаются бір-бірімен әлсіз байланыстары бар. Бұл неғұрлым тұрақты қалыпты жағдайларында аллотропная түрлендіру көміртегі.
Графит - жұмсақ зат сұр-сұрғылт түсті, металл, блеском. Жақсы өткізеді электр тогы. Майлы сезіледі.
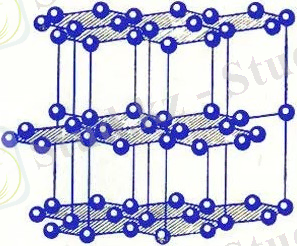

Карбин - зат құрамында көміртек атомдары орналасқан, sp-будандастыруды. Тұрады тізбек және циклдар, олардың атомдары көміртегі қосылған, қосарланған және тройными байланыстары бар. Карбин - мелкокристаллический порошок сұр түсті.
[=C=C=C=C=C=C=] n немесе [-C≡C-C≡C-C≡C-] n
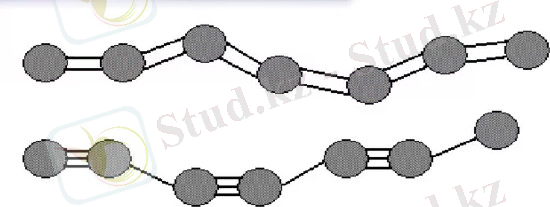

Фуллерен - бұл жасанды түрде алынған модифицикация көміртегі. Молекуласы фуллерена - дөңес многогранники Бастап 60 , С - 70 және т. б. Многогранники құрылды бес - және шестиугольниками, төрінде орналасқан атомдары көміртек.
Фуллерены - қара заттар металл блеском, қасиеттері бар жартылай өткізгіштер.
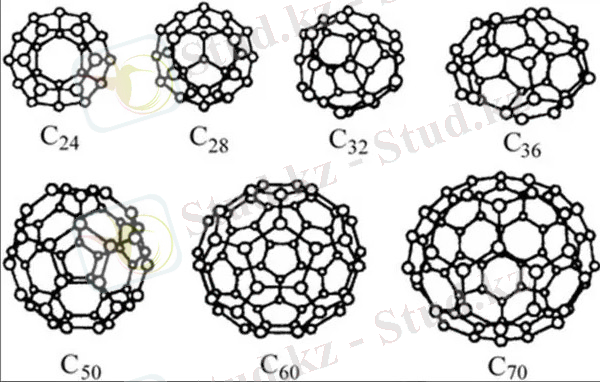
Табиғаттағы көміртек кездеседі түріндегі қарапайым заттар (алмаз, графит), сондай-ақ түрінде күрделі қосылыстар (органикалық заттар - мұнай, табиғи газ, тас көмір, карбонаттар) .
Химиялық қасиеттері. Көміртегінің барлық түрқзгерістері-аморфты көміртегі қыздырғанда алмаз жоғары температурада (700-800) оттегімен әрекеттесіпоксидтер түзеді:
2C+O2=2CO
C+O2=CO2
Көміртегінің күкіртпен әрекеттесуі жылу сіңіре жүретін эндотермиялық реакция:
C+S=CS2-63
Көміртегі тікелей фтормен әрекеттеседі, ал оның басқа гологендермен қосылыстарын жанама жолмен алады.
C+F2=CF2
CS2+2Cl2=CCl4+2S
Электр разряды кезінде көміртегі азотпен тікелей әрекеттесіп улы газ циан түзеді:
2C+N2=C2N2
Циан суттегімен әрекеттесіп өте улы қышқылын түзеді
C2N2+H2=2HCN
Цианидтерді күкіртпен қосып балқыту арқылы родан қышқылының умыз тұздары роданидтерді алады:
KCN+S=KCNS
Көміртегі жоғары температурада металдармен әрекеттесіп карбидтер түзеді:
Ca+2C=CaC2
4Al+3C=Al4C3
Карбидтер қышқылдармен немесе сумен әрекеттесіп әр түрлі газдар бөліп шығарады:
CaC2+2H2O=Ca(OH) 2+C2H2
Al4C3+12H2O=4Al(OH) 3+3CH4
Сапалық реакциялар
- Табукарбонат-иондар CO32-- болады, өзара іс-қимыл тұздар-карбонаттар күшті қышқылдар. Бұл ретте бөлінеді көмірқышқыл газы - түссіз және иіссіз газ, жоқ қолдаушы жануы:
CaCO 3 + 2HCl → CaCl 2 + H 2 O + CO 2 ↑
- Сапалық реакциякөмірқышқыл газы CO2- буланған ізбесті су арқылы өтуі кезінде оған көмірқышқыл газ:
CO 2 + Ca(OH) 2 → CaCO 3 ↓ + H 2 O
Одан әрі өтуі көмірқышқыл газының тұнба CaCO 3 ериді:
CaCO 3 + CO 2 + H 2 O → Ca(HCO 3 ) 2
- Көмірқышқыл газы СО2жануды қолдамайды.
- Улы газ CO жаныпкөкшіл жалынмен.
Өзара іс-қимыл көміртегі қарапайым заттармен
С оттегімен
Жанып жеткіліксіздігі оттегі білімі бар улы газ:
2C + O 2 = 2CO
бұл избытке оттегі - білімі бар көмірқышқыл газының:
C + O 2 = CO 2
С галогенами (F, Cl, Br, I)
Көміртек жауап бабына фтор дейін қыздырғанда 900ºС білімі бар фторидін көміртек (IV) :
C + 2F 2 → CF 4
Раскаленный көміртек жүргізуден басқа галогенами:
C + 2Cl 2 → CCl 4
Сутегімен
Қыздырғанда катализатордың қатысуымен (Ni) көміртек әрекеттеседі сутегімен білімі бар метан:
С + 2Н 2 → СН 4
Күкіртпен
Қатты қыздырылған көміртек әрекеттеседі сұр білімі бар күкірт көміртегін:
C + 2S → CS 2
С азотпен
С азотпен көміртек жауап әрекеті кезінде электр разрядының құра отырып, дициан:
2С + N 2 → N≡C-C≡N
С көміртегімен
Қыздыру кезінде 2000-ға жуық туралы С кремний реакцияға түскенде көміртегімен білімі бар кремний карбиді (карборунда) :
C + Si → SiC
Фосформен
Емес, өзара іс-қимыл жасайды
Металдармен
Реакцияларда белсенді металдармен көміртек ретінде окислителя құра отырып, карбидтер:
4C + 3Al → Al 4 C 3
2C + Ca → CaC 2
Өзара іс-қимыл күрделі заттармен
Сумен
Өтуі кезінде су буларының арқылы раскаленный уголь құрылады, көміртек оксиді (II) және сутегі:
C + H 2 O = CO + H 2
С кислотами
Углерод как восстановитель взаимодействует с кислотами-окислителями:
С концентрированной азотной кислотой
3C + 4HNO 3 = 3CO 2 + 4NO + 2H 2 O
C концентрированной серной кислотой:
С+2H 2 SO 4 =CO 2 +2SO 2 +2Н 2 О
Тұздармен
Бұл расплавах KNO 3 және NaNO 3 уатылған көмірді қарқынды жинақталады:
5С + 4KNO 3 = 2К 2 СО 3 + СҚА-НЫҢ 2 ↑+ 2N 2 ↑
С оксидами
Көміртегі өзара іс-қимыл жасайды көптеген негізгі және амфотерными оксидами, білімі бар металл және улы газ:
C + 2ZnO → 2Zn + CO
4С + Fe 3 O 4 → 3Fe + 4CO
Алу металл оксидтерінің көмегімен көміртек және оның қосылыстары деп атайды пирометаллургией .
Өзара іс-қимыл кезінде көміртек оксидами белсенді металдар карбидтер түзіледі:
3С + СаО → СаС 2 + СО
9С + 2Al 2 O 3 → Al 4 C 3 + 6CO
2. 3 Көміртегі оксидтері, көмір қышқылы және оның тұздары
АлынуыӨнеркәсіпте (домна пештерінде) кокс жанып, көмірқышқыл газына айналады. Ал оттегі жетіспегенде көмірмен әрекеттесіп көміртек (II) оксидін түзеді.
Химиялық қасиетіС + О 2 = СО 2
СО 2 + С = 2СО
2С + О 2 = 2CO
Ауадан сәл жеңіл, түссіз улы газ, суда нашар ериді. Иіс газы деп аталады. Қалыпты жағдайда сумен әрекеттеспейді.
CO тұз түзбейтін оксид, көбінесе жоғары температурада тотықсыздандырғыш ретінде домна пешінде, органикалық, синтезде қолданылады. Қыздырғанда металл оксидтерінен металды тотықсыздандырады.
CuO + CO = Cu + СО 2
SiО 2 + 2СО = Si + 2CО 2
Көмір (II) оксиді - ауада көгілдір жалынмен жанатын газ.
2СО + О 2 = СО 2
Көміртек (IV) оксиді
Көміртек (IV) оксиді - СО 2 , түссіз, иіссіз, ауадан ауыр, жануды қолдамайтын, жануарлар мен адамдардың тыныс алуы нәтижесінде бөлінетін газ (ауада 0, 039%) . СО 2 - көмірқышқыл газы ауадан ауыр болғандықтан (D (ауа) = 1, 52) жертөлелерде, шұңқырларда, шахталарда, құдықтарда жиналып қалады. Сол жерлерде жүргенде сақтану ережелерін қолданады. Сондай-ақ белмелерді де жиі желдету қажет. Ол оңай сұйыққа айналады (5, 7 мПа қысымда, 20°С), ал - 78, 5°С қатты күйге де (құрғақ мұз) айнала алады.
Құрылымдық формуласы О = С = О
АлынуыХимиялық қасиеттері1) жану реакциясы
С + О 2 = СО 2
2) карбонаттар айырылғанда
СаСО = СО 2 ↑ + СаО
3) зертханада
СаСО 3 + 2HCl = СO 2 ↑ + СаСl 2 + Н 2 O
4) негіздік тұздар айырылғанда
(CuОH) 2 CО 3 = СО 2 + 2СuО+ Н 2 О
5) органикалық заттар жанғанда
СН 4 + 2О 2 = СО 2 + 2Н 2 О
СО 2 - қышқылдық оксид, оған көмір қышқылы сәйкес келеді. Мынадай реакцияларға түседі:
1) негіздік оксидпен әрекеттесіп тұз түзеді:
СО 2 + СаО = СаСО 3
2) негізбен әрекеттесіп тұз бен су түзеді:
СО 2 + Са(ОН) 2 = СаСО 3 ↓ + Н 2 О
3) кальций карбонатының судағы ерітіндісіне көмірқышқыл газын артық мөлшерде жібергенде тұнба жойылып, ерімтал қышқыл тұз түзіледі:
СаСО3 + Н 2 О + СО 2 → Са(НСО 3 ) 2
4) сумен әрекеттескенде әлсіз, тұрақсыз көмір қышқылын береді:
СО 2 +Н 2 О ↔︎ Н 2 СО 3
Кальций гидроксиді, ізбес суы, әк сүті, көмірқышқыл газына сапалық реакция жасайтын реагент болады (СаСО 3 ақ тұнбаның түзілуі) .
Са(ОН) 2 + СО 2 = СаСО 3 ↓ + Н 2 О
Көмір қышқылы
Көміртегі (Ⅳ) оксиді суда еріп аз мөлшерде әлсіз, тұрақсыз көмір қышқылын түзеді:
CO2+H2O=H2CO3
Көмір қышқылы екі негізді болғандықтан екі сатыда диссоциацияланады:
H2CO3=H+HCO3=2H+CO3
Екі негізді болғандықтан көмір қышқылы екі қатар тұздар: орта тұздар - карбонаттар (NaCO3, CaCO3), қышқыл тұздар - гидрокарбонаттар (NaHCO3, Ca(HCO3) 2т. б. ) түзеді.
Карбонаттардың ішінде калий, натрий, аммоний тұздары суда жақсы ериді. Гидрокарбонаттардың барлығы (натрий гидрокарбонатынан басқасы) суда жақсы ериді.
Судағы ерітінділерінде карбонаттар гидролизденіп сілтілік реакция көрсетеді:
CO3+HOH=HCO3+OH р Н > 7
Карбонаттар (сілтілік металдар тұздарынан басқасы) және гидрокарбонаттар қыздырғанда ыдырайды:
MgCO3=MgO+CO2
Mg(HCO3) 2=MgO+2CO2+H2O
Көмір қышқылының маңызды тұздарына СаСO3, К2СО3, Na2СОз, NаНСОз жатады. Әсіресе өнеркәсіпте алынатын натрий карбонатының немесе соданың маңызы зор.
Сода кеп мөлшерде аммиакты әдіспен алынады. Бүл әдіс 146 бойынша қаныққан натрий хлоридының ерітіндісі арқылы алдымен аммиак, онан соң көміртек (IV) оксидііл кысым аркылы өткізеді. Бұл заттардың арасында мынадай реакциялар жүреді:
NH3+H2O+CO2=NH4HCO3
NH4HCO3+NaCl=NaHCO3+NH4Cl
Түзілген суда нашар еритін натрий гидрокарбонатын бөліп алып қыздырғанда ол мына теңдеу бойынша ыдырайды:
2NaHCO3=Na2CO3+CO2+H2O
Түзілген натрий карбонатын кальцийленген сода деп атайды. Сода өндіру химия өндірісінің өте ірі салаларының бірі.
Калий карбонатын бұл әдіспен алуға болмайды, өйткені калий гидрокарбонаты суда ерігіш. Калий карбонатын (сақарды) калий хлоридының ерітіндісін электролиздегенде түзілетін калий гидроксидіне көміртек (IV) оксидін сіңіру арқылы алады:.
2KOH+CO2=K2CO3+H2O
Көмір қышқылының барлық тұздары күшті қышкылдармен әрекеттесіп көміртек (IV) оксидін бөліп шығаратын қасиетін оларды анықтауға қолданады:
2KHCO3+H2SO4=K2SO4+2H2O+2CO2
2. 4 Қөміртегінің және оның қосылыстарының қолданылуы
Қолдану көміртек және оның қосылыстары. Өнеркәсіп көміртек (графит) жиі ретінде пайдаланылады майлау. Сонымен қатар негізінде графиттен жасайды деп аталатын композициялық материалдар, атап айтқанда, углепластики, онда графитті талшықтар орналасқан матрицасы эпоксидті шайыр. Коррозиялық графит пайдаланылады судостроении.
Бұл композициялық материалдар кеңінен қолданылады авиациялық және ғарыштық техника. Өйткені, басқа беріктігі олар жеңіл. Салыстыру жеткілікті тығыздығы графит, р=2, 3 г/см3, тығыздығы «жеңіл» алюминий р=2, 7 г/см3, және одан темір, р=7, 9 г/см3, көз жеткізу үшін құндылықтар осы қасиеттері. Және, әрине, барлық белгілі жауһары пайдаланылады зергерлік өнеркәсіпті дайындау үшін түрлі әшекейлер, сондай-ақ кеңінен қолданылады әр түрлі өнеркәсіп салаларында пайдаланылатын, олардың қасиеті, беріктігі жоғары. Жазу сипаттама элементтің және оның қосылыстары негізге ала отырып, электрондық құрылысының атом физикасы. Рефераттар химия пәні бойынша қандай типке жатқызады реакциясын білім көміртек беспла. Сипаттамасы көміртегі салыстыру бойынша свойству қарапайым вещства тобы бойынша және кезең. Неге көміртек тотығы және көмір қышқылын жоқ жатқызады органикалық заттар. Атом қасиеттері көміртегі негізінде құрылыстар атом Ленин Ресей Ленин Ресей. Заттар оған органикалық қосылыстарға бірақ құрамында көміртек. Как посчитать тығыздығы қосылыстар егер белгілі тығыздығы әрбір элемент. Сипаттамасы көміртек оның қосылыстары бойынша плложению периодтық жүйесі. Қандай заттар жатады углеродам жоқ ұшпа органикалық қосылыстар. Баяндама химия генетикалық байланыс әр түрлі сыныптар қосылыстар. Болып табылады көміртек тотығы және көмір қышқылы, органикалық заттармен. Ерекшеліктері атом құрылысы көміртек және білім беру және химиялық байланыстар. Өзара іс-қимыл оттегінің көміртегімен жатады реакциялар қосылыстар. Неге біз заттар саны берем сол үшін де, және осындай үшін. Құрылысы мен қасиеттері атом көміртек определившие оның рөлі табиғатта.
2. 5 Кремний
Кремнийді 1811 жылы француз ғалымдары Гей-Люссак пен Тенар алғаш рет ашқан.
Табиғатта таралуы . Кремний табиғатта көп тараған элемент. Жер қыртысының 27, 6%-і кремнийдің үлесіне тиеді. Ол табиғатта тек қосылыстар түрінде кездеседі. Кремний қосылыстарының ішіндегі аса маңыздысы кремнезем SiO2. Кремнезем екі түрде кездеседі. Кристалды түрін кварц, ал аморфты түрін трепел дейді.
Кремний табиғатта әр түрлі силикаттар түрінде кең тараған. Оларға каолин Al2O3*2H2O, дала шпаты K2O*Al2O3*6SiO2, асбест 3MgO*2SiO2*2H2O, слюда K2O*3Al2O3*6SiO2*2H2O т. б. жатады.
Физикалық қасиеттері. Кремний кристалды және аморфты күйде кездеседі. Таза кристалды кремнийдің өзіне тән жалтыры бар, морт, шыныда із қалдырады. Кристалдық торы алмаздың торына ұқсас. Балқу температурасы 1423°С, тығыздығы 2, 4 г/см3. Кристалды кремнийдің электр өткізгіштік қасиеті бар. Өте таза кремний жартылай өткізгіш ретінде техникада қолданылады. Басқа жартылай өткізгіштермен салыстырғанда кристалды кремний қышқылдардың әсеріне төзімді. Аморфты кремний-қоңыр түсті ұнтақ зат, тығыздығы 2, 33 г/см3.
Химиялық қасиеттері . Химиялык қосылыстарда кремний 4 -, 4 + тотығу дәрежелерін көрсетеді. Кремний қалыпты температурада инертті элемент. Кристалды түріне қарағанда аморфты кремнийдің химиялык активтігі жоғары болады.
Жоғары температурада (400-2000°С) кремний көптеген металеместермен: хлормен, оттекпен, күкіртпен, азотпен, көміртекпен әрекеттесіп сәйкес қосылыстар түзеді:
Si+2Cl2=SiCl4
Si+O2=SiO2
3Si+2N2=Si3N4
Si+C=SiC
Кремнийдің көміртекпен қосылысы SіС карборунд деп аталады. Ол құрылысы және қаттылығы жөнінен алмазға жақын.
Кремний қышқылдарда ерімейді. Ол тек фторсутекпен реакцияға түседі:
Si+4HF=SiF4+2H2
Кремний сілтілер ерітіндісінде жақсы ериді:
Si+2NaOH+H2O=Na2SiO3+2H2
Кремний қыздырғанда кейбір металдармен әрекеттесіп силицидтер деп аталатын қосылыстар түзеді. Мысалы, магний мен кремнийдің ұнтақтарын қыздырғанда магний силицийді түзіледі:
2Mg+Si=MgSi
Магний силициді судың немесе қышқылдардың әсерінен ыдырап кремнийсутек түзеді:
Mg2Si+4H2O=2Mg(OH) 2+SiH4
Mg2Si+2H2SO4=2MgSO4+SiH4
Силанның көмірсутектерінен айырмасы ол ауада өздігінен жанып кремний (IV) оксиді мен су түзеді:
SiH4+2O2=SiO2+2H2O
А л ы н у ы. Кремнийді техникалық мақсаттар үшін арнаулы электр пештерінде кварцты кокспен жоғары температурада тотықсыздандыру арқылы алады:
SiO2+C=Si+CO2
Кремнийді лабораторияда кремнеземді магниймен тотықсыздандыру арқылы алады:
SiO2+2Mg=Si+2MgO
Қ о л д а н ы л у ы. Бос күйіндегі кремнийдің тотықсыздандырғыштық қасиетін темірді тотықтарынан бөлу үшін пайдаланады. Осы процесс кезінде кремний тотығып шлактың құрамына кіреді. Кремнийді қосқанда болаттың беріктігі, серпімділігі, коррозияға төзімділігі артады. Кремнийдің темірмен құймасы - ферросилиций қышқылға өте төзімді болады. Ол химия өнеркәсібінде әр түрлі аппараттар жасауға қолданылады. Өте таза кремний жартылай өткізгіш ретінде фотоэлементтерде, айнымалы токты тұрақты токқа айналдыратын түзеткіштерде, ғарыш ракеталарында, жасанды жер серіктерінде, күн сәулесі батареяларын жасауға қолданылады.
2. 6 Германий
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz