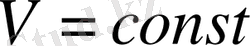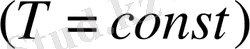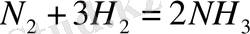Химиялық термодинамика: жүйелер, параметрлер, термохимия және энтропия


Дәрістер кешені
1-дәріс. Термодинамикалық жүйелер және олардың жіктелуі
Химиялық өзгерістерді зерттеуде негізінен екі тәсіл қолданылады. Оның бірінші тәсілі термодинамикалық тәсіл, ал екіншісі кинетикалық тәсіл.
Термодинамикалық тәсіл арқылы реакцияның жүру мүмкіншілігін және бағыттары анықталады.
Кинетикалық тәсіл реакцияның механизмін және жылдамдығын қарастырады.
Химиялық термодинамиканың әдістері арқылы реакцияныңқандай шартты жағдайларда, қандай бағытта жүретіні анықталады. Сонымен қатар реакцияның энергетикалық балансы, реакцияның өнімдерінің мөлшерін және қысым мен температураның химиялық тепе - теңдікте қалай әсер ететінін есептеуге болады.
Термодинамикалық тәсілдің объектісі термодинамикалық жүйе дейміз. Жүйе деп қоршаған ортаның (окружающая среда) ойша бөлініп алынған материалдың объектілердің жиынтығын айтамыз. Жүйе арқашан қоршаған ортадан нақтылы шекарамен бөлінген. Шекара дегеніміз - шынайы физикалық жазықтықтар немесе қабырғалар болуы мүмкін. Сол сияқты шекара ролін болжамалы математикалық жазықтықтарда атқара алады.
Жүйенің қоршаған ортаданқорғану дәрежесіне байланысты оңашаланған жабық және ашық жүйелерді қарастырады.
Қоршаған ортамен мүлде әрекеттеспейтін жүйені оңашаланған жүйе дейміз. Қоршаған ортамен өзін құрайтын бөлшектермен (атом) айырбастаспайтын бірақ сол ортамен жылу алмасу, механикалық жұмыс, алмасу жағдайында тұратын жүйелерді жабық жүйе дейміз.
Ал егер жүйе қоршаған ортамен бөлшектердің айналасында болса, ашық жүйелер дейміз.
2-дәріс. Жүйенің интенсивті және экстенсивті параметрлері
Парциалдық (меншіктік) мольдік мөлшері.
Жүйенің кейбір қасиеттері оның құрамындағы фазалардың мөлшеріне, оқуды көптігіне бағынбайды. P, T, p - осындай жүйелік қасиеттерді интенсивтік параметрлер. Сонымен қатар m, U -ішкі энергия, Н - энтальпия, S - энтропия осы сияқты жүйелер фазалардың аумағына, азды - көптілігіне тәуелді бұл экстенсивтік параметрлер.
Көптеген жағдайда экстенсивті параметрі жүйені қарастырып отыратын экстенсивті параметрлердің қосындысына тең болады. Осындай жағдай идеалды арласқан газдар ие болмаса идеалды ерітінділер қоспасына тән. Жаңағыдай идеалды жүйелердің көлемі үшін мынадай теңдеулер жазуға болады.
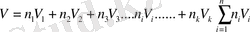
к - қарастырылып отырған компоненттің мольдік көлемі (интенсивті)
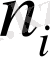 - қарастырылып отырған компоненттердің мольдік саны.
- қарастырылып отырған компоненттердің мольдік саны.
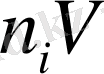 - экстенсивті параметр болады.
- экстенсивті параметр болады.
Араласқан фазалардың сандық (мөлшерлік) сипатын беру үшін парциалдық немесе меншіктік мольдік шама дегенді қарастырайық (парциальная мольная величина) .
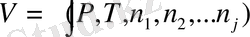
Осы қоспаның мына жағдайын қарастырайық. P=const, Т=const тұрақты параметрден туынды туынды алған кезде нольге тең.
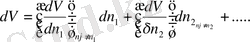
Демек температурамен қысым тұрақты жағдайда толық дифференциал
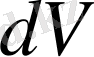 функцияның мольдер саны бойынша
функцияның мольдер саны бойынша
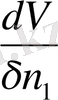 алған жеке туындының жиынтығы.
алған жеке туындының жиынтығы.
Парциалды немесе меншікті шама дегеніміз басқа жағдайда өзгермейтінжағдайда қарастырылып отырған зат өзгерген моль шамасының өзгеру бойынша алынған жеке туындысы екен.
Экстенсивтные парамерты обладает адитивными свойствами т. е суммированы.
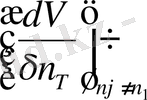 - парциалды мольдік шама
- парциалды мольдік шама
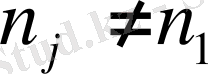 - тұрақты болған жағдай
- тұрақты болған жағдай
4-дәріс. Идеалды газдың ұлғаюы, қысылуындағы
жұмыстардың мәнін есептеу.
Көптеген газ күйінде берілетін жүйелер үшін істелінетін жұмыс газ көлемінің ұлғаюына сығылуына байланысты, ал көптеген реалды газдар қысым, көлемі аздау, ал температура көптеген жағдайда идеалды газ көлемі ұлғайған немесе кішірейген кездегі атқаратын жұмыстың мәні білу маңызды.
Изотермді процесс (T=const)
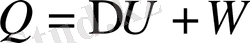
Цилиндр поршень
P
тетік
de
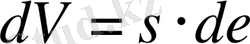
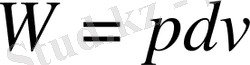
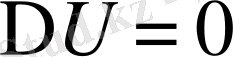

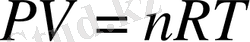
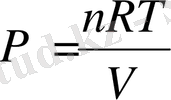
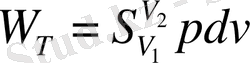
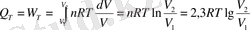
5-дәріс. Газдың ұлғауы, қысылуы кезіндегі атқарылатын жұмыстың P-V координатында график түрінде көрсету (бейнелеу)
P
изобара
изотерма
изохора
адиабат
V
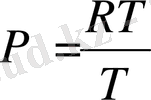
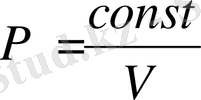
P
B изобара C
P 1
δ
F
адиабата
изохора
P 2
A D
V 1 V 2 V
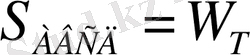
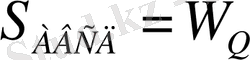

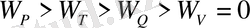
Қарастырылған 4 жағдай үшін идеалды газдың барысында атқарылатын жұмысты P - V координатасында график арқылы көрсетуге болады.
 өзгергенде қойылған шарттарға байланысты қандай жұмыс атқаратынын көреміз.
өзгергенде қойылған шарттарға байланысты қандай жұмыс атқаратынын көреміз.
6-дәріс. Термохимия
Реакцияның жылу әсері, Энтальпия - жүйе күйінің функциясы. Гесс заңы қайтымсыз термодинамикалық процесс изобарлы - изотермді немесе изохорлы - изотермді процесс өткенде бөлінетін жылу мөлшерін өзгерістің немесе реакцияның
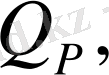
 деп белгілейміз.
деп белгілейміз.
Бірақ реакция барысында температура өзгеруі де мүмкін негізгі мәселе реакцияға қатысатын бастапқы заттармен реакция өнімнің реакцияның жылу әсерін зерттеуді термохимия дейді.
- V - тұрақты болатын жағдайды қарастырымыз.
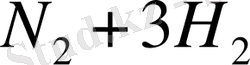
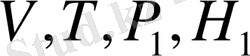
Т. Б. З. W=0
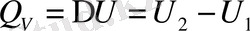

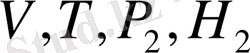
Соңғы теңдеу бойынша жалпы жағдай бойынша жылу жүйе күйінің функциясы болмаса да изохорлы - изотермді процессте жылу жүйе күйінің функциясын атқаруы мүмкін.
II.
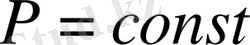 ,
,
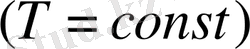
Т. Б. З
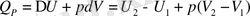
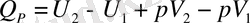
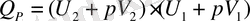

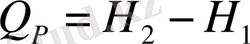


Н - дегеніміз жүйе күйінің функциясы - энтальпия
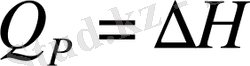
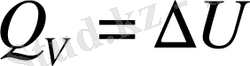 .
.
Осы соңғы қатынастар Гесс заңына анықтама беруге болады.
Көлем немесе қысым тұрақты болған жағдайда өткізілген реакцияның жылу әсері процесстің жүру жолына яғни орта жолға сатыларына тәуелсіз, оның мәні тек бастапқы заттармен, реакция өнімдерінің табиғи ерекшеліктерімен қатар олардың күйлеріне байланысты.
7-дәріс. Термохимиялық есептеулер
Термохимия арқылы эксперименталды мәліметтер жоқ жағдайда есептеуге болады. Осыған орай заттардың түзілуі және жануы. Түзілу жолығы деп күрделі заттың 1 молінің жай заттардан түзілетін бөлігінің реакцияның түзілу жолылығы нолге тең деп қарастырылған.
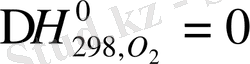
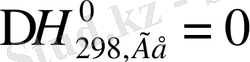
Стандарттық түзілу жолылығы 298К және қысым 1, 013*10
5
Н/м
2
сәйкес алынған көптеген күрделі заттары үшін стандартты түзу жолылығы
 анықтамаларда берілген.
анықтамаларда берілген.
Мысалы,
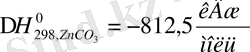
Бұл мына реакцияда бөлінген жылу мөлшері
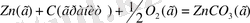
Осы стандарттық түзу жолылығының мәндерін қолдана отырып, алуан түрлі реакциялардың жылу әсерін есептеуге болады.
8-дәріс. Еру жылулығы
Интегралды еру жылулығы деп заттың 1 молінен m молярлық концентрациясы ерітінді дайындалғандағы бөлінетін немесе сіңірілетін жылу мөлшері.
KCl 75, 5г + 100 мл 10 моль/л
+ 500 мл 2 моль/л
+ 1000 мл 1 моль/л
Еру жылулығы күрделі шама себебі қатты зат ерігенде оның кристалды қаңқасы ыдырайды. Бұл процесте жылу сіңіріледі, ал ыдырау нәтижесінде қайта болған иондар сумен сольваттанғанда жылу бөлінеді. Көрсетілген процестердегі жылу мәндері жеке қарастырылған жүздеген және мыңдаған мәндерге кДж тең болуы мүмкін. Бірақ бұлардың таңбалары кері болғандықтан бұлардың жиынтығы болып келетін еру мөлшері ондаған кДж - ден аспайды.
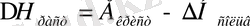
Интегралдың еру жылулықтың мәні дайындалған ерітіндінің концентрациясына байланысты.
9-дәріс. Газдардың және қатты заттардың жылу сыйымдылығы Дьюлонг -Пти, Нейман - Копт ережелері
 Идеал газ үшін мына заңдылық тұрақты. Оның кинетикалық энергиясы мынаған тең.
Идеал газ үшін мына заңдылық тұрақты. Оның кинетикалық энергиясы мынаған тең.
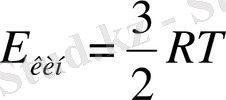 (1 моль үшін)
(1 моль үшін)
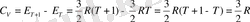
Идеалды газды изохорлы жылу сыйымдылығы мынаған тең
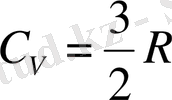
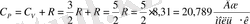
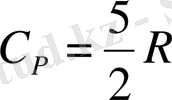
Бір атомды газдың молекуласының дербес қозғалыс дәрежесі үшке тең. Ал екі атомды қарастырсақ, оның дербес қозғалыс дәрежесі беске тең. Оның үшеуі ілгермелі (поступательное) қозғалыс, ал қалған екеуі айналмалы (вращательное) қозғалысқа жатады. Бұл шарт симметриясы түзу болып келетін көп атомды молекулаларға тән.
10-дәріс. Эинштейн және Дебай ұсынған теориялары жылу
сыймдылығы туралы.
Эинштейн жылу сиымдылығының кванттық теориясын ұсынды. Жылу сиымдылығының нольден нақтылы бір шамаға дейін өсуінің заңдылығын белгіледі. Әрбір атомның кеңістікте тербелуінің үш бағыты болуы керек. Әрбір N атомды алсақ оларды Эинштейн 3N гармоникалық осциллятор - тұрақты тербеліс көзі.
N - атомдардың саны.

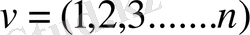
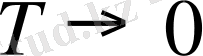
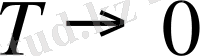
Температура өскен сайын осциллятордың энергиясы осы формула бойынша өзгеріп отырады. Ал егер Т→0 кезде Эинштейн мынадай формула ұсынады. Изохорлы жылу сиымдылығы үшін
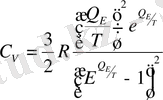
 - Эинштейннің характеристикалық температурасы.
- Эинштейннің характеристикалық температурасы.
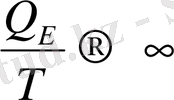
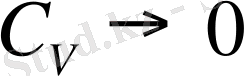
 Эинштейн изохорлы жылу сиымдылық
Эинштейн изохорлы жылу сиымдылық
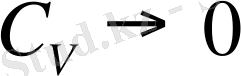 . Бұл мәселе Термодиналиканың II заңынан өзінен - өзі шығып отыр.
. Бұл мәселе Термодиналиканың II заңынан өзінен - өзі шығып отыр.
 (қыздыру арқылы)
(қыздыру арқылы)
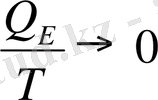

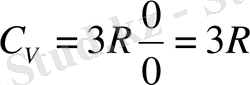
11-дәріс. Жылу әсерінің температураға байланысты
өзгеруі Кирхгоф теңдеуі.
Термодинамикалық кестелерде тек стандарттық жағдайда алынған ΔН°298 қысымда 1, 013*10 5 Н/м 2 сәйкес жылу әсерлері берілген. Ал көпшілік жағдайда жылу шөлшерін өте жоғары температурада анық қажет болады.
Термодинамиканың I заңы жылу әсерімен температура арасындағы тәуелділікті білдіретін мүмкіншілікті қарастырайық:
Qp = ΔН, Qv = ΔU
Мынадай жалпы түрде реакция алайық
bB+dD=gG+rR
Q=C*dT
Көрсетілген реакция 2 тәсілмен жүргіземіз: температура Т дан T+dT көтерілгенде реакцияның жылу әсері Q дан Q+dQ өзгеруі күмәнсіз. Реакцияны 1 жолмен жүргізгенде Т өзгермейді, реакция нәтижесінде Q мөлшерінде жылу бөлінеді, реакция нәтижесінде g, G, r, R заттары бөлінеді. Яғни айтылған заттардың T+d´T күйіне келеміз. (gCG+rCR) ат шамасында жылу жұмсау керек.
2) b, B және d, D заттарының температурасын T+aT температурасына дейін өсіреміз. Бұл үшін (вCb+dCD) dT. Егер айтылған өзгерістер қысым немесе көлем тұрақты жағдайда жүрсе екі жолдың қай - қайсысы да ақырғы күйге әкелетіні анық. Сол үшін Гесс заңы бойынша берілген - бірі тең болуы керек.
Q+(gC G + rC R ) dT=Q+δQ(bC B +dC D ) dT
δQ = [(gC G + rC R ) - (bC B +dC D ) ] dT
δQ/ dT = [(gC G + rC R ) - (bC B +dC D )
δQ/ dT = ΔC (жылу сыйымдылығының өзгерісі физикалық мәні)
Егер P = const
ΔC р = Συ өн С р өн - Συ баст С р баст (а)
Егер V=const
ΔC=Συ өн Cν өн - ΣV баст Cν баст (б)
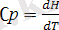 ;
;
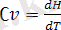
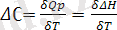 және
және
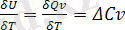 (в)
(в)
Көрсетілген а, б, в теңдеулерін дифференциалдық түрде Кирхгоф теңдеулері деп атайды.
Т
2
t-сындағы бөлінетін ΔН
2
жылу әсерін Т
1
-дегі бөлінетін ΔН
1
жылу әсері арқылы есептеп шығаруға болады. Ол үшін мынау
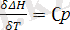 және мына
және мына
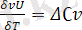 теңдеулерін интегралдау керек.
теңдеулерін интегралдау керек.
ΔН
2
= ΔН
1
+
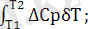 ΔН
2
= ΔН
1
+
ΔН
2
= ΔН
1
+
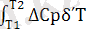 (2)
(2)
12-дәріс. Термодинамиканың II заңы
Термодинамиканың II заңының мазмұны
Термодинамиканың I заңы өзгерістердің энергиялық баланысын дәлме -дәл анықтап, ешқандай деректер бере алмады. Өзгерістерді жеткізуге өте жеткіліксіз, ешқандай дерек бере алмайды. Мұндай деректерді Т ІІ заңы белгілейді. Оның бірнеше анықтамалары бар. Солардың бірі:
1) Томсонның айтуы бойынша: энергияның көптеген түрі жылуға ауысады, ал жылудың өзі барлық құрайтын жүйені біркелкі ыдырауға тырысады. Бұл анықтамада табиғатта әрқашан жылу ыдырау процессі көрсетілген. Т ІІ заңын кейде жылу ыдырау немесе жылу энергиясының дезинтеграция заңдылығы деп атайды.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz