Шеннон энтропиясының мәні: термодинамикалық, статистикалық және ақпараттық аспектілер


ҚАЗАҚСТАН РЕСПУБЛИКАСЫ БІЛІМ ЖӘНЕ ҒЫЛЫМ МИНИСТРЛІГІ
Қ. ЖҰБАНОВ АТЫНДАҒЫ АҚТӨБЕ ӨҢІРЛІК МЕМЛЕКЕТТІК УНИВЕРСИТЕТІ
Физика - математика факультеті
МӘНЖАЗБА
Тақырыбы: Шеннон энтропиясының мағынасы.
Орындаған: Ералина Жаннұр
Нұғыманова Самал
Махамбет Ибрагим
Тексерген: Байганова А. М
Ақтөбе, 2019 ж.
Шеннон энтропиясының мағынасы.
Энтропия (гр. еntropіa - бұрылыс, айналу) - тұйық термодинамикалық жүйедегі өздігінен жүретін процестің өту бағытын сипаттайтын күй функциясы. Энтропияның күй функциясы екендігі термодинамиканың екінші бастамасында тұжырымдалады. Энтропия ұғымын термодинамикаға 1865 ж. Р. Клаузиус енгізген. Кез келген А және В күйлеріндегі жүйе энтропиясы мәндерінің айырымы мына формула арқылы анықталады:, мұндағы δQ - жүйеге күйі шексіз аз квазистатик. болып өзгергенде берілетін жылу мөлшері, Т - жүйенің абс. темп-расы; интрегал екі күйді өзара жалғастыратын кез келген қайтымды жолмен алынады. Изотерм. процесс жағдайында: ∆S=Q/Т. Ал кез келген қайтымды жолмен алынатын тұйық процесс үшін: . Соңғы теңдік Энтропияның dS=δQ/Т түріндегі толық дифференциал болатындығының қажетті және жеткілікті шарты, ал Энтропия - күй функциясы. Энтропияның абс. мәні термодинамиканың үшінші бастамасы бойынша анықталады және ол бойынша абс. нөл темп-рада кез келген жүйенің Энтропиясы нөлге айналады. Адиабаталық оңашаланған жүйелеріндегі қайтымды процестер кезінде Энтропияның мәні тұрақты болып қалады да, қайтымсыз процестер кезінде Энтропияның мәні артады; барлық реал процестерінде Энтропияның мәні артады (Энтропияның арту заңы) . Статистистикалық физикада Энтропия статист. салмақ (∆Ω) деп аталатын шамамен байланыстырады. Больцман принципіне сәйкес: S=kІn∆Ω, мұндағы k - Больцман тұрақтысы. Сонымен Энтропия - термодинам. тепе-тендік күйдегі макроскоп. денелерге тән қасиет. Ол бірліктердің халықаралық жүйесінде (СИ) Дж/К арқылы өрнектеледі. Энтропия ұғымы ғылымның көптеген салаларында (физика, химия, т. б. ) маңызды рөл атқарады. С. Асанов.
Энтропия туралы ұғым.
Еркінше алынған қайтымды циклды қарастыралық. Циклды бөлшектеу көмегімен, элементарлы Карно циклын шексіз көп санды теңдікті, мына түрде жазуға болады:
- dq1T1= dq2T2
Тұйықталған пішін бойынша, интегралдау кезінде және dq 2 теріс таңбаларын есептеп табамыз.
- ʃdqқайтT1= 0.
Мұндағы, dq қайт - таңбасы кезіндегісі, қаралып отырған айналмалы процесстегі қайтымды түріне, ерекше көңіл аударылуы тиіс. Сонымен, келтірілген жылулықтың интегралды суммасы үшін, қандай болса да, қайтымды циклда нөлге тең. Бұл Клаузиус теңдеуідеп аталады. Жылу динамикасында формуласын Клаузиус теңдеуі деп, ал формуласының оң жақ бөлігінің теңдеуін, Клаузиус интегралы деп атайды. Қандай да тұйық жол үшін, математикалық қажетті және жеткілікті шарт, ол:
- ds = dq/T
толық дифференциал болады. 1-2 еркінше алынған жол бойындағы интеграл, әр уақытта тең:
- {\displaystyle S_{2}-S_{1}=\int _{1}^{2}dq_{qait}/T}Шарт бойынша, жылулықты dq жеткізу процессі қайтымды деп есептеледі. Сонымен, S - функция жағдайы. Оны энтропия деп атайды. Формуладағы 1/T үстіңгі көрсеткішінде тұрған, толық емес дифференциал dq үшін интегралдаушы көбейткіш болады. Еркін қайтымды айналмалы процесс үшін алынған формуладан, энтропия S және абсолютты температура Т бар екендігі туралы тікелей қорытынды шығады да, теңдеумен анықталады, оны қайтымды процесстер үшін, жылу динамикасының екінші заңының теңдеуі деп атайды.
Қайтымды изотермиялық процесс (T=const) кезіндегісін теңдеуден табамыз:
- {\displaystyle S_{2}-S_{1}=q_{1-2}/T}Қайтымды адиабатты процесс кезіндегі, dq=0 болғанда:
- ds = 0; S2- S1= 0; S = const.
Қайтымды адиабатты процесс, энтропияның өзгеруін болдырмайды. Сондықтан, оны, изоэнтропийлі процесс деп атайды. Екі рет кездесетін көрсеткіштердің бар болуына сәйкес, сыртқы ортамен, энергетикалық пішіндегі әрекетте болуы. Әрекеттік шарты үшін, байланыстырушы температура Т жылу алмасуы және меншікті энтропия S жолымен, осындай қос көрсеткіштерді құрады. Энтропия экстенсивті (аудитивті) шама болады, себебі энтропия зат, осыған қарағанда оның анықтамасы, осы заттардың (S = mS) санды мөлшеріне пропорционалды, Т мұнда S функциясында болады.
Энтропияның абсолютты шамасын, кейбір тұрақты дәлдікпен есептеуге болады. Себебі, оның абсолютты шамасына емес, энтропиялық өзгеруіне жиі көңіл аударады, оның бастапқы есептелуін шартты түрде таңдайды (әрекеттегі қалыпты физикалық күй, ал су үшін, үш қатты нүкте күйі) . Энтропия бірлігі - Дж/(кгК) . Химиялық реакцияны зерттеу кезінде тұрақтыны білу үшін, энтропияның абсолютты шамасының бастапқысын есептеуі үшін өте үлкен практикалық мәні бар. Нернстің ашқан принципінің атауындағы, Нернстің жылулық теоремасымен көрсетілген тұрақтылығын таңдауды іске асыруға болады. Теореманың тұжырымдауына байланысты, қандай да болмасын жүйенің энтропиясы кезіндегі абсолютты нольде, әр уақытта нөлге тең жағдайында қабылдануы мүмкін.
- limsr->0= 0
Бұдан көрінгендей, жүйелер жағдайының T-> К температура кезіндегі, барлық мүмкіндік өзгеруі, энтропияның тұрақты кезінде өтеді. Сондықтан, жүйелер күйінің (қалай болса солай) Т= 0 К кезіндегісін бастапқы есептеу үшін таңдайды. Сонымен, қайтымды процесстер бойынша алынған интеграл
- {\displaystyle S(A) =\int _{T=0}^{A}{\frac {dq}{T}}},
T=K кезіндегі, қалай болса солай алынған бастапқы жағдайының, А жағдайына арналған энтропияның абсолютты шамасын көрсетеді.
Нернст принципі, тәжірибе жолымен анықталған. Ол, статистикалық механиканың теориялық дәледенуімен табылады. Бұл жерде, мыналарды атап өту керек. Өйткені Нернстің теоремасына байланысты, энтропия - абсолютты нөл айналасында, қандай да өзгеру күйі кезінде, өзгеріске ұшырамайды, сондықтан заттар, жылу алмасуға қабілетсіз болады, онда, бұдан шығуы, салдар ретінде есептелген, осы Нернстің тұжырымдауынша, жылу динамикасының үшінші заңы бойынша, жылуды алып кету жолымен, абсолютты нөлге қол жетпестігі туралы айтылады. Атап айтқанда, Т 2 = 0 К температуралы суықтық көзінен, Карно циклын жүргізуге болмайды және осыған сәйкес пайдалы эсер коэффициенті η к = 1.
Энтропия ұғымын алғаш рет Клаузиус еңгізген (1865) . Бұл ұғымның физикалық мағынасын анықтау үшін изотермиялық процесс кезінде дененің алатын
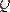 жылуының жылуды беретін дененің
жылуының жылуды беретін дененің
 температурасына қатынасын қарастырады. Бұл
температурасына қатынасын қарастырады. Бұл
 қатынасты келтірілген жылу мөлшері деп атайды.
қатынасты келтірілген жылу мөлшері деп атайды.
Процестің шексіз кішкентай бөлігіндегі денеге берілетін келтірілген жылу мөлшері
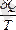 -ға тең.
-ға тең.
Кез келген қайтымды дөңгелек процесс кезінде денеге берілетін келтірілген жылу мөлшері нолге тең
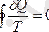
Интегралдың нолге тең болуы кейбір функцияның толық дифференциал екенін қөрсетеді. Яғни сол функция тек жүйенің күйімен ғана анықталадыда жүйе сол күйге келген жолға тәуелсіз болады.
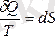
мұндағы
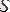 күй функциясы энтропия деп аталады.
күй функциясы энтропия деп аталады.
Қайтымды процестер үшін энтропияның өзгерісі:
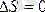
Қайтымсыз процестер үшін жүйенің энтропиясы өсіп отырады:
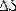 >
>

Бұл өрнектер тек тұйық жүйелер үшін орындалады. жүйе сыртқы ортамен жылу алмасатын болса, онда оның энтропиясы кез келген жолмен өзгереді.
Клаузиус теңсіздігі: тұйық жүйенің энтропиясы немесе өседі (қайтымсыз процестер үшін), немесе тұрақты болып қалады (қайтымды процестер үшін) .

Егер жүйе 1-ші күйден 2-ші күйге қайтымды процесс жасай ауысатын болса, онда энтропияның өзгерісі:
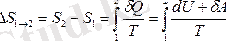
Бұл формула көмегімен энтропияны аддитивті тұрақтыға дейінгі дәлдікпен анықтауға болады. энтропияның өзінің физикалық мағынасы жоқ, физикалық мағына тек энтропияның айырмасында болады.
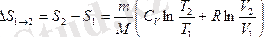
Изотермиялық процесте:
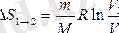
Изохорлық процесте:
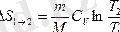
Энтропия аддитивтік қасиетке ие болады: жүйенің энтропиясы, жүйеге кіретін денелер энтропияларының қосындысына тең.
Энтропия жүйе күйінің термодинамикалық ықтималдылығымен байланысқан.
Жүйе күйінің термодинамикалық
 ықтималдылығы деп берілген макрокүйді жүзеге асыратын микрокүйлердің санын атайды.
ықтималдылығы деп берілген макрокүйді жүзеге асыратын микрокүйлердің санын атайды.
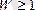
Больцман теңдеуіне сәйкес:
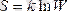
Энтропия жүйедегі қозғалыстардың ретсіздінің өлшемі.
Термодинамиканың екінші бастамасының кейбір тұжырымдамалары:
Тұйық жүйелерде өтетін қайтымсыз процестерде жүйенің энтропиясы ұлғаяды.
Нәтижесі тек қыздырғыштан алынған жылуды оған эквивалентті жұмысқа түрлендіруде ғана болатын дөңгелек процестің өтуі мүмкін емес (Кельвин) .
Нәтижесі тек салқын денеден ыстық денеге жылудың берілуінде ғана болатын процестің өтуі мүмкін емес (Клаузиус) .
Термодинамиканың үшінші бастамасы (Нернст теоремасы) :
Температура нөлге ұмытылғанда барлық денелердің энтропиясыда нөлге ұмытылады:
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz