Орта мектепте d-элементтер химиясын оқыту әдістемесі және заманауи ақпараттық технологияларды қолдану


МАЗМҰНЫ
КІРІСПЕ
Болашақта білікті мамандары өсіп жетілген мемлекеттер ғана өркениеттің алдыңғы қатарынан көрінеді. Өркениетті мемлекеттер, ең алдымен, ғылым мен экономиканың, мәдениеттің дамуымен ерекшеленеді. Қоғамның экономикасын әлемдік деңгейге көтеру білім беру жүйесін дамытуға тәуелді. Мұны «Қазақстан Республикасындағы - білім және ғылым» атты ақпараттық-статистикалық материалдар жинағына енген Елбасының «ХХІ ғасырда білімін дамыта алмаған елдің тығырыққа тірелері анық» деген ойы нақтылай түседі. Осы ретте Қазақстан Республикасы, әсіресе, тәуелсіздік кезеңінен соң әлемдік деңгейден артта қалмау үшін білім беру жүйесінде - әлемдік білім деңгейіне көтерілу, оқытудың жаңа әдістерін қолдану сияқты маңызды, әрі түбегейлі жаңаша міндеттер қойып отыр. Ел президенті Н. Назарбаев «Біз бүкіл елімізде әлемдік стандарттар деңгейінде сапалы білім беру қызметін жолға қоюға тиістіміз» деп қолдау көрсетті.
Мемлекеттік білім стандарты деңгейінде оқыту үрдісін ұйымдастыру жаңа педагогикалық технологияны ендіруді міндеттейді. Ал жаңа педагогикалық технологияның түрі, қолдану ерекшелігі, одан туындайтын ділгір мәселелер бүгінгі таңда әлі нақтыланып белгілі бір жүйеге түспеген дүние.
Инновациялық үрдістің негізі - жаңалықтарды қалыптастыру, қолдану, жүзеге асырудың тұтастык қызметі. Кез келген жаңа әдіс жекелік, сондай-ақ уақытша жоспарға жатады. Бұл яғни, бір мұғалім үшін табылған жаңа әдіс, жаңалық басқа мұғалім үшін өтілген материал тәрізді.
Жас ұрпаққа жан-жақты білім, тәлімді тәрбие беру - әрбір мұғалімнің басты міндеті. Оқушылардың химия пәніне ынтасын арттырып, сабақты қызықты және мазмұнды етіп өткізу үшін оқыту үрдісінде әр түрлі әдістерді пайдаланған тиімді.
Оқытудың технологиясы білім берудің теориялық және қызметтік негізін қалыптастыруда, білімді еңбекпен ұштастырып, іс-әрекеттің сапалығын дамытады, мақсатты өмір сүруге ұмтылуға әсер етеді. Оқыту технологиясы оқу бағдарламаларында қарастырылған алға қойған мақсатқа жетудің тиімділігін қамтамасыз ететін оқытудың әдіс-құрал түрлерінің жүйесі арқылы оқыту мазмұнын жүзеге асыру жолы. Оқыту технологиясында мазмұн, әдіс және құралдардың өзара байланысы мен себептілігі жатыр, ал қажетті мазмұнда, тиімді әдістер мен құралдарды, бағдарлама мен алға қойылған педагогикалық міндетке сәйкес іріктей білу.
Зерттеу жұмысының өзектілігі . Оқушылардың білім деңгейін көтеру үшін оқу үрдісіне педагогикалық технологияны кеңінен енгізіп, барлық ұйымдастыру, дамыту, білім сапасын көтерудің тың жолдарын, әдіс-тәсілдерін қалыптастыру қажет. Жалпы білім беретін мектептің педагогикалық үрдісін жақсарту бірінші мәселе болса, жасыратыны жоқ, бұрын оқыту ісіне біржақты қарап, тек сабақты жақсы беру деп санап келдік. Соның салдарынан барлық ауыртпалық мұғалімге түсті. Мұғалім өзі түсіндіреді, сұрайды, қоcымшалармен толықтырады. Бұрынғы дәстүрлі оқытудың тозығын да озығын да қайта қарап, оқытудың жаңа инновациялық жүйесін ендірудің уақыты жетті. Білім беру саласының барлық жағына жаңаша ой, көзқарас, қарым-қатынас қалыптастыру қажет.
Жоғарыда айтылып өтілгендей, оқушылардың химия сабағына қызығушылығын арттыру мақсатында, химияның адамзат өміріне маңыздылығын көрсету негізінде жаңа оқу әдістемесін ұйымдастыру қазіргі таңдағы педагогтың басты міндеті болып саналады.
Дипломдық жұмыстың мақсаты:
Орта мектептің химия пәнін оқытуда «d - элементтер химиясын» оқыту әдістемесін жасау.
Дипломдық жұмыстың міндеттері:
- d -элементтерге ғылыми - теориялық әдістемелік шолу;
- орта мектепте химия курсында «d - химиясының» орны мен мазмұнын анықтау;
- 10 сыныпқа арналған «Темір және оның қосылыстары» және «Марганец топшасы. Марганец және оның қосылыстары» тақырыптарына оқыту әдістемесін жасау;
-орта мектепте өткізілген сабақтардың (оқыту әдістемелерінің) нәтижелерін талдау;
-зерттеу бойынша берілген негізгі ұсыныстар мен әдістерді педагогикалық экспериментке қою және оның оң нәтижелерін анықтау.
- оқушылардың химия пәні мен жаратылыстану ғылымына деген ынтасын арттыра түсуге септігін тигізетін химияны оқытудың әдіс-тәсілдерін енгізу жұмыстарын арттыру;
1 ТЕОРИЯЛЫҚ ӘДІСТЕМЕЛІК ШОЛУ
1. 1 Қосымша топтардағы элементтерге жалпы сипаттама
Д. И. Менделеевтің периодтық системасындағы әрбір топтың элементтері негізгі және қосымша топ элементтері болып екіге бөлінетіндігі (VIII және нөлдік топтардан басқасы) бұрыннан мәлім. Негізгі топтардағы элементтермен танысып болдық, енді қосымша топтардағы элементтермен танысамыз. Периодтық системаның ұзын түрінде, бұлар В топтардағы элементтер.
Қосымша топтардағы элементтердің барлығы ауыр металдар. Қосымша топтардағы элементтердің атомдарының құрылысы жағынан ерекшелігі - бұлардың соңғы электроны, негізгі топ элементтеріндегідей сыртқы қабатта емес, сырттан екінші ішкі қабатта, әрі оның ішінде d қатпарында орналасқан. Қосымша топтардағы элементтерді d-электронды элементтер деп те атайды. Сондықтан, радиусы қысқарақ болады; радиусының қысқалығы, оның электрон тартқыштығын күшейтеді, демек, химиялық активтілігін кемітеді. Осы айтылғанды айқындау үшін I топтағы негізгі және қосымша топ металдарының радиустарын және ионға айналдыру үшін жұмсалатын энергияны (электрон вольтпен көрсетілген иондану потенциалын) 1-ші кестеде келтірілген мәліметтер арқылы салыстыруға болады.
1кесте
I негізгі және қосымша топтардағы металдардың атомдарының радиусы және иондану потенциалы
Қосымша топтардағы металдардың химиялық активтігі негізгі топтардағы металдардан анағұрлым кем.
Қосымша топтардағы металдардың өзара химиялық активтігі де бірдей емес әрі металдардың периодтық кестеде орнына қарай өзгереді; атап айтқанда кестеде период бойымен солдан оңға қарай, яғни ол металдардың d-электрондардың саны көбейетін бағытта жүрсек, химиялық активтігі аздап та болса кемиді, 2-ші кестеде көрсетілген. Сонымен осы қарап шыққан бағытта бұл металдардың тотықсыздандырғыш қабілеті, демек, металдық қасиеті кемиді.
Бұл қосымша топтар топтың элементтерінің негізгі топтың металдарынан, әсіресе сілтілік және сілтілік-жер металдарынан бір айырмашылығы комплекс қосылыстар түзуге бейім келеді.
2 кесте
Қосымша топтардағы металдардың химиялық активтігінің өзгеруі
Sc
-
Ті
-
V
-
Сr
-
Мn
-
Fe
-
Со
-
Ni
-
-
782, 4
-
920, 5
539, 7
-
669, 5
-
677, 8
-
708, 4
-
721, 7
-
778, 2
-
-
-
794, 9
-
Мұндай қосылыстарды кейбір негізгі топтардың, мысалы III А, IV А, V А топтарының элементтері де түзеді(3-ші кесте) .
1
2
3
4
5
6
7
3 кесте
Периодтық кестеде металл-металл емес элементтердің орналасуы
а. ендік сызықтар - металдар;
ә. бойлық сызықтар - металл еместер;
б. торкөз шаршылар - металл және металл еместік қасиетке ие элементтер
Қосымша топша элементтерін топтарға жіктеу
Периодтық жүйедегі «А» топша элементтерін қарастырып өттік және бұл топшаларға металдар, металл еместер және жартылай өткізгіштік қасиетке ие элементтер кіреді. Ендігі қарастырылатын «Б» топша элементтерінің бәрі де металдар екендігіне оңай көз жеткізуге болады.
«Б» қосымша топша элементтері металдар болғандықтан металдарды техникада оларды «қара» және «түсті» деп негізінен екі түрге топтайды. Металдардың жіктелуі 1-ші сызбанұсқада көрсетілген. Техникалық тұрғыда металдарды таралуы, қасиетін негізге ала отырып, төмендегідей түрде жіктеп, топтайды.
Сызбанұсқа 1. Металдардың жіктелуі
Келтірілген жіктеу шартты, жетілдіруге де болады. Бұл жіктеу бойынша жартылай өткізгіш элементтер германий және сурьма металл ретінде қарастырылған.
Бағалы металдар жеке дербес күйінде де ұшырасады, ал қалғандарының көпшілігі қосылыс түрінде кездеседі. Ол қосылыстар кен көздерінен өндіріліп, арнайы өңдеулерден өткізіліп, таза металл өндіруге даярланады.
Қосымша топшадағы элементтердің электрондық құрылымындағы ерекшеліктер. Ауыспалы металдар
Периодтық кестедегі элементтердің қасиеттері олардың электрондық құрылымына тікелей қатысты екендігі белгілі. Міне, осы элементтердің электрон қабаттарының орналасу және толу ретіне қарай, олар «s», «р», «d» және «f» элементтері болып табылады. Әрбір электрон қабаттарында жаңадан бірінші рет басталатын деңгейшелер - кайносимметриялы орбитальдар (кайнос - гректің жаңа, яғни жаңа типтегі симметриялы) деп аталынады. Мысалы: 1s, 2р, 3d, 4f-орбитальдары кайносимметриялы да, ендігі ұшырасатын 3р, 4р немесе 4d, 5d кайносимметриялыққа жатпайды. Периодтық кестеде кайносимметриялы орбитальдары бар элементтердің дәл осындай орбитальдары бар, тек кайносимметриялы емес элементтерден қасиеті аз да болса, өзгешелеу болатындығын әрдайым есте ұстау қажет.
Сонымен қатар, «d» және «f» деңгейшелері толатын элементтер ауыспалы элементтер немесе металдар деп аталатыны да негізінен екі жағдаймен ерекшеленеді:
-бірінші, сыртқы қабатқа іргелес орналасқан «d» деңгейшелеріндегі электрондармен қоса бос орбитальдардың байланысқа қатынаса алу мүмкіндігі;
-екінші, сыртқы қабаттағы электрон санының өзгермей ішкі «d» және «f» деңгейшелеріне электрондардың орналасуы.
Аталған ерекшеліктер олардың қасиеттерінің ұқсас және координациялық байланыс арқылы комплексті қосылыстар түзуіне мүмкіндік туындатады. Алдағы тақырыптарда комплексті байланыс табиғаты және олардың аталынулары ұғынықты болуы үшін қысқаша тоқтала отырып, арнаулы әдебиеттерді қараған жөн деп есептейміз.
Ауыспалы металдардың комплексті қосылыстар түзуіне электростатикалық көзқарас
Комплексті қосылыстардың қасиетін зерттеу барысында комплекстүзуші элементке (ионға) молекула лигандалардың байланысын түсіндіру үшін әр түрлі көзқарастар пайда болды. Комплексті қосылыстардың түзілуіне:
-электростатикалық (иондық) теория;
-валенттілік байланыс әдісі;
-кристалдық өріс ілімі ;
-лигандалық өріс ілімі;
сияқты көзқарастар бір-бірін толықтыра отырып, өздерінің талдаулары мен тұжырымдамаларын ұсынды.
Электростатикалық теория ілімінде комплекстүзуші элемент (ион) зарядының, оның радиусының және иондардың поляризациялану бейімділігі сияқты қасиеттері мен шамалары назарға алына отырылып комплекс түзу талданылады. Комплекстүзуші ионның заряды артқан сайын, оның координация саны да артатындығын ескеріледі. Мысалы:
CuCl 2 +НСl→Н[CuCl 2 ] Сu + ; координациялық саны 2.
CuCl 2 +2НСl→Н 2 [CuCl 4 ] Сu 2+ ; координациялық саны 4.
Комплексті қосылыстың тұрақты болуына комплекстүзуші элемент пен лиганда радиустарының қатынасы да негізгі көрсеткіштердің бірі ретінде қабылданады. Мысалы, Na 3 [АlF 6 ] комплексінде алюминий фторид лигандасын алтауын топтайды, ал фторға қарағанда, радиусы үлкен хлордың төртеуін ғана жинақтай алады, яғни Na[АlСl 4 ] .
Келтірілген теория сапалық тұрғыда жуықтап болжап тұжырымдар жасауға жол ашқанымен, квантты механикалық есептеулерге мән бермеді.
Қосымша топшадағы металдарды өндірудің негізгі әдістері
Металдарды олардың қосылыстарынан жоғары температурада тотықсыздандыру арқылы өндіретін әдісті пирометталлургия, ал ерітінділерден алатын болса - гидрометаллургия деп атайды.
Пирометталлургия әдісіне металдарды олардың қосылыстарына металл арқылы тотықсыздандырып алатын металлотермия (алюмотермия, магнийтермия, кальцийтермия және т. б. ) әдісі де кіреді.
Металдарды электролиз арқылы олардың балқыған түрінен алу - әдісінің негізін құрайды. Мысалы, NаСl, КСl балқымаларының электролизі арқылы натрий, калий өндіру[5] .
Активтілігі жоғары металмен ерітіндідегі активтілігі төмендеу металдың қосылысынан ығыстырып шығару гирдометталлургия әдісінің бір түрі бола отырып, орыс тілінде «цементация» деп аталады. Мысалы, таза мыс алу:
CuSO 4 + Fe → Cu + FeSO 4
Металл өндірудің жалпы жобасы 4-ші кестеде көрсетілген. Әрбір металды не олардың топшасын баяндау барысында алу жолдарына жекелей қысқаша тоқталуға тырысамыз, өйткені бұл саламен ғылымның «металлургия» бөлігі айналысады.
4 кесте
Металл өндірудің негізгі әдістері
1. 2 d - элементтер химиясы
d-элементтер химиясы s және p элементтерінің химиясынан ерекшеліктері көп, бұл ерекшеліктер d элементтерінің әртүрлі тотығу дәрежелерін көрсетуіне байланысты. Бұдан басқа, s және p элементтерден айырмашылығы, d-элементтері өзара көптеген ортақ белгілерге ие. d-элементтерінің қасиеттерін сипаттайтын кейбір ортақ заңдылықтарды атап өтейік.
Барлық d-элементтері металдар болып табылады. Тәртіпке сай, олар едәуір қаттылығымен, қиын балқығыштығымен (әсіресе VIБ топшасының элементтері, соның ішінде барлығынан қаттысы W), сублимациялау энтальпиясымен және жоғары дәрежедегі электр өткізгіштігімен ерекшеленеді, ол мәліметтер 1-ші суретте көрсетілген. Иттрий мен лантан d-элементтеріне қарағанда, лантаноидтарға өте ұқсас. d -элементтерінің әрбір декадасы үшін d 0 (Sc, Y, La ) , d 5 (Mn, Tc, Re) және d 10 (Ln, Cd, Hg) электрондық конфигурациялары едәуір тұрақты. Толықтаған, жартылай толыққан және толықтай толыққан d-элементтеріндегі d-қабықшалардың жоғары тұрақтылығы, мысалы, Ti +4 (d 0 ), Fe +3 (d 5 ) және Zn +2 (d 10 ) тұрақтылары мен d 4 конфигурациясына ие Cr +2 және Mn +3 тұрақсыздығымен көрініс береді.
Қосылыстар түзілу кезінде s электрондар мен d- электрондардың бір бөлігі немесе барлығы қолданылып, мұнда сыртқы s-электрондардың барлығы байланыс түзуге қатысқаннан кейін ғана d- электрондары қатысады.
Бұл заңдылыққа мырыш топшасы мен Pd бағынбайды, себебі мырыш топшасы элементтерінің атомдарында валентті d- электрондары жоқ, ал
Pd (4d 10 5s 0 ) атомында қозбаған күйінде сыртқы s - электрондары болмайды.
Негізгі топшалардан ерекшелігі тотығу дәрежесінің жоғары мәндеріне жауап беретін қосылыстар тұрақтылығы топтар бойынша өседі: мысалы темірдің тотығу дәрежесі ω (макс) =+6, ал рутений мен осмийдегі ω max =+8.
Берілген элемент үшін ω макс «химиялық партнер» табиғатына тәуелді, мұнда ол оксидтегіге қарағанда галогенидтерде төмен [2] .
Осы тотығу дәрежесі кезінде элемент атомына О(оттегі) - ге қарағанда Г(галогендер) атомдар екі есе көп қосылысатындықтан, екі Г - өзара тебілісі екі О -2 салыстырғанда жоғары болады ( бұл айырмашылық басқаларда кіші d-элемент атомдарында айқын көрінеді) . Шынында да V 2 O 5 , CrO 3 , MnO 2, Re 2 O 7 , RuO 4, OsO 4 тұрақты болғанымен, VCl 5 , CrCl 6 , MnCl 4 , ReCl 7 , RuCl 8 , OsCl 8 түзілмейді. Жоғарғы хлоридтеріне қарағанда, жоғарғы фторидтерінде d-элементтер көбінесе жоғарғы тотығу дәрежесіне ие болады; бұл фтордың үлкен электр терістігімен және оның атомының радиусы кіші болуына негізделген.
Ұқсас қосылыстардың, мысалы оксидтердің G 0 f мәндері бойынша (жекелей алғанда, Mn n O m ) w-ға тәуелділігі бойынша олардың беріктігі жайлы пікір айта алмаймыз. G 0 f Mn0 (-363 КДж/ моль) ; G 0 f MnO2 (-466), G 0 f (Mn 2 O 3 ) =(-878) және G 0 f Mn3O4 (-1280) мәндері абсолюттік шама бойынша өсу ретінде орналасқанымен, өрнектерде оттегі қысымы әртүрлі дәрежеге келтірілетін тепе-теңдік константасына жауап береді. 1моль оттегіге G 0 f жатқызу да оны салыстыратындай ете алмай, бұл оксидтер (MnO басқа) Mn пен O 2 -де емес, сәйкесінше төмен оксид пен оттегіге диссоцияланады. Мына реакциялардың:
4MnO 2 (к) =2 Mn 2 O 3 (к) +O 2 (г) ; G 0 = 108 кДж
6 Mn 2 O 3 (к) =4Mn 3 O 4 (к) +O 2 (г) ; G 0 = 148 кДж
2Mn 3 O 4 (к) =6MnO(к) +O 2 (г) ; G 0 = 382 кДж
2 MnO(к) =2Mn(к) +O 2 (г) ; G 0 = 726 кДж
G
0
мәндерінен MnO
2
-Mn
2
O
3
-Mn
3
O
4
-MnO қатарындағы оксидтер тұрақтылығының ұлғаятындығы шығады. Осы қатарда
G
0
=-RТlnр
О
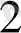 теңдеуіне сәйкес Po
2
төмендеуі (оттегінің кезекті ыдырау раеакциясы үшін) байқалады.
теңдеуіне сәйкес Po
2
төмендеуі (оттегінің кезекті ыдырау раеакциясы үшін) байқалады.
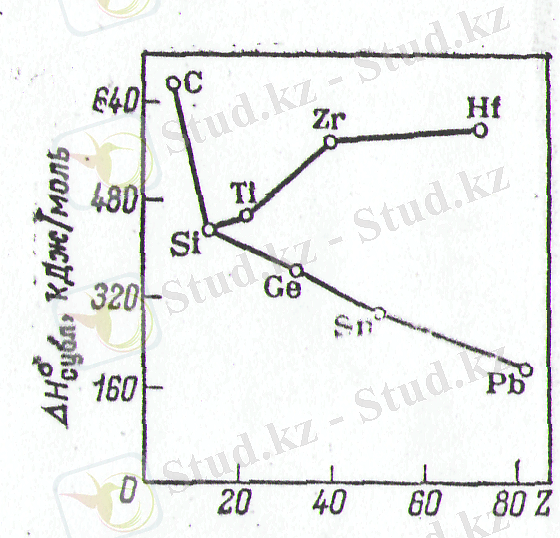
Сурет 1. Элементтің реттік нөмеріне IV топтағы элементтік заттар сублимизациясының стандартты энтальпия тәуелділігі
Әрбір топшадағы бірінші элемент (IV периодта) қасиеттері қалған элементтер қасиеттерінен бірден ерекшеленеді. V және VI периодтағы элементтердің ұқсастығы лантаноидтық сығылумен түсіндіріледі. Осы топшаның ең жеңіл элементі төменгі тотығу дәрежесіндегі қосылыстарды түзуге бейім, сонымен бірге әрбір топша шамасында тотығудың жоғары дәрежесінің тұрақтылығы өседі (мысалы, VI топтың 3d элементтерінің жоғары хлоридтері болып СrCl 3, MoCl 5 , WCl 6 болып табылады) . Жоғары w тұрақтылығының жоғарылауы ауыр атомдардағы барлық валенттік электрондардың ядродан үлкен қашықтықта орналасып, одан біршама эффективті экрандалуымен себептендірілген[4] .
d-элементтері үшін тек вертикалды ғана емес, сонымен бірге горизантальды ұқсастық та тән ( мұнда ол бірдей тотығу дәрежелері кезінде жоғарырақ өрнектелген) . Fe, Ru және Os қарағанда Fe, Co және Ni бір-бірімен ұқсастығы көп, тек ω сипаттамалық мәндері бойынша ғана емес, сонымен бірге бір типті қосылыстар қасиеттері (жекелей алғанда, стандартты түзілу жылуларының мәндері ) бойынша да біріне-бірі қатты ұқсас, мысалы:
ЭCl 2(k) Fe Cl 2 CoCl 2 NiCl 2 RuCl 2 OsCI 2
H 0 f, кДж/моль -400 -310 - 304 -230 -191
Мырыш мысқа қарағанда кадмийге ұқсас:
ЭCl 2(k) ZnCl 2 CoCl 2 CuCl 2
H 0 f, кДж/моль -415 - 391 -215
Балқыма күйде көптеген d-элементтерінің қосылыстары ток өткізеді, мүны жекелей диссоциациялануымен түсіндіруге болады, мысалы:
V 2 O 5 VO 2 + +VO 3 -
2VF 5 VF 4 + +VF 6 - .
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz