Орта мектептің химия курсында бейметалдар тақырыбын оқытудың әдістемесі: 10-сыныпқа арналған Көміртек, Кремний және Оттек сабақтарының әзірлемелері


2. 1 «Көміртек пен кремний» тақырыбына КТК сайыс сабағының әдістемесі . . .
2. 2 10сыныпқа арналған «Оттек» тақырыбын оқыту әдістемесі . . .
2. 3 Алынған нәтижелерді сараптау . . .
50
56
59
МАЗМҰНЫ
КІРІСПЕ
Тақырыптың өзектілігі . Ұлттық бәсекелестік қабілеті бірінші кезекте оның білімділік деңгейімен анықталады. Егемен елімізде болып жатқан әлеуметтік - экономикалық және саяси өзгерістер ғылым мен өндірістің барлық салаларында жұмыс істейтін маман даярлау сапасын жетілдіруде, тәрбие мәселеріне тыңғылықты байыппен қарауды бүкіл педагогикалық процесті басқарып және оған қатысып отырған мамандар талап етеді.
Қазіргі кездегі Қазақстан Республикасындағы Білім беру жүйесінде болып жатқан өзгерістер Білім берудің мемлекеттік стандарттардындағы білім берудің мақсаты мен мазмұнынан мұғалімдерге қойылып отырған талаптардың жоғары екендігін айқындайды. Бүгінгі таңда қоғамымыздың кез-келген саласында өзі үшін де, елі үшін де өскелең экономикалық және әлеуметтік жауапкершілік жағдайында өмір сүріп, жұмыс жасай білетін білікті, қабілетті, іздеңгіш азаматтар қажет екені белгілі.
Қазақстан Республикасында 2015жылға дейінгі білім беруді дамыту тұжырымдамасына сәйкес 12 жылдық білім беру жүйесіне көшу жағдайында жас ұрпаққа білім беру ісінде оның жеке даралық ерекшеліктеріне мейлінше мән бере отырып, оқушылардың мектепте алған білімдері олардың бүкіл өмірлік азығы болатындай етіп білім беру, оны өмірге дайындау, мамандық таңдауға бағыттау мәселесі бүгінгі жаңа қоғамның білім саласындағы кезек күттірмейтін ауқымды мәслелер қатарында тұр [1] .
Жас ұрпаққа жан-жақты білім, тәлімді тәрбие беру - әрбір мұғалімнің басты міндеті. Оқушылардың химия пәніне ынтасын арттырып, сабақты қызықты және мазмұнды етіп өткізу үшін оқыту үрдісінде әр түрлі әдістерді пайдаланған тиімді.
Оқытудың технологиясы білім берудің теориялық және қызметтік негізін қалыптастыруда, білімді еңбекпен ұштастырып, іс-әрекеттің сапалығын дамытады, мақсатты өмір сүруге ұмтылуға әсер етеді. Оқыту технологиясы оқу бағдарламаларында қарастырылған алға қойған мақсатқа жетудің тиімділігін қамтамасыз ететін оқытудың әдіс-құрал түрлерінің жүйесі арқылы оқыту мазмұнын жүзеге асыру жолы. Оқыту технологиясында мазмұн, әдіс және құралдардың өзара байланысы мен себептілігі жатыр, ал қажетті мазмұнда, тиімді әдістер мен құралдарды, бағдарлама мен алға қойылған педагогикалық міндетке сәйкес іріктей білу.
Әрбір мұғалімнің алдына қоятын міндеті - сабақтың мақсаты мен мазмұнына сай тиімді әдістерді таңдап, тақырыпты оқушыға терең жеткізу, ұғындыра білу. Бұл орайда мұғалімдерге жүктелетін міндет ерекше. Себебі, оқушы сабақты толық түсініп, өз дәрежесінде ұғып қабылдаса, ол ұмытылмай есте жақсы сақталады. Оқушы алған білімін өмірде, сабақтың келесі тақырыптарын өткен кезде еркін пайдалана алады. Егер оқушы өткізілген сабақты жетік меңгермесе, келесі тақырыптарды түсінуі қиындай түседі.
Мектептегі дәстүрлі оқытуда оқушылардың бар назары негізінен білім, білік және дағдырларды қалыптастыруға аударылады да, ал ғылыми- білімдердің логика-операциялық жағынан көңіл бөлінбейді. Нәтижеде жеке тұлғаға ең қажетті қасиеттер: бақылампаздық пен ойлау заңдылықтарын талап деңгейінде меңгермейді.
Жоғарыда айтылып өтілгендей, оқушылардың химия сабағына қызығушылығын арттыру мақсатында, химияның адамзат өміріне маңыздылығын көрсету негізінде жаңа оқу әдістемесін ұйымдастыру кәзіргі таңдағы педагогтың басты міндеті болып саналады.
Тақырыптың зерттеліну деңгейі . Педагогикада оқу - тәрбие процесінде оқушылардың белсенділігін жоғарылатудың жолдары үздіксіз түрде жүргізілетіндігі көрсетіледі. Оқу үдерісінде оқушылардың өз бетінше және белсенділік принципі атақты дидакт М. Н. Скаткиннің жұмыстарында ұсынылды. Кейін ол М. И. Махмутова, Т. И. Шамова, Н. А. Половникова, Д. В. Вилькеева, И. Я. Лернер зерттеулерінде дамыды. Бірақтан да алдыңғы ғасырдың 80-жылдарына дейін бұл бағытты зерттеу оқытуды ұйымдас-тырудың бір түрі-тек сабақта ғана жүргізілді. Сабақтың әр кезеңдерінде оқушыларды белсенділігін арттырудың тәсілдері қарастырылды. Зерттеушілер оқу процесінде әрбір оқушының белсенділігін арттыруда оқу әрекетін жекешелендіру мүмкіндіктерін қарастырды. Басқалары бұл міндетті шешуде оқытудың жаңа технологияларын қарастырды. 80 - жылдардың басынан бастап педагогикада педагогикалық технологиялармен байланысты зерттеудің жаңа бағыттары пайда болды. Бұл бағыт аумағында әр түрлі оқытудың инновациялық технологиялары қарқынды түрде бастау ала бастады және олардың қатарында оқытудың ұжымдық әдісі де рөл атқарды. Педагогикада бұл технология В. К. Дьяченко атымен байланысты. Ол бұл форманың негізін, мазмұнын және мақсатын құрды. Ол өзінің зерттеулерінде ұжымдық оқыту технологиясының әрбір оқушының белсенділік әрекетінің міндеттерін шешуде, оқушылардың ынтасын жоғарылатуда, коммуникативті дағдыларын қалыптастыруда үлкен мүмкіндікке ие екендігін айтты. Сол уақыттарда оның қарқынды түрде жүзеге асуына жұмыстар жүргізілмеді.
Диплом жұмысының мақсаты . Орта мектептің химия курсын оқыту барысында бейметалдар химиясын оқытудың әдістемесін жасау.
Диплом жұмысының міндеттері :
- бейметалды элементтерге теориялық әдістемелік шолу;
- орта мектепте химия курсында «бейметалдар химиясының» орны мен мазмұнын анықтау;
- 10 сыныпқа арналған «Оттек», «Көміртек және кремний» тақырыптарына оқыту әдістемесін жасау;
-орта мектепте өткізілген сабақтардың (оқыту әдістемелерінің) нәтижелерін талдау;
- зерттеу бойынша берілген негізгі ұсыныстар мен әдістерді педагогикалық экспериментке қою және оның оң нәтижелерін анықтау.
Зерттеудiң ғылыми әдiстерi : Зерттеу бағыты бойынша ғылыми-әдістемелік, психологиялық, педагогикалық әдебиеттерді талдау; оқушылар-мен, мұғалімдермен, мектеп басшыларымен, олардың арасында сауалнамалар жүргізу; оқу үрдісіне енгізу жолдарын ұсыну.
Зерттеу объектісі: Бейорганикалық химия курсында бейметалдар химиясы.
Зерттеу пәні: Бейорганикалық химия сабақтарында оқушылардың ойлау қабілетін, логикалық пікірлеу, шығармашылық қабілетін дамыту жолдары.
Зерттеудің ғылыми жаңалығы:
Орта мектепте бейорганикалық химияны оқыту үрдісінде ұжымдық оқыту әдісі пайдаланылса, онда оқушылардың білім көрсеткіштері жоғарылап, химия пәніне деген қызығушылықтары оянып, танымдық белсенділіктері артады және сабаққа деген ынтасы жақсарады.
Диплом жұмысының құрылымы кіріспеден, екі бөлімнен және қорытынды мен пайдаланылған әдебиеттер тізімінен тұрады.
1 БЕЙМЕТАЛДАРҒА ЖАЛПЫ СИПАТТАМА
1. 1 Д. И. Менделеевтің периодтық жүйесінде бейметалдардың орналасуы. Табиғатта кездесуі
Бізді қоршаған орта элементтерден құралады. Тарихқа көз жіберсек, элемент ұғымына әр түрлі ойлар айтылады. Ежелгі грек философтары элемент ретінде 4 түрлі затты қарастырды. Олар - жылу, суық, құрғақ және ылғалдылық. Олар өзара бір-бірімен жұптасып барлық заттардың төрт «бастамасын» құрайды - от, ауа, су және жер. Орта ғасырларда бұл бастамаларға тұз, күкірт және сынап қосылды. XVIIғасырда Р. Бойль барлық элементтер материалдық сипатта болып, олардың саны өте көп болуы мүмкін деген болжам айтты. 1787 жылы химик А. Лавуазе "Жай денелердің кестесін" құрастырды. Сол кездегі барлық белгілі элементтер кестеге ендірілді. Соңына қарай ол кестеге күрделі заттар да қосылып кеткендігі анықталды. Қазіргі таңда "химиялық элемент" ұғымына дәл анықтама берілген. Химиялық элемент бұл - ядроның оң зарядтары бірдей атомдардың түрі. (Соңғысы Д. И. Менделеев кестесіндегі элементтердің реттік нөміріне тең) .
Қазіргі уақытта 109 элемент белгілі, солардың 90-ға жуығы табиғатта кездеседі. Қалғандары ядролық реакциялар арқылы жасанды жолмен алынды. 104-109 элементтерді Дубне қаласындағы ядролық зерттеулерді жүргізетін біріккен институтында ғалым -физиктер синтездеді. Қазіргі уақытта да реттік нөмірі одан да жоғары химиялық элементтерді жасанды жолмен алу қарқынды түрде жалғасуда. Барлық элементтер металдар және бейметалдар деп бөлінеді. 109 элементтің 87 металдар. Бейметалдарға келесі элементтер жатады: гелий, неон, аргон, криптон, ксенон, радон, фтор, хлор, бром, йод, астат, оттегі, күкірт, селен, теллур, азот, фосфор, мышьяк, көміртек, кремний, бор, сутегі. Бірақ, бұл бөлу шартты түрде ғана. Белгілі жағдайларда металдар- бейметалдық қасиет көрсетеді, ал бейметалдар-металдық қасиет көрсетеді [2] .
Бейметалдық элементтерді металдық элементтермен салыстырғанда саны аздау. Бейметалдық қасиеті бар элементтер периодтық жүйеде ІІІА-VІІА топтарда орналасқан. Сутегіні де бейметалдар ретінде қарастырады. Бірақ, сутегі бейметалдардың да, металдардың да химиялық қасиеттерін көрсетеді. Химиялық элементтердің Д. И. Менделеев жасаған периодтық жүйесінде металдар қандай орын алады? Бұл сұраққа жауап беруден бұрын едәуір аз болса да бейметалдардың мұнда қалай орналасқанын естеріңе түсіріңдер. Металдардың негізінен периодтық жүйенің сол жағына және төменгі бөлігіне (яғни негізінен I, II және III топтарда), ал бейметал-дардың оң жақ бөлікте жоғары орналасатыны 1-кестеде көрініп тұр.
Бейметалдар негізінен периодтық жүйеде оң жақ жоғарғы бұрышында орналасқан, шартты түрде бор-астат диагоналімен шектелген. Фтор ең белсенді элемент болып табылады.
Кесте 1
Бейметалдардың периодтық кестеде орналасуы
Химиялық элементтердің периодтық жүйесінде
бейметалдардың топ бойынша орналасуы
1
2
3
4
5
6
7
C
Si
N
P
As
O
S
Se
Te
F
CI
Br
I
He
Ne
Ar
Kr
Xe
Rn
Бейметалды атомдардың жалпы электрондық формуласы: ns 2 np 1−5 , сондықтан бейметалдар қосылыстарда әртүрлі тотығу дәрежесін көрсетеді. Бейметалдарға тән негізгі қасиет металдармен салыстырғанда, атомдарының сыртқы энергетикалық деңгейінде электрондардың көп болуы. Бұл қосымша электрондарды қосып алу қабілеттілігіне ие болады да, жоғары тотығу белсенділігін көрсетеді. Міне, сондықтан да бейметалдардың электр-терістілігінің мәні жоғары болуынан, оларды алудың әдістері мен химиялық қасиеттері әртүрлі болады. Бейметалдардың қосымша электрондарды қосып алуға бейім және олардың тотықтырғыш активтілігі жоғары. Осының салдарынан бейметалдар әртүрлі электртерістілік мәндерін көрсетеді[3] .
Бейметалдардың атом құрылысы. Бейметалдардың атом құрылысының ерекшеліктері 2-кестеде көрсетілген.
Кесте 2
Бейметалдардың атом құрылысы
B
1s 2 2s 2 2p 1
2p 1
C
1s 2 2s 2 2p 2
2p 2
N
1s 2 2s 2 2p 3
2p 3
O
1s 2 2s 2 2p 4
2p 4
F
1s 2 2s 2 2p 5
2p 5
Ne
1s 2 2s 2 2p 6
2p 6
Металдармен салыстырғанда бейметалдар атомдары үшін тән:
- кіші атомдық радиус;
- сыртқы энергетикалық деңгейде төрт және одан да көп электрондардың болуы;
Осыдан бейметалдар атомдарының маңызды қасиеттері туындайды - 8 электронға дейін электрондар қабылдау тенденциясы, яғни тотықтырғыш қасиеттері. Бейметалдардың атомдарының сапалық мінездемесі, яғни олардың бейметалдылығының өзіндік өлшемі, электртерістілік қызмет етуі мүмкін, яғни химиялық элементтердің атомдарының химиялық байланысты полярлау қасиеттері, ортақ электрон жұптарын өзіне тарту. Электртерістілік - бейметал-дылық өлшемі, яғни берілген химиялық элемент қаншалықты электртеріс болса, соншалықты бейметалдық қасиеттері айқын байқалады. Бейметалдардың келесі ерекше қасиеттерінің бірі - басқа бейметалдар атомдарымен және амфотерлі элементтермен ковалентті байланыс түзуге ұмтылуы. Сондықтан бейметалдардың жай заттары да, қосылыстарының да байланысы ковалентті. Бос күйінде газ тәрізді заттар - F 2 , Cl 2 , O 2 , N 2 және Н 2 , қатты түрде - I 2 , At, S, Te, P, As, C, Si және В кездеседі, ал бөлме температурасында бір сұйық бейметалл - бром Вг 2 белгілі. Аллотропия құбылысы бейметалдарда жиі кездеседі, мысалы оттегіде (О 2 және О 3 ) және көміртегіде (графит, алмаз, карбин, фуллерон) .
Табиғатта самородты бейметалдар - N 2 және O 2 (ауада), күкірт (жер қыртысында) кездеседі, бірақ көбіне бейметалдар табиғатта химиялық қосылыс түрінде жиі кездеседі. Ең бірінші кезекте бұл - су және онда еріген тұздар, одан кейін - минералдар мен тау жыныстары (мысалы, әртүрлі силикаттар, алюмосиликаттар, фосфаттар, бораттар, сульфаттар және карбонаттар) . Бейметалдардың жерқыртысында таралуы бойынша әртүрлі орынға ие: ең көп таралған элементтер O, Si, H, сирек кездесетін элементтер As, Se, I, Te.
Бейметалды элементтер негізінен периодтық жүйенің жоғары оң бөлігін қамтиды. Период бойынша солдан оңға қарай элемент атомының ядро заряды артады және атомдық радиусы кемиді, ал топ бойынша жоғарыдан төмен атомдық радиусы өседі. Демек, металдарға қарағанда, бейметалды атомдар сыртқы деңгейшедегі электрондарын көбірек тартады [4] .
Сондықтан, бейметал атомдары металл атомдарына қарағанда электрон, тартқыш қабілеті жоғары. Бұл бейметалдардың тотықтырғыш қасиетін көрсетеді. Ерекше күшті тотықтырғыш қасиетті, яғни электрондарды қосып алуға қабілеттілері, 2-3 периодтың VI-VIIтоптың элементтері көрсетеді. Ең күшті тотықтырғыш фтор болып табылады. Бейметалдардың электртерістілігі келесі қатарда артады: Si, B, H, P, C, S, I, N, Cl, O, F. Фтор сутекпен және металдармен белсенді түрде әрекеттеседі.
H 2 + F 2 = 2HF
Ал, оттегімен аз белсенділікпен әрекеттеседі:
2H 2 +O 2 =2H 2 О
Фтор - ең типтік бейметал, тотықсыздандырғыш қасиетті ешқашан көрсетпейді, яғни химиялық реакцияларда электронын бермейді. Химиялық жағынан фтор бейметалдардың ішінде ең активтісі. Оның бірнеше себебі бар: фтор молекуласының атомға ажырауы (F 2 →2F) оңай, оған 159 кДж/моль (хлорға 243 кДж/моль, оттегіге - 494 кДж/моль) керек, оның үстіне фтор атомдарының электрон тартқыштығы үлкен, яғни сыртында сегізге дейін жетпейтін электронды өте белсенділікпен қосып алады, бұл экзотермиялық процесс.
F + e = F - ΔH 0 = - 398 кДж/моль
398 кДж/моль - электрон тарту күшінің сандық көрсеткіші. Осы қосылған электронды үзіп аламыз десек те, осыншама энергия жұмсау керек. Сондықтан фтор атомдарының валенттілік байланысы басқа бейметалдармен салыстырғанда берік болады. Мысалы, Н-F байланыс энергиясы 565 кДж/моль, ал Н-О 460 кДж/моль, Н-С одан да кем 431 кДж/моль[5] .
Оттегінің фтормен қосылысында оттегі оң тотығу дәрежесін көрсетеді. Басқа бейметалдардың барлығы тотықсыздандырғыш қасиет көрсете алады. Оттегіден кремниге қарай тотықсыздандырғыштық қасиет артады: O, Cl, N, I, S, C, P, H, B, Si. Хлор тікелей оттегімен әрекеттеспейді, бірақ жанама жолмен оның оксидтерін алуға болады (Cl 2 O, ClO 2 , Cl 2 O 2 ) бұл қосылыстарда хлор оң тотығу дәрежесін көрсетеді. Азот жоғары температурада ешнәрсе қатысуынсыз оттегімен әрекеттесіп, тотықсыздандырғыш көрсетеді. Және күкірт оттегімен оңай әрекеттеседі.
Бейметалдар - жай заттар. Аллотропия. Бейметалдардың құрылысы
Бейметалдардың металдардан негізгі айырмашылығы - алуан түрлілігімен сипатталатын, жай заттар. Егер металдардың жай заттары металдық байланыс есебінен түзілген болса, онда бейметалдардың жай заттарына ковалентті полюссіз химиялық байланыс тән.
Бейметал-элементтер металдармен салыстырғанда аллотропияға бейім. Бір элементтің аллотропиялық модификациясында молекула құрамының әртүр-лілігі (оттегі мен озонның - молекулалы кристалды торларын мысалға алып) және фосфор модификациясының кристалдық торының құрылысының (қызыл фосфор - атомдық және ақ фосфордың құрылысы молекулалық) әртүрлі ал-лотропия құбылысының себебін ашуға мүмкіндік туады. Озонның қасиетін де-монстрациялық түрде қарапайым тәжірибемен көрсетуге болады. Электрлі от-жандырғышын ылғалды иодкрахмалды қағазға жақындатады. Соңғысы түзіл-ген озон әсерінен көгереді. Озон мен оттегі арасындағы айырмашылық 3-кесте-де, ал, фосфордың аллотропиясы 4-кестеде көрсетілген.
Кесте 3
Оттек пен озонның қасиеттерін салыстыру
- екі затта кәдімгі жағдайда - газдар
- екі затта - жай заттар
- екеуі де - бір элементтен, яғни оттегіден құралған, аллотропиялы модификация.
Екеуі де - күшті тотықтырғыштар.
Ауа құрамында: жазда көлемі бойынша - 7∙10 -9 %, қыста - 2∙10 -10 %-ке дейін.
Атмосферада жерден 20-25км қашықтықта озон қабаты түзіледі, ол жерді ультракүлгін сәулелерден қорғайды
Кесте 4
Фосфордың аллотропиялық түр өзгерістері
Р 4 - тәтраэдрлі формаға ие.
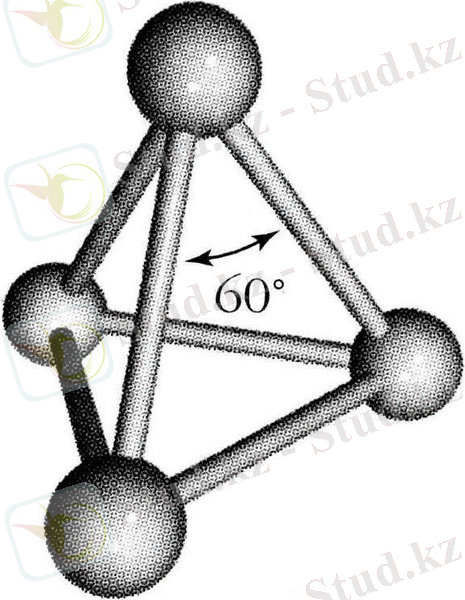
Р n
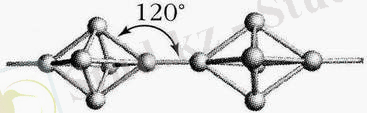
Р х
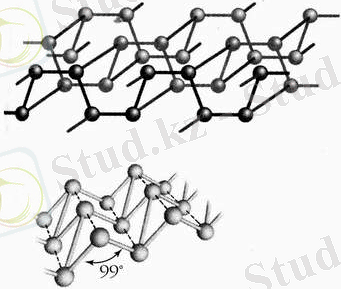
Оттегі аллотропиясын қарастыру барысында аллотропия құбылысының бірінші себебін - сандықтың сапалыққа көшу құбылысын ашуға мүмкіндік болады. Екінші себебі - кристалл торының әртүрлі құрылысы - фосфордың аллотропиясын мысалға келтіріп көрсетуге болады [6] .
Бейметалдардың-жай заттардың кристалдық құрылымы. Аллотропия. Бейметалды элементтерді металдармен салыстырғанда , аллотропияға бейім . Бір химиялық элемент атомдарының бірнеше жай зат түзу қабілеті аллотропия, ал осы жай заттар - аллотропиялық түр өзгерістер немесе модификациялар деп аталады.
Себебі
Біртекті атомның көп санынан әртүрлі кристалдық түрдің
молекуланың түзілуі (оттегі, озон) түзілуі (алмаз, графит)
Бейметалдардың молекуласын қарастырайық. Бейметалдар бір атомды да, екі атомды да молекуланы түзе алады. Бір атомдық бейметалдарға инертті газдар жатады, практика жүзінде ең актив заттарменде әрекеттеспейді. Инертті газдар периодтық жүйеде VIII топта орналасқан, ал жай заттарының химиялық формулалары келесідей: He, Ne, Ar, Kr, Xe және Rn. Инертті элементтердің радиустары өскен сайын олардың атомдарының поляризациялануы күшейіп, олардың арасындағы ван-дер-ваальстық күштері молайып, балқу және қайнау температуралары гелийден радонға қарай жоғарылай бастайды. Инертті газдардың сыртқы қауызы 8 электронды (гелийде-2) тұрақты болады, сондықтан олар электрон беріп не алып реакцияласпайды - инертті. Кейбір бейметалдар екі атомды молекула түзеді. Олар H 2 , F 2 , Cl 2 , Br 2 , I 2 (периодтық жүйедегі VII топтың элементтері), сол сияқты о-ттегі O 2 және азот N 2 . Ал үш атомды молекуланы озон газы түзеді O 3 [7] .
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz