Химиялық үдерістер туралы ілім: термохимия, термодинамика, кинетика және тепе-теңдік


ХИМИЯЛЫҚ ҮДЕРІСТЕР ТУРАЛЫ ІЛІМ
Химиялық үдерістердің жүру табиғатын, динамикасын зерттеу белгілі бір қасиетті заттарды синтездеудің ықтималды жолын көрсетеді. Бұл жәйт химия ғылымының теориялық толығуымен қатар оны практикалық жағынан да байытады.
Сондықтан бұл тарауда химиялық реакцияның термохимиясын, термодинамикасын, кинетикасын, тепе-теңдікті қарастырамыз.
Химиялық үдерістердің заңдылықтарын қарастырмастан бұрын «жүйе» деген түсінікке анықтама берейік:
Жүйе деп реттелген ішкі тұтастығы бар, салыстырмалы тұрақты қоршаған ортадан бөлініп алынған бір-бірімен байланысқан құрамдас бөліктер жиынтығы. Жүйедегі заттардың қоршаған ортамен заттары және энергия алмасуына байланысты- ашық , жабық және изоляцияланған (оқшауланған) жүйе деп бөлінеді .
Ашық жүйе болса, ол қоршаған ортамен бөліну бетінің қасиеттеріне байланысты заттардың және энергиясының алмасуы болады, ал заттары алмаспай, энергия алмасуы мүмкін жүйе-жабық деп аталады. Изоляцияланған жүйеде ешқандай алмасу болмауы тиіс, бірақ мұндай жүйенің болу ықтималдылығы нольге тең.
Жүйенің күйінің мынадай параметрлері:көлем, қысым, температура, зат мөлшері, энергия шамасы т. т уақыт пен кеңістікте тұрақты болса, жүйенің осы күйін тепе-теңдік күйі деп есептейді.
Жүйедегі заттардың агрегаттық күйлеріне байланысты: гомогенді (біртекті), гетерогенді (әртекті деп бөлінеді) жүйе деп бөледі.
§1 Термохимия негіздері
Табиғатта, я болмаса, зертханада тәжірибе жасаған кезде өтетін химиялық үдерістердің қай-қайсысын алсақ та азды-көпті энергетикалық өзгерулермен қабат жүріп отыратынын көреміз. Көбіне энергетикалық өзгерулер жылудың бөлінуі, сіңірілуі түрінде байқалады. Реакциялар кезінде химиялық энергия жылу, жарық, механикалық және электр энергиясына айналады. Химиялық реакцияның энергетикалық өзгерулері көбіне жылу түрінде болғандықтан әрі оны өлшеу жеңілге түсетіндіктен химия ғылымында бір ғана энергия түрінің өзгерісін зерттеу қабылданған. Қандай да болмасын басқа энергияның түрлері жылуға шағып беріледі. Соңғы кезде энергия өлшемі ретінде калория және джоуль қолданылып келді, олардың эквивалентті мөлшерлері мынадай:
1Дж = 0, 239 кал = 0, 624 ∙ 10 19 э. в.
Химиялық реакцияға сай энергияның өзгерулерінің практикалық, теориялық үлкен маңызы бар. Химиялық реакцияның жылу энергиясын білу нәтижесінде қажетті реагенттерді таңдап алып, жылу балансын есептеуге мүмкіндік туады.
Практикада жылу алу үшін жүргізілетін реакция-заттардың жануы болып саналады. Реакция нәтижесінде түзілетін жылу мөлшері қосылыс құрамындағы көміртек пен сутектің мөлшеріне тәуелді, олар неғұрлым көп болса, жылу мөлшері де көп болады. Заттардың жылу тудыру қабілеті кДж/г есебінде беріледі.
Кесте5. 1 Жиі қолданыста болатын отынның жылу тудыруы
Ағза тіршілігіне қажетті жылу (ересек адам тәулігіне ≈ 6300 кДж жылу пайдаланады) көбіне қоректенген астағы көмірсулар мен майлардың ферментативті тотығуы арқылы түзіледі.
Қазіргі кезде жылу көзі болатын табиғи ресурстарды үнемдеу мақсатында жаңа технологияны пайдаланып, күн, жел, су, атом энергиясын, экологиялық жағынан таза сутектік технологияны қолдану жүзеге асырылуда. Еліміздің жоғары техникалық білім ордаларының жанынан құрылған технопарктерде, арнайы зерттеу институттарында ғалымдар осы маңызды мәселемен айналысуда. Бұл мәселені шешу үшін халықаралық деңгейде ірі ғылыми форумдар өтуде (Астана, ЕХРО - 2017) .
Химиялық реакцияның жылу эффектісі деп оның тұрақты қысымда, не тұрақты көлемде өткендегі бөліп шығаратын немесе өзіне сіңіретін энергиясының мөлшерін айтады. Оны калориметрлік тәсілмен анықтайды. Калориметр көмегімен реакцияның жылу эффектісін ғана анықтап қоймай, заттардың әртүрлі еріткіштердегі еру жылуларын, заттардың агрегаттық күйлері өзгеруіне байланысты байқалатын жылу өзгерістерін де анықтауға болады.
Химиялық реакцияның энергетикалық эффектісін және сол эффектің әрекеттесетін заттардың құрамы мен құрылысына, үдерістің өту жағдайына тәуелділігін зерттейтін сала термохимия деп аталады. Егер реакция нәтижесінде жылу бөлінсе, оны экзотермиялық, ал сіңірілсе- эндотермиялық реакция деп, ал жылу эффектілері көрсетілген реакция теңдеулерін термохимиялық реакция теңдеулері деп аталады. Мысалы:
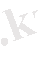 Экзотермиялық реакция (1, 2)
Экзотермиялық реакция (1, 2)
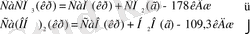 Эндотермиялық реакция (3, 4)
Эндотермиялық реакция (3, 4)
Бір моль күрделі зат молекуласы жай заттардан түзілген кезде бөлінетін немесе сіңірілетін жылу мөлшерін - түзілу жылуы (Q түзілу , кДж / моль ), ал ыдырау кезіндегісін - ыдырау жылуы (Q ыдырау ) деп атайды.
Термохимияның негізгі заңын 1840 жылы Г. И. Гесс ашқан. Бұл заң бойынша:
Белгілі бір тұрақты қысым мен көлемде жүретін реакциялардың жылу эффектісі оның жүру жолына тәуелсіз, тек жүйенің бастапқы және соңғы күйіне ғана тәуелді болады.
Гесс заңын мына төмендегі сызбанұсқамен кескіндеуге болады:
Бұл заңды түсіну үшін төменде келтірілген мысалды қарастырайық.
Төмендегі сұлбада темірдің (III) оксидін екі әдіспен алу жолы келтірілген.
1) Fe →Fe 2 O 3 2) Fe → FeO → Fe 2 O 3
Жазылған сұлбада бастапқы күйі темірге қатысты болса, соңғысы темір (III) оксиді.
2
Енді көрсетілген реакция теңдіктерінің сұлбаларына қатысты термохимиялық реакциялардың теңдеулерін жазсақ:
2Fe + O 2 = 2FeO + 529, 6 кДж
2FeО + 0, 5O 2 = Fe 2 O 3 + 292, 6 кДж
Осы теңдіктің екі жағын мүшелеп қоссақ:
2Fe + 2FeО +1, 5O 2 = 2FeО + Fe 2 O 3 + 822, 2 кДж
Өзгеріссіз қалған заттар формулаларын жойып, қайта жазсақ:
2Fe +1, 5O 2 = Fe 2 O 3 + 822, 2 кДж (5)
Сонда: Q 3 =Q 1 +Q 2 болғаны, олай болса темірден темір (III) оксидін тікелей алса да шығатын жылу мөлшері (5) реакциядағыдай болар еді.
Гесс заңының төрт салдары бар
Бірінші салдары
(Лавуазье-Лаплас заңы)
Бұл заңды энергия сақталу занының жеке бір жағдайы ретінде қарастыруға болады, өйткені бұл заң былай оқылады:
Мөлшерлері бірдей заттардың ыдырауы кезінде сіңірілетін жылуымен, сол заттың түзілуі кезінде шығатын жылуы бірдей болады.
Бұдан мынадай қорытынды жасауға болады: күрделі заттардың түзілу жылуы мен ыдырау жылулары абсолюттік мәндері жағынан тең, ал таңбалары жағынан қарама-қарсы:
= (5. 1)
Ал, жай заттар үшін түзілу және ыдырау жылуы шартты түрде нөльге тең деп қабылданылған.
Q
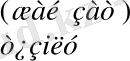 = Q
= Q
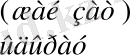 = 0
(5. 2)
= 0
(5. 2)
Жоғарыда қарастырылған төрт реакцияның біріншісінің жылу эффектісі көмірқышқыл газының түзілу жылуы бола алады, ал қалғандарынікі түзілу жылуына жатпайды. (2) -нші реакция теңдеуіне қарасақ, жай заттар молекулаларынан күрделі зат молекуласы түзіліп тұрғанымен, анықтамаға қайшы келетіні-зат мөлшері, егер судың түзілу жылуына лайықты реакция теңдеуін жазар болсақ, теңдіктегі коэффициенттерін және жылу эффектісінің мәнін екіге бөлу қажет болады:
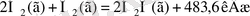
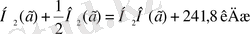
Q түзілу (H 2 , O 2 ) =0
Заттың түзілу жылуының мәні зат табиғатына, оның агрегаттық күйіне тәуелді болады. Сондықтан термохимиялық реакция теңдеулерінде заттардың агрегаттық күйі жақша ішінде көрсетіледі. мысалыQ түзілу (H 2 O(c) ) = 285, 8 кДж / моль болса, Q түзілу (H 2 O(г) ) = 241, 8 кДж / моль болады.
Бұл теңдеулердің екінші бір ерекшелігі теңдеудегі коэффициенттер ретінде бөлшек сандарды да қолдануға болады. Мысалы:
2С 2 Н 2 (г) + 5О 2 (г) →4СО 2 (г) + 2Н 2 О(г) + 2511, 2 кДж(6)
С 2 Н 2 (г) + 2, 5О 2 (г) → 2СО 2 (г) + Н 2 О(г) + 1255, 6 кДж
Екінші салдары
Екі реакцияға қатысқан бір заттың физикалық күйі екі түрлі болып, ал соңында алынатын зат бірдей күйде болса, онда осы реакциялардың жылу эффектілерінің айырымы реакцияға алынған заттың бірінің екіншісіне айналу жылуына тең болады.
C (графит) + O 2 = CO 2 + 393, 51 кДж (Q 1 ) (7)
C (алмаз) + O 2 = CO 2 + 395, 34 кДж (Q 2 ) (8)
(8) - теңдікті шартты түрде кері аударып жазсақ:
CO 2 =C (алмаз) + O 2 - 395, 34 кДж (Q 2 ) (8 1 )
Егер (7) және (8) теңдеулерін мүшелеп қоссақ:
C (графит) + O 2 + CO 2 = CO 2 + C (алмаз) + O 2 +393, 51 кДж- 395, 34 кДж
C (графит) →C (алмаз) - 1, 83 кДж (9)
Бұл салдар тәжірибе жүзінде көмір сияқты бір аллотропиялық түр өзгерісінің екінші түріне ауысу жылуын анықтай алмаған жағдайда оны осы жолмен есептеуге болады.
Үшінші салдары
Реакцияға қатысқан заттар мен олардың күйлері бірдей болып, нәтижесінде күйлері өзгеше бір зат пайда болса, осы реакциялардың жылу эффектілерінің айырымы заттардың бір күйден екіншісіне өткендегі жылу эффектісіне тең болады.
H 2(г) + 0, 5O 2(г) = H 2 O (г) + 241, 83 кДж (10)
H 2(г) + 0, 5O 2(г) = H 2 O (с) + 285, 84 кДж (11)
Осы салдарды пайдаланып, H 2 O(г) →H 2 O(с) өзгерісінің жылу эффектісін анықтауға болады. Ол үшін тағы да жоғарыда көрсетілген амалды қолдануға болады.
H 2 O (с) = H 2(г) + 0, 5О 2(г) - 285, 84 кДж (11 I )
(13) және (13 I ) теңдеулерін мүшелеп қосамыз, сонда:
H 2(г) + 0, 5 О 2 (г) + H 2 O (с) = H 2 O (г) + H 2 (г) + 0, 5 O 2 (г) + 241, 83 кДж - 285, 84 кДж
H 2 O (с) → H 2 O (г) - 44, 01 кДж (12)
Судың үш агрегаттық күйде болатынын барлығымыз білеміз, бір күйден екінші күйге ауысқанда жылу эффектілері байқалады. Мына өзгерісті қарастырсақ:
Мұз → Су → Бу (Q<0)
Осы бағыттағы өзгеріс эндотермиялық үдеріске жатады, ал кері бағыттағысы-экзотермиялық (Q>0) .
Төртінші салдары
Реакцияның жылу эффектісі реакция нәтижесінде түзілген заттардың түзілу жылуларының қосындысынан(коэффициенттерін ескере) реакцияға қатысқан заттардың түзілу жылуларының қосындысының (коэффициенттерін ескере) айырымына тең болады.
A n B m + nmCD=nAD m + mC n B+Q p
Q p = [nQ түзілу (AD m ) + mQ түзілу (C n B) ] - [Q түзілу (A n B m ) + mnQ түзілу (CD) ] (5. 3)
Ал, осыны нақты мысал негізінде қарастырайық:
2C 2 H 2 (г) + 5O 2 (г) = 4CO 2 (г) + 2H 2 O(г) + Q p
Q p =[4Q түзілу (CO 2 ) + 2Q түзілу (H 2 O) ] - [2Q түзілу (C 2 H 2 ) + 5Q түзілу (O 2 ) ] ;
Мұнда Q түзілу (O 2 ) =0, болғандықтан реакцияның жылу эффектісін былай жазуға болады:
Q p = 4Q түзілу (CO 2 ) + 2Q түзілу (H 2 O) - 2Q түзілу (C 2 H 2 ) .
Q p = 2511, 2 кДж.
Осы салдарды пайдаланып, арифметикалық амал қолданып, егер реакцияның жылу эффектісі белгілі болса, түзілу жылуы белгісіз заттыкін есептеп шығаруға болады.
Қарастырылған мысалда ацетиленнің түзілу жылуынан басқа мәліметтер белгілі болса, оның түзілу жылуы мына формуламен анықталады:
Q түзілу (C 2 H 2 ) = [4Q түзілу (CO 2 ) + 2Q түзілу (H 2 O) - Q p }/2.
Заттың түзілу жылуының мәні оның тұрақтылығы туралы мәлімет береді.
Көпшілік заттардың, әсіресе молекула құрамы екі элементтен артық күрделі қосылыстар синтездік жолмен алынбайтыны белгілі, сондықтан ондай заттардың түзілу жылуларының мәнін анықтау үшін осы Гесс заңының салдарын пайдалануға болады.
Мысалы:
СаО + СО 2 = СаСО 3 + 178 кДж
Q т кДж/моль 635, 5 393, 5 х
Q р = Q т (СаСО 3 ) - Q т (СаО) + Q т (СО 2 ) => Q т (СаСО 3 ) = Q р + Q т (СаО) + Q т (СО 2 )
Q т (СаСО 3 ) = 178 + 635, 5 + 393, 5 = 1207 кДж/моль
Көп жағдайда әртүрлі есептеулер жүргізу барысында осы заңның салдары қолданылады.
Заттың түзілу жылуының таңбасы және оның абсолюттік мәнін салыстыру арқылы қай қосылыс кәдімгі жағдайда тұрақты, ал, қайсысы тұрақсыз екендігін болжау мүмкін болады.
Кесте 5. 2 V. A топшасы элементтерінің гидридтерінің түзілу жылулары
Бұл заттардың ішінде тек аммиак экзотермиялық қосылыс, яғни бұл заттың
1 молі түзілгенде 46, 15 кДж бөлінеді, олай болса, оны ыдырату үшін осынша энергия жұмсауды қажет етеді. Ал, қалған гидридтер эндотермиялық болуына байланысты олардың беріктілігі аммиакқа қарағанда төмен.
Олай болса, осыдан шығатын қорытынды, заттың түзілуі экзотермиялық үдеріс болса, сол қосылыстың беріктілігі жоғары болатыны көрініп тұр.
§2 Химиялық термодинамика заңдары, функциялар
және олардың мағынасы
Физикалық және химиялық құбылыстардың арасындағы байланысты физика және химия ғылымдарының теориялық және эксперименттік әдістерін пайдалана отырып, физикалық химия реакцияларды жан-жақты зерттеумен айналысады. Химиялық реакциялардың жүру жағдайы туралы білу оны белгілі бір қолайлы бағытқа бағыттауға мүмкіндік береді.
сияқтыжүйедегі жүретін үдерістердің бастапқы және соңғы күйін қарастырғанымен оның соңғы күйге жету жолын ескермейді. Термодинамика энергияның бір түрінің басқа түріне айналу заңдылықтарын зерттейді. Жүйенің күйі оның интенсивт і және экстенсивті қасиеттерімен анықталады. Интенсивті қаситтеріне қысым, температура, концентрация жатады, бұлармен жүйенің әрбір нүктесі сипатталады. Ал, экстенсивтіге - зат мөлшері мен массасына байланысты қасиеттері жатады. Осы екі қасиетке де физикалық шама уақыт кірмейді, оның себебі термодинамика тепе-теңдікте тұрған жүйені зерттейді.
Термодинамикалық жүйе деп қоршаған ортадан ойша бөлінген денелер тобы.
Жүйенің күйі деп оны сипаттайтын барлық физика - химиялық шамалар жиынтығын айтады.
f(Р, V, T) = 0 (5. 4)
Бұл үш шама арасындағы байланыс идеалды газдар үшін Клапейрон-Менделеев теңдеуімен өрнектелетінін білеміз.
Ал, көпшілік жүйелер үшін жүйенің күйін көрсететін теңдеулер белгісіз. Сондықтан, термодинамика жүйенің күйін сипаттау үшін бес түрлі функция пайдаланылады : E, U, H, S, G.
Е-жүйенің толық энергиясы.
Толық энергия қозғалыстағы жүйенің үш түрлі энергиясымен анықталады:
Е = Е кин + Е пот + U. (5. 5)
Мұндағы, Е кин - кинетикалық энергия.
Е пот - потенциалдық энергия.
U - жүйенің ішкі энергиясы
Жүйені термодинамикалық жағынан сипаттау үшін жүйе салыстырмалы тыныштықта тұр деп есептелінеді, сонда Е кин = 0, сыртқы өріс әсерін есепке алмасақ Е пот = 0, сонда жүйенің толық энергиясы оның ішкі энергия қорымен ғана анықталады, энергия дененің жұмыс істеу қабілетін сипаттайды.
E = U (5. 6)
Жүйенің ішкі энергиясы (U) депжүйеніңжалпы кинетикалық және потенциалдық энергиясынан басқа оны құрайтын материалдық дүниелердің барлық энергия түрлерінің (молекула және молекула ішілік байланыс энергиясы, атомның құрамдас бөліктерінің байланыс энергиясы) қосындысымен анықталатын шаманы айтады. Бұл шаманың сандық мәнін нақты анықтауға мүмкін де емес және термодинамика үшін тек оның өзгерісін білген жеткілікті (∆U) .
Термодинамиканың бірінші заңы бойынша жүйенің ішкі энергиясының қоры сыртқы ортамен энергия алмасу болмағанда тұрақты болады.
Бұл заңды 1748 жылы М. В. Ломоносов ұсынған, ол энергия сақталу заңынан туындайды.
Жүйеге сырттан берілетін энергия оның ішкі энергиясын өзгертеді және сыртқы күштерге қарсы әсер ететін жұмысқа айналады:
Q = ∆U + A (5. 7)
Бұл формула (5. 7) термодинамиканың бірінші заңының және энергия сақталу заңының математикалық өрнегі болып есептелінеді.
Сыртқы күшке қарсы істелінетін жұмыстың физикалық мағынасын түсіну үшін поршені қабырғасымен үйкеліссіз қозғалатын қоршаған ортадан бөлініп алынған цилиндр ішіндегі газдан тұратын жүйені қарастырайық. Егер поршені қозғалмаса (V=const), сырттан келген жылу тек ішкі энергияны өзгертеді.
Q v =∆U (5. 8) болады, себебі А=0.
Поршень үйкеліссіз қозғалыста болса, V≠const газ көлемін ұлғайтып, жұмыс істелінеді:
A = Fh = pSh (5. 9)
Мұндағы, F-поршеньге әсер ететін күш;
h-поршеннің қозғалу биіктігі;
S-поршень ауданы;
p-газ қысымы;
Бұл формуладағы Sh = V (V-көлемнің өзгерісі), мынадай жұмыс тудырады:
A = p∆V = р(V 1 -V 2 ) (5. I0)
p = const, изобаралық жағдайға сәйкес келеді, олай болса:
Q p = ∆U + p(V 1 -V 2 )
Q p = U 2 - U 1 + pV 2 - PV 1
Q p = (U 2 + pV 2 ) - (U 1 + pV 1 ) (5. 11)
Енді жаңа термодинамикалық функция енгіземіз:
U + pV = H. (5. 12)
Мұндағы Н-энтальпия, формуладан энтальпия шамасы жүйенің ішкі энергия қорынан оның кеңеюі кезіндегі істелінетін жұмыс шамасынан артық екендігі байқалады.
Сонда, p = const болғанда:
Qp = H 2 - H 1 = ∆H. (5. 13)
(5. 8), (5. 13) формулалары бойынша жүйенің энтальпиясы оның ішкі энергиясына эквивалентті екені, ал оның өзгерісі (∆Н) химиялық реакциялардың жылу эффектісіне эквивалентті болады. Сөйтіп, энтальпия жүйенің ішкі энергиясының өзгерісін көрсетеді. Экзотермиялық реакциялар (Q реакция >0) үшін ∆Н<0 болса, эндотермиялық реакциялар (Q реакция <0) үшін ∆Н>0 болады, яғни экзотермиялық реакциялар кезінде оның ішкі энергиясының шамасы шығатын жылуға байланысты азайса, эндотермиялық реакцияларда сіңірілетін энергия есебінен жүйенің ішкі энергиясы артады. Реакция энтальпиясы сол жағынан алғанда (p = const) жылу эффектісіне тең.
Енді термохимиялық реакция теңдеулерін былай жазуға болады:
СаО(к) + H 2 O(с) = Са(ОН) 2 (к), ∆Н = -65, 3 кДж.
CaCO 3 (кр) = CaO(кр) + CO 2 (г), ∆Н = +178 кДж.
Жоғарыда қарастырылған екі реакцияның қайсысы өздігінен жүретінін сіздер күнделікті тұрмыста жинақталған тәжірибеңізден білесіздер, әрине экзотермиялық реакциялар (∆Н<0) өздігінен жүреді.
Табиғатта өздігінен жүретін экзотермиялық үдерістен басқа да құбылыстар байқалады. Сонда оларға қандай фактор әсер етеді?
Кейбір эндотермиялық үдерістер, мысалы мұздың 0 0 С - дан жоғары температурада суға айналуы, тұздардың (KCI, NH 4 NO 3 ) суда еруі өздігінен жүреді.
Ал, жылу өзгерісінсіз жүретін мына құбылысқа тоқталайық: бір-бірімен
кран (тиек) арқылы байланысқан екі шыны ыдыстың бір бөлімінде газ, ал екінші бөлімінің ауасы сорылған болсын. Егер де тиекті ашсақ, газ қысымдары теңескенше газ біріншісінен екінші бөліміне өздігінен өтеді, ал кері бағытта үдеріс жүрмейді.
Қарастырылған үш мысалдағы ортақ нәрсе, ол жүйелердің бастапқы және соңғы күйлеріндегі ретсіздік дәрежесі.
Реакция бағытын анықтау үшін жаңа термодинамикалық функция энтропияны (S) енгіземіз, ол жүйенің ретсіздік дәрежесін көрсетеді.
Бұл функцияның физикалық мағынасын түсіну үшін төмендегі құбылыстарды қарастырайық: судың үш агрегаттық күйінің бір-біріне ауысуы.
Мұз → Су → Бу
S 1 S 2 S 3
Бұл жүйелердің ретсіздік дәрежесі былай өзгеретіні S 1 <S 2 <S 3 айтпаса да түсінікті, сонда мұз буға айналған кезде ретсіздік дәрежесі артады, өйткені S 3 - S 1 = ∆S> 0.
Ал, егер бу конденсацияланып суға айналып, соңынан қататын болса:
Бу → Су → Мұз
S 1 S 2 S 3
S 1 > S 2 > S 3 , сонда ∆S = S 3 - S 1
∆S < 0
Кез келген кристалды затты балқыту үшін жұмсалған жылу оның балқу температурасын көтермейді. Олай болса, ол жылу жүйеде жүретін кейбір үдерістер, атап айтқанда оның ретсіздік дәрежесінің өзгерісіне жұмсалады, осы құбылысты мына формуламен беруге болады:
S (5. 14)
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz