Аналитикалық химия: V аналитикалық топ катиондарының сапалық реакциялары - лабораториялық әдістемелік нұсқау


ЖАРАТЫЛЫСТАНУ ФАКУЛЬТЕТІ
хИМИЯ кафедрасы
Аналитикалық химияның
Сапалық анализ курсынан
лабораториялық сабақтар жүргізуге арналған
ӘДІСТЕМЕЛІК НҰСҚАУ
(II бөлім)
Шымкент 2021
ОҢТҮСТІК ҚАЗАҚСТАН МЕМЛЕКЕТТІК ПЕДАГОГИКАЛЫҚ УНИВЕРСИТЕТІ
ЖАРАТЫЛЫСТАНУ ФАКУЛЬТЕТІ
ХИМИЯ КАФЕДРАСЫ
Аналитикалық химия
Сапалық анализ курсы
(лабораториялық практикум)
Аналитикалық химияның
Сапалық анализ курсынан
лабораториялық жұмыстарға арналған
ӘДІСТЕМЕЛІК НҰСҚАУ
Шымкент 2021
Әдістемелік нұсқауды дайындаған
х. ғ. к., профессор м. а. Мәдібекова Ғ. М.
УДК 543. 063
Оңтүстік Қазақстан мемлекеттік педагогикалық университеті Жаратылыстану факультеті оқу-әдістемелік Кеңесінің мәжілісінде (№ хаттама, 2018 ж) бекітілді.
4 баспа табақ.
Пікір жазғандар:
- Шитыбаев С. А. - х. ғ. к., доцент
- Муталиева Б. Ж. - х. ғ. к., доцент
Әдістемелік нұсқау 6В01504 - Химия, 6В01507- Химия-биология мамандығы студенттеріне арналған. Әдістемелік нұсқауға аналитикалық химия пәнінің сапалық анализ курсы бойынша жүргізілетін лабораториялық сабақтардың әдістемелері енгізілген.
© Мәдібекова Ғ. М. САПАЛЫҚ АНАЛИЗ.
(лабораториялық практикум)
БЕСlНШl АНАЛИТИКАЛЫҚ ТОП КАТИОНДАРЫНЫҢ САПАЛЫҚ РЕАКЦИЯЛАРЫ
Жұмыс мақсаты: V аналитикалық топ катиондарының қасиеттерiн сапалық реакцияларына тәжiрибе жасау негiзiнде үйрену
1. Жалпы сипаттамасы
V- аналитикалық топты Mg 2+ , Sb(III, V), Bi 3+ , Mn 2+ , Fe 2+ , Fe 3+ катиондары құрайды. Бұл катиондар периодтық системада әр түрлi топтарда, топшаларда орналасқан. Mg - IIA, Sb, Bi - VA, Mn - VIIA, Fe - VIIIB топшаларында орналасқан. Атом құрылыстары да әртүрлi. Мысалы, марганецпен темiр иондарының сыртқы деңгейшелерi аяқталмаған, демек 18-электронға әлi жетпеген бұл d-элементтерi. Химиялық реакциялар кезiнде ауыспалы тотығу дәрежелер көрсетедi. Әсiресе темiр иондары бос деңгейшелерiнiң арқасында комплекстi қосылыстар түзедi.
Сурьма мен висмут иондарында аяқталмаған 18-электрондық деңгейшелерi бар. Бұл амфотерлi иондар, бiрақ сiлтiлер әсерiнен тұнбаға түсетiнболғандықтан және тотығу дәрежелерi ауыспалы болуына байланысты V-топқа қосқан.
Магний S-элемент, ион күйiнде 8-электрондық деңгейшiсi бар. Сiлтi әсерiнен тұнбаға Mg(OH) 2 түседi.
Бұл аналитикалық топ катиодарының нормальды стандартты потенциалдары әртүрлi, кестеде көрсетiлгендей, олардың сұйытылған қышқылдармен түрлi әрекет етуiнiң өзi осыған негiзделген.
Жүйе Mg 2+ /Mg Mn 2+ /Mn 0 Fe 2+ /Fe 0 Sb 3+ /Sb 0 Bi 3+ /Bi 0
E 0 B -2, 34 -1, 1 -0, 44 -0, 20 +0, 23
Магний, марганец, темiр сұйытылған HCI, H 2 SO 4 қышқылдар ерiтiндiсiнен сутектi бөлiп шығарады.
Fe+ H 2 SO 4 = FeSO 4 +H 2 🡩
Mn + 2HCI = MnCI 2 +H 2 🡩
Сурьма мен висмут сұйытылған қышқылдарда ерiмейдi. Осы топты құрайтын металдар тотықтырғыш қышқылдармен әрекеттеседi:
2Sb + 6H 2 SO 4 = Sb(SO 4 ) 3 + 3SO 2 🡩 + 6H 2 O
3Sb + 5HNO 3 = 3HsbO 3 🡫 +5NO🡩 + H 2 O
Магний оксид MgO және гидроксид түзедi, олар тек негiздiк қасиет көрсетедi.
FeO мен Fe(OH) 2 негiздiк қасиет көрсетедi, сондықтан FeSO 4 , FeCI 2 т. б. тұздардың су ерiтiндiлерiнде гидролиздену процестерi баяу жүредi. Fe 2 O 3 пен Fe(OH) 3 кейбiр жағдайда амфотерлi қасиет көрсетедi, мысалы NaFeO 2 , Ba(FeO 2 ) 2 , Fe(FeO 2 ) 2 , Fe 3 O 4
Марганец түрлi оксидтер түзедi:
MnO, Mn 2 O 3 , MnO 2 , MnO 3 және Mn 2 O 7 бiрiншi екеуiнiң негiздiк қасиетi басым, ал соңғы үшеуiнiң қышқылдық қасиетi жоғары.
Сурьма екi түрлi оксид түзедi; Sb
2
O
3
және Sb
2
O
5
бiрiншiнiң негiздiк қасиетi басым, ал Sb
2
O
5
- қышқылдық қасиет көрсетедi. Sb
2
O
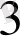 қышқылдардада, сiлтiлерде де еридi:
қышқылдардада, сiлтiлерде де еридi:
Sb 2 O 3 + 2NaOH = NaSbO 2 + H 2 O
Sb 2 O 3 + 6HCI = 2SbCI 3 + 3H 2 O
Sb 2 O 5 қышқылдарда еридi:
Sb 2 O 5 + 12HCI = 2H[SbCI 6 ] + 5H 2 O
Жаңа даярлаған Sb 2 O 5 KOH-те еридi, бiрақ NaOH ерiмейдi:
Sb 2 O 5 + 6KOH = 2K 3 SbO 4 + 3H 2 O
Жалпы глицериннiң қатысумен сiлтiлерде еридi. Бұл топ катиондарының тұздары гидролизденедi, оның iшiнде сурьма мен висмуттың тұздары ерекше орын алады:
Sb 3+ + HOH = SbO + + 2H +
Bi 3+ + HOH = BiO + + 2H +
SbO + - антимонил ионы, BiO + - висмутил ионы. Магнийдiң хлоридi, бромидi, сульфаты, нитраты суда жақсы еридi. Суда ерiмейтiн түрлi қосылыстар түзедi: Mg(OH) 2 , MgCO 3 , MgNH 4 PO 4 6H 2 O, MgNH 4 AsO 4 6H 2 O, MgC 2 O 4
Темiрдiң сульфаттары, хлоридтерi, нитраттары суда жақсы еридi. Ерiмейтiн қосылыстарының: сульфидтерiнiң, гидроксидтеiнiң, карбонаттарының, фосфаттарының маңызы зор.
Талдауда жиi қолданатын сурьма қосылыстары: сульфидтер және сурьма қышқылдарының күмiс тұздары Sb 2 S 3 , Sb 2 S 5 , Ag 3 SbO 3 , AgSbO 4 , натрий дигидроантимонаты NaH 2 SbO 4 .
Марганецтiң хлоридi, бромидi, иодидi, сульфаты, нитраты суда жақсы еридi, ал сульфидi, карбонаты, оксалаты, фосфаты суда нашар еридi. Висмуттың суда ерiмейтiн қосылыстарының iшiнде Bi 2 S 3 , Bi(OH) 3 , BiPO 4 , (BiO) 2 Cr 2 O 7 , BiI 3 талдауда маңызы зор.
Топтық реагентiнiң әсерi.
Топтық реагентi NaOH ерiтiндiсi, оның әсерiнен гидроксидтер түзiледi. Fe(OH) 2 - жасыл, Fe(OH) 3 - қо”ыр, Mn(OH) 2 , Bi(OH) 3 , Sb(OH) 3 , SbO(OH) 3 , Mg(OH) 2 - ақ.
Fe 2+ + 2NaOH = Fe(OH) 2 🡫 +2Na +
Bi 3+ + 3NaOH = Bi(OH) 3 🡫 + 3Na +
Жүйелiк анализде IV мен V аналитикалық топтарды бiр-бiрiнен бөлгенде H 2 O 2 пайдаланады. Бұл кезде V-аналитикалық топ катиондары, яғни Mn 2+ , Sb(III), Fe 2+ сутек пероксидiнiң әсерiнен тотығады:
Mn(OH) 2 + H 2 O 2 = MnO(OH) 2 + H 2 O
Mn(OH) 2 + OH - -2e🡪 MnO(OH) 2 + H + 1
H
2
O
2
+ 2e🡪2OH
-
 1
1
Осы сияқты сурьмада тотығады:
Sb(OH) 3 + H 2 O 2 = SbO(OH) 3 +H 2 O
Sb(OH) 3 + OH - - 2e🡪SbO(OH) 3 + H + 1
H 2 O 2 + 2e🡪2OH - 1
Висмут гидроксидiн қыздырғанда тұнба сарғаяды:
Bi(OH)
3
 BiOOH + H
2
O
BiOOH + H
2
O
Топтық реагентiнiң әсерiнен түзiлген тұнбалар, реагенттiң артық мөлшерiнде ерiмейдi.
- П а й д а л а н ы л у ы
Магний қосылыстары адам және жануарлар клеткаларының құрамында кiредi, сонымен қатар өсiмдiк хлорофилiнiң құрамында да кездеседi. Адам организмiнде 0, 1 процент, ал өсiмдiктердiң құрамында 2 процентке дейiн магний болады.
Магний оксидi MgO асқазан қышқылдарын бейтараптандыру үшiн пайдаланылады, терi ауруларды емдейтiн майлардың құрамының бiр бөлiгi болып табылады. Магнийдiң гидроксокарбонаты - асқазан қышқылдығын бейтараптандыру және организм iшiндегi залалды қосылыстарды адсорбциялау үшiн қолданылады. Магний сульфаты MgSO 4 7H 2 O (Magnesium sulfuricum) шек, өт ауруларын емдеуде, наркотик ретiнде де пайдаланады.
Темiр иондары адам клеткаларының құрамында өте аз мөлшерде болады, көбiне органикалық қосылыстар күйiнде бауырда кездеседi. Адам организмiнде 4, 25 г. темiр бар, оның 57 процентi гемоглобиннiң құрамына кiредi. Темiр (II) иондары қан гемоглобинiнiң, тотықтырғыш ферменттердiң құрамына кiредi. Темiр иондары қан тасымалдайтын органдардың жұмыс жасауын арттырады. Организмде темiр жеткiлiксiз болған кезде түрлi аурулар пайда болады. Ал өсiмдiктердiң құрамында темiр жеткiлiксiз болғанда, олар хлороз деген ауруға шалдығады (жапырақтар сарғыштанады) .
Марганец адам және жануарлар организмдерiнде кездеседi: жүректе, бауырда, сүйекте. Ол клеткаларда, тканьде жүретiн тотығу-тотықсыздану процестерiн активтендiредi, қан түзiлу, өсу процестерiне әсер етедi. Адам организмiнде марганец жеткiлiксiз болған кезде сүйек қалыптасу, өсу процестерi нашарлайды. Марганец адам организмiнде өсiмдiк арқылы жеткiзiледi. Марганец қосылыстары залалды, олардың көп мөлшерi нерв жүйесi ауруына әкелiп соғады. Калий перманганаты ерiтiндiлерi дизенфекциялау үшiн қолданылады. (Жараларды жуады, тамақ шаяды, күйген жерлердi емдейдi) .
Висмутилдiң гидроксонитраты (BiO) 2 (OH) NO 3 ұнтақ күйiнде асқазан ауруын емдеу үшiн пайдаланылады, сонымен қатар iсiп қызару процестерiн емдейтiн майлардың, пасталардың, ұнтақтардың құрамына кiредi. Висмут өте аз мөлшерiнде адам организмiнде анықталған: жалын сұйығында, мида, организмге керектi заттарды жасап шығаратын бездерде, бауырда т. б. органдарда.
Гильминтозды емдеуде сурьманың қосылысы K(SbO) C 4 H 4 O 6 H 2 O қолданылады. Сурьма қосылыстарының залалдығы мышьяк қосылыстарына қарағанда төмен (адам сурьма (III) хлоридiнiң 0, 12 г. -1, 0 г. мөлшерiнде мерт болады) .
3. IV-аналитикалық топ катиондарының реакциялары
Sb(III) және (V) иондарының реакциялары
- NaOH, KOH, NH4OH әсерi
Sb(III) иондары сiлтi және аммиак ерiтiндiлерiмен метасурьма қышқылының ақ түстi тұнбасын түзедi:
H 3 [SbCI 6 ] + 6NaOH = Sb(OH) 3 🡫 + 6NaCI + 3H 2 O
3H + + [SbCI 6 ] 3- + 6OH - = Sb(OH) 3 🡫 + 6CI - + 3H 2 O
Тұнба сiлтiлердiң артық мөлшерiнде және күштi қышқылдарда еридi:
Sb(OH) 3 🡫 + NaOH = Na[Sb(OH) 4 ]
Sb(OH) 3 🡫 + OH - = [Sb(OH) 4 ] -
Р е а к ц и я н ы ң о р ы н д а л у ы
Сурьма (III) тұзы ерiтiндiсiнiң 2-3 тамшысына 1-2 тамшы сiлтi ерiтiндiсiн қосып, тұнба түзiлгенiн байқау. Тұнбаны екiге бөлiп HCI және NaOH ерiтiндiлерiнде ерiту қажет.
2. Гидролиз реакциясы
Sb(III) тұздарының сұйытылған ерiтiндiлерi, әсiресе қыздырған кезде гидролизденедi. Реакция нәтижесiнде ақ түстi негiзiдiк тұздар түзiледi:
SbCI 3 + HOH = SbOCI + 2HCI
Sb 3+ + 3CI - + HOH = SbOCI + 2H +
SbO + бiр зарядты катионнын ролiн атқарады. Тұз қышқылында еридi.
Р е а к ц и я н ы ң о р ы н д а л у ы
Сурьма (III) тұзы ерiтiндiсiнiң 2-3 тамшысына 5-6 тамшы
дистилденген су қосып, буландырғышта қыздыру қажет.
3. Na 2 S 2 O 3 әсерi
Әлсiз қышқыл ортада сурьма (III) тұздары мен натрий тиосульфатын қыздырған кезде қызыл түстi сурьма (III) оксидiнiң дисульфидi тұнбаға түседi.
2SbCI 3 + 2Na 2 S 2 O 3 + 3H 2 O = Sb 2 OS 2 🡫 + 2Na 2 SO 4 + 6HCI
2Sb 3+ + 2S 2 O 3 2- + 3H 2 O = Sb 2 OS 2 🡫 + 2SO 4 2- + 6H +
Р е а к ц и я н ы ң о р ы н д а л у ы
Сурьма (III) тұзы ерiтiндiсiнiң 2-3 тамшысына әлсiз қышқылдық ортада 2-3 тамшы Na 2 S 2 O 3 ерiтiндiсiн қосып, буландырғышта қыздырады.
- H2S (III) әсерi
Күкiрттi сутек қышқылдық ортада сурьма (III) иондарымен ашық қызғылт сары түстi аморфты тұнба түзедi:
2SbCI 3 + 3H 2 S = Sb 2 S 3 🡫 + 6HCI
2Sb 3+ + 3H 2 S = Sb 2 S 3 🡫 + 6H +
Сұйытылған бейтарап ерiтiндiлерден түстi коллоидтi ерiтiндi Sb 2 S 3 түзiледi. Сурьма (III) сульфидi Na 2 S, (NH 4 ) 2 S, (NH 4 ) 2 S 2 , NaOH ерiтiндiлермен тиотұздар бередi:
Sb 2 S 3 + 3(NH 4 ) 2 S = 2(NH 4 ) 3 SbS 3
Sb 2 S 3 + 3(NH 4 ) 3 S 2 = 2(NH 4 ) 3 SbS 4 + S
Тиотұздар тұрақсыз қосылыстар, олар тұз қышылдарының әсерiнен бұзылады да, сульфид тұнбаға түседi:
2(NH 4 ) 3 SbS 3 + 6HCI = Sb 2 S 3 🡫 + 3H 2 S🡩 + 6NH 4 CI
Сурьма (III) сульфидi 6н. ТЅз қышқылы ерiтiндiсiнде еридi (As 2 S 3 , As 2 S 5 ерiмейдi) .
Sb 2 S 3 + 6HCI = 2 SbCI 3 + 3H 2 S🡩
Азот қышқылымен нашар еритiн ақ түстi HsbO 3 түзедi:
3 Sb 2 S 3 + 10HNO 3 = 6HsbO 3 + 9S +10NO + 2H 2 O
немесе Sb 2 S 3 + 28HNO 3 = 2HsbO 3 + 3H 2 SO 4 + 28NO 2 + 10H 2 O
Sb 2 S 3 + 18H 2 O - 28e 🡪 2HsbO 3 + 3SO 4 2- + 34H +
NO 3 - + 2H + +1e 🡪 NO 2 + H 2 O
Sb 2 S 3 + 28NO 3 - + 22H + 🡪 2HsbO 3 + SO 4 2- + 28NO 2 + 10H 2 O
Sb 2 S 3 , NH 4 OH және (NH 4 ) 2 CO 3 ерiтiндiлерiнде ерiмейдi (мышьяк сульфидтерiнен айырмашылығы) .
Р е а к ц и я н ы ң о р ы н д а л у ы
Сурьма (III) тұзы ерiтiндiсiнiң 4-5 тамшысына 1-2 тамшы 2н. HCI ерiтiдiсiн қосып күкiрттi сутек жiберу қажет. (Реакция сорғыш шкафта орындалады) .
- Дербес металдармен тотықсыздандыру
Кернеу қатарында сурьмаға дейiн орналасқан металдар оны бос күйге дейiн тотықсыздандырады:
2H 3 [SbCI 6 ] + 3Sn = 2Sb🡫 + 3H 2 [SnCI 4 ]
2H 3 [SbCI 6 ] + 3Fe = 2Sb🡫 + 3FeCI 2 + 6HCI
Sb(V) иондарының реакциялары
1. Гидролиздену реакциясы
Сурьма (V) тұздары ерiтiндiлерiн сұйылтқан кезде, олар гидролизденедi, нәтижесiнде ақ түстi тұнба SbO 2 CI түзiледi:
H[SbCI 6 ] + 2H 2 O = SbO 2 CI🡫 + 5HCI
[SbCI 6 ] - + 2H 2 O = SbO 2 CI🡫 + 4H + + 5CI -
Р е а к ц и я н ы ң о р ы н д а л у ы
Ерiтiндiнiң 2-3 тамшысына 4-5 тамшы дистилденген су қосып, буландырғышта қыздырады.
2. NaOH, KOH, NH 4 OH әсерi
Сiлтiлер мен аммиак ерiтiндiлерi сурьма (V) тұздарымен әрекеттесiп метасурьма қышқылын түзедi:
H[SbCI 6 ] + 6NaOH = SbO(OH) 3 🡫 + 6 NaCI + 2H 2 O
H + + [SbCI 6 ] - + 6OH - = SbO(OH) 3 🡫 +6CI - + 2H 2 O
Р е а к ц и я н ы ң о р ы н д а л у ы
Ерiтiндiнiң 2-3 тамшысына 1-2 тамшы NaOH (KOH, NH 4 OH) ерiтiндiсiн қосады.
3. H 2 S әсерi
Күкiрттi сутек қышқылортада сурьма (V) иондарымен қызғылт сары-қызыл түстi тұнба түзедi:
2H[SbCI 6 ] + 5H 2 S = Sb 2 S 5 🡫 + 12HCI
2[SbCI 6 ] - + 5H 2 S = Sb 2 S 5 🡫 + 10H + + 12CI -
Сурьма (V) сульфидi (NH 4 ) 2 S, (NH 4 ) 2 S 2 , Na 2 S, NaOH ерiтiндiлерiнде еридi, бiрақ NH 4 OH, (NH 4 ) 2 CO 3 ерiтiндiлерiнде ерiмейдi:
Sb 2 S 5 + 3 (NH 4 ) 2 S = 2(NH 4 ) 3 SbS 4
4 Sb 2 S 5 + 24NaOH = 5Na 3 SbS 4 + 3Na 3 SbO 4 + 12H 2 O
Тиотұздар тұрақсыз, олар қышқылды ортада ыдырайды:
2(NH 4 ) 3 SbS 4 + 6HCI = Sb 2 S 5 🡫 + 3H 2 S🡩 + 6NH 4 CI
2SbS 4 3- + 6H + = Sb 2 S 5 🡫 + 3H 2 S🡩
Сурьма (V) сульфидi 6н. HCI ерiтiндiсiнде еридi:
Sb 2 S 5 + 12HCI = 2H 3 [SbCI 6 ] + 3H 2 S🡩 + 2S🡫
Р е а к ц и я н ы ң о р ы н д а л у ы
Сурьма (V) тұз ерiтiндiсiнiң 4-5 тамшысына 1-2 тамшы ерiтiндiсiн қосып күкiрттi сутек жiбередi. (Реакцияны сорғыш шкафта орындайды) .
4. Мырыштың, алюминийдiң, темiрдiң әсерi
Металдар сурьма (V) иондарын бос күйге дейiн тотықсыздандырады:
2H[SbCI 6 ] + 5Fe = 2Sb🡫 + 5FeCI 2 + 2HCI
2[SbCI 6 ] - + 5Fe = 2Sb🡫 + 5Fe 2+ + 12CI -
Қара түстi тұнба түзiледi.
Р е а к ц и я н ы ң о ры н д а л у ы
Сурьма (V) ерiтiндiсiне бiр түйiршiк мырыш (темiр) салып қара тұнба түзiлгенiн байқау.
Висмут (III) катионының реакциялары
- NaOH, KOH, NH4OH әсерi
Сiлтi мен аммиак ерiтiндiлерi әсерiнен висмут (III) ақ гидроксид түзедi:
BiCI 3 + 3NaOH = Bi(OH) 3 🡫 + 3NaCI
Bi 3+ + 3OH - = Bi(OH) 3 🡫
Висмут және висмутил гидроксидтерi қышқылдарда еридi.
Р е а к ц и я н ы ң о р ы н д а л у ы
Висмут (III) тұзы ерiтiндiсiнiң 2-3 тамшысы осынша тамшы KOH, NH 4 OH ерiтiндiсiн қосады.
- Судың әсерi (гидролиз)
Гидролиздену нәтижесiде висмуттың негiздiк тұздары тұнбаға түседi:
BiCI 3 + 2HOH = Bi(OH) 2 CI🡫 + 2HCI
Бұл тұнба ақ түстi, бiрақ ол тұрақсыз, сондықтан:
Bi(OH) 2 CI = BiOCI🡫 + H 2 O
Катионның ролiн BiO + (висмутил) орындайды.
Р е а к ц и я н ы ң о р ы н д а л у ы
Висмут (III) тұзы ерiтiндiсiнiң 2-3 тамшысы 8-10 тамшы су қосып тұнба түзiлуiн байқау.
3. H 2 S әсерi
Күкiрттi сутектiң әсерiнен қара-қоныр висмут сульфидi түзiледi:
2BiCI 3 + H 2 S = Bi 2 S 3 🡫 + 6HCI
2Bi 3+ + 3H 2 S = Bi 2 S 3 🡫 + 6H +
Сульфид сұйытылған HCI, H 2 SO 4 HNO 3 ерiтiдiлерiнде ерiмейдi. Бiрақ 2н. HNO 3 ерiтiндiсiнде еридi:
Bi 2 S 3 + 8HNO 3 = 2Bi(NO 3 ) 3 + 3S🡫 + 2NO🡩 + 4H 2 O
Bi 2 S 3 -6e 🡪 2Bi 3+ + 3S 1
NO 3 - + 4H + + 3e 🡪 NO + 2H 2 O 2
Висмут сульфидi тиотұздар түзбейдi.
Р е а к ц и я н ы ң о р ы н д а л у ы
Зерттелетiн ерiтiндiнiң 2-3 тамшысына күкiрттi сутек жiбередi (реакция сорғыш шкафта орындалады) .
4. Na 2 HPO 4 әсерi
Реакция нәтижесiнде ақ түстi висмуттың фосфаты түзiледi:
BiCI 3 + Na 2 HPO 4 = BiPO 4 🡫 + 2NaCI + HCI
Тұнба сұйытылған CH 3 COOH, HNO 3 ерiтiндiлерiнде ерiмейдi, бiрақ концентрлi HCI ерiтiндiсiнде еридi.
Р е а к ц и я н ы ң о р ы н д а л у ы
Висмут (III) тұзы ерiтiндiсiнiң 2-3 тамшысына осынша тамшы Na 2 HPO 4 ерiтiндiсiн қосады.
5. Сiлтiлiк ортада қалайы (II) хлоридiнiң әсерi
Станнум (II) хлоридi сiлтiлiк ортада висмут (III) ионын дербес күйге дейiн тотықсыздандырады. Алдымен SnCI 2 ерiтiндiсiнен натрий станиттiн алады:
SnCI 2 + 4NaOH = Na 2 SnO 2 + 2NaCI + 2H 2 O
Sn 2+ + 4OH - = SnO 2 2- + 2H 2 O
Осы ерiтiндiге висмут (III) тұзы ерiтiндiсiн қосады, алдымен:
BiCI 3 + 3NaOH = Bi(OH) 3 🡫 + 3NaCI
Одан соң:
2Bi(OH) 3 + 3Na 2 SnO 2 = 2Bi🡫 + 3Na 2 SnO 3 + 3H 2 O
Bi(OH) 3 + 3e 🡪 Bi + 3OH - 2
SnO 2 2- + 2OH - -2e 🡪 SnO 3 2- + H 2 O 3
Реакция нәтижесiнде қара түстi тұнба түзiледi. Реакция өте сезгiш.
Р е а к ц и я н ы ң о р ы н д а л у ы
SnCI 2 ерiтiндiсiнiң 2-3 тамшысына NaOH, KOH ерiтiндiсiн тамшылап қосады, түзiлген тұнба толық ерiгенше, тағы артық 1-2 тамшы NaOH қосады. Осы ерiтiндiге Bi 3+ ерiтiндiсiн қосып, қара түстi тұнба түзiлгенiн байқайды.
6. K 2 CrO 4 және K 2 Cr 2 O 7 әсерi
Хромат және дижромат иондары висмут (III) иондарымен әлсiз қышқыл ортада висмутил дихроматы (BiO) 2 Cr 2 O 7 деген сары түстi тұнба бередi:
2BiCI 3 + K 2 Cr 2 O 7 + 2H 2 O = (BiO) 2 Cr 2 O 7 🡫 + 2KCI + 4HCI
2Bi 3+ + Cr 2 O 7 2- + 2H 2 O = (BiO) 2 Cr 2 O 7 🡫 + 4H +
Бұл тұнба сiрке қышқылында еридi, ал сiлтiлерде ерiмейдi.
Р е а к ц и я н ы ң о р ы н д а л у ы
Висмут (III) тұзы ерiтiндiсiнiң 2-3 тамшысына осынша тамшы K 2 Cr 2 O 7 ерiтiндiсiн қосады.
7. KI әсерi
Калий иодидi висмут (III) иондарының концентрлi ерiтiндiлерiмен BiI 3 қара тұнба түзедi:
BiCI 3 + 3KI = BiI 3 🡫 + 3KCI
Bi 3+ + 3I - = BiI 3 🡫
Тұнба реагенттiң артық мөлшерiнде еридi, реакцияның нәтижесiнде қызғылт сары түстi ерiтiндi түзiледi:
BiI 3 + KI = K[BiI 4 ]
Ерiтiндiнi сұйылтқан кезде, қайтадан қара тұнба түседi:
K[BiI 4 ] = BiI 3 🡫 + KI
Сұйылту дәрежесi өте жоғары болған кезде қызғылт сары түстi висмутил иодидi тұнбаға түседi:
K[BiI 4 ] + HOH = BiOI🡫 + KI + 2HI
Р е а к ц и я н ы ң о р ы н д а л у ы
Висмут (III) тұзы ерiтiндiсiнiң 2-3 тамшысына тамшылап KI ерiтiндiсiн қосады. Алдымен тұнба түзiлгенiн байқайды. Содан соң тұнбаға реагенттiң артық мөлшерiн қосады.
8. Na 2 CO 3 , K 2 CO 3 , (NH 4 ) 2 CO 3 әсерi
Висмут (III) иондары карбонат иондарымен висмуттың оксикарбонатын түзедi:
2BiCI 3 + 3Na 2 CO 3 + HOH = 2Bi(OH) CO 3 🡫 + CO 2 🡩
2Bi 3+ + 3CO 3 2- + HOH = 2Bi(OH) CO 3 🡫 + CO 2 🡩
Р е а к ц и я н ы ң о р ы н д а л у ы
Висмут (III) тұзы ерiтiндiсiнiң 2-3 тамшысына осынша тамшы Na 2 CO 3 немесе (NH 4 ) 2 CO 3 ерiтiндiсiн қосады.
Темiр(II) катионының реакциялары
I. Na OH, KOH әсерi
Сiлтiлер темiр (II) иондарымен әрекет еткенде ақ түстi темiр /II / гидроксидiн түзедi
FeCl 2 + 2 KOH = Fe(OH) 2 ↓ + 2 KCl
Fe 2+ + 2 OH - = Fe(OH) 2 ↓
Бiрақ бұл тұнба ауада тез тотығады да, жасылдан қызыл-қоңыр түске дейiн өзгередi.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz