Физикалық химия зертханалық жұмыстары: калориметрия, гетерогенді тепе-теңдік, таралу коэффициенті, қаныққан бу қысымы, седиментация және коллоидты жүйелер


№ 3-4 зертханалық жұмыс. Тұздардың
интегралды еру жылуын анықтау
Теориялық мәліметтер
Түрлі химиялық реакциялардың жылулық эффектілерін, заттардың жылусыйымдылықтарын эксперименттік анықтау конструкциясы сан-алуан калориметрлерде жүргізіледі. Бұл жұмыс қақпағының саңылауына термометр мен тұзға арналған сынауық салынатын, жылуөткізгіштігі төмен материалдан (органикалық шыныдан) жасалған калориметрлік ыдыстан тұратын калориметрде жүргізіледі. Калориметрді магнитті араластырғышқа орнатады. Тәжірибе кезінде калориметрлік жүйедегі қысым атмосфералық қысымға тең тұрақты қысым (ашық типті калориметр) болатындықтан, зерттелетін үрдістің жылулық эффектісі:
Q P = ∆ H (1)
∆ Н анықтауда жылуалмасу шамасы мен қателікті кеміту үшін шарттарды дұрыс таңдау қажет: тәжірибе ұзақтығы 7÷10 минут болып, калориметр температурасы қоршаған орта температурасынан қатты ерекшеленбеуі тиіс.
Калориметрлік тәжірибедегі үрдістің жылулық тепе-теңдігі келесі өрнекпен өрнектеледі:
∆ Н=C K ∆ t (2)
мұндағы С к - калориметрлік жүйенің барлық бөліктерінің жылусыйымдылықтарының қосындысына тең оның жылусыйымдылығы. С К =С i m i ; С К егер тұз бен еріткіш (су) салмағын тұрақты түрде алғандағы түрлі тұздармен сол калориметрдегі тәжірибелер кезінде тұрақты қалады. Қарама-қайшы жағдайда:
C= (G-+g) С + K =∆Н/ ∆ t (3)
Мұндағы: Q - су сынамасы;
g - тұз сынамасы;
С - іс-жүзінде судағы бейорганикалық тұздардың барлық ертінділері үшін
бірдей ертіндінің меншікті жылусыйымдылығы; С = 0, 98 кал/гК = 4, 1 Дж/г К;
К - су мен тұз сынамаларының жылусыйымдылықтары кірмейтін, калориметрлік жүйенің барлық бөліктерінің жылусыйымдылықтарының қосындысына тең оның тұрақтысы;
∆t - графиктік түрде анықталатын еру үрдісіндегі температура өзгерісі.
Жұмыс екі: І және ІІ тәжірибелерінен тұрады.
1. Су эквиваленті әдісімен - белгілі жылу эффектісімен реакцияны жүргізу жолымен - суда КСІ еріту жолымен калориметрлік жүйенің жылусыйымдылығын немесе калориметр тұрақтысын анықтайды.
0, 5 кг судағы 10, 35 г. КСІ еру жылуы келесіні құрайды:
∆Н KCI = 2436, 8 Дж.
1. Калориметрге бөлме температурасына ие 0, 5 кг (0, 5 л) суды құйып, оны магнитті араластырғышқа орналастырады.
2. Келіде мұқият ұсақталған КСІ тұзының сынамасын (10, 35 г. ) аналитикалық таразыда өлшеп алып, оны калориметр қақпағына бекітілген сынауыққа салады.
3. Қақпақ саңылауына термометрді оның сынаптық резервуары суға бататындай деңгейде орналастырады да, магнитті араластырғыш стерженін салып, араластырғышты іске қосады.
4. Әрбір 30 секунд (0, 5 минут) сайын температура өзгерісін жазып отырады.
5. Температураның біркелкі өзгерісін анықтаған соң (шамамен «алдыңғы кезең» температуралардың 10 есебінде), калориметрге тұзды енгізіп, оны сынауықтан суға жылдам себелейді де, бос сынауықты бастапқы орнына қойып, температураны белгілеуді жалғастырады. Тұздың еруі нәтижесінде калориметрдегі температура жылдам өзгереді. Бұл «негізгі кезең».
6. Су мен қоршаған орта температураларының теңесуі басталған кезде, «негізгі кезең» аяқталып, «соңғы кезең» басталады. Осы кезеңдегі 8÷10 өлшеуден кейін тәжірибені аяқтайды. Алынған мәліметтерді кестеге енгізеді:
Эксперименттік мәліметтер негізінде миллиметрлік қағазда калориметрлік тәжірибе барысындағы уақытқа қарай температура өзгерісінің графигін сызады. Графиктен KCI температуралық өзгерісін ∆t табады.
Мысал график суретте кескінделген, мұндағы АВ - «алдыңғы кезең»; ДЕ - жүйе бастапқы күйіне оралған кездегі «соңғы кезең»; ВД - тұз еруінің «негізгі кезеңі».
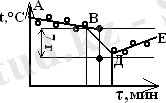
Сурет - Ертінді температурасының уақытқа тәуелділігі
Д және В нүктесінен уақыт өсіне перпендикуляр түсіріліп, В I Д I кесіндісі теңдей бөлінеді де, оның ортасынан ДЕ және АВ жалғасымен (түзуімен) қиылысқанша перпендикуляр салынады, ал бұл ізделінді шама - ∆ t KCI. Калориметрлік жүйенің жылусыйымдылығы келесіге тең:
C к =
,
( ∆ Н KCI = 2436, 8 Дж. )
Кейін (3) формула бойынша калориметр тұрақтысын К есептейді (KCI сынамасы - g KCI =10, 35 г, су сынамасы G - 500 г) .
II. Оқытушы берген тұздың еруінің интегралдық жылуын ∆ Н т анықтауды КСІ-мен жүргізілген І тәжірибедегідей бірізділікпен жүзеге асырады. τ-t графигінен температура өзгерісін ∆t т анықтайды. Кейін 2 немесе 3 формула бойынша алынған тұз сынамасы үшін бөлінген жылу мөлшерін ∆ Н т есептейді.
Тұздың еруінің меншікті жылуы (судағы 1 г тұздың еру жылуы) тұздың грамм g с санына есептелеген ∆ Н т шамасын бөлу жолымен есептеледі . Мольдік жылуды ∆ Н т шамасын тұз молінің шамасына бөле отырып, алады:
n = g/м.
№ 5-6 зертханалық жұмыс.
Гетерогендік жүйелердегі химиялық тепе-теңдікті зерттеу
Теориялық мәліметтер
Металл карбонаттары жоғары итемпературалар кезінде келесі теңдеу бойынша диссоциациаланады:
МеСО
3
 МеО + CO
2
МеО + CO
2
К т константасы CO 2 қысымымен анықталады (уравнение П. 16) .
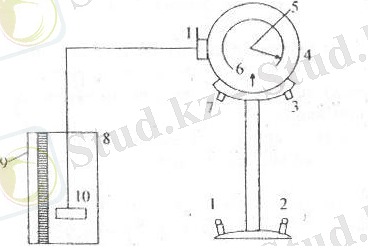
Жұмыс суретте кескінделген қондырғыда жүргізіледі.
Көмірқышқылды кальций сынамасы бар кварцтық ампула 1 пештің ыстық кеңістігінде (жаровая пространства) 2 орналасады. Пеш қыздыру жылдамдығын сатылы реттегішпен (ЛАТР) 3 жабдықталған. Температура милливольтметрмен 5 қосылысқан терможұптар 4 көмегімен өлшенеді. Терможұптардың салқын спайлары Дюар ыдысына 6 батырылып, бөлме температурасында болады. 100÷120 мм сынап бағанасына дейінгі СО 2 қысымы жабық манометр 7 көмегімен, ал ол мәннен жоғары - ашық манометр көмегімен 8 өлшенеді. Жабық манометрдегі деңгейлер айырмасының жүйедегі қысымның абсолюттік шамасын, ал ашық манометрдегі деңгейлер айырмасының - жүйедегі қысымның атмосфералық қысымнан қаншалықты жоғары екендігін көрсететіндігін еске саламыз.
Туынды нәтижелерді алу үшін барлық өлшеулерді 2 мәрте қайталап жүргізеді.
4
1
6
3
2
5
8
7
Сурет - Жоғары температуралар кезіндегі гетерогендік реакциялар
тепе-теңдігін өлшеуге арналған қондырғы сызбасы
Тәжірибені пешті қосудан бастайды. СО 2 қысымын өлшеуді жүйе температурасы 6ОО °С-қа жеткеннен кейін ғана бастау қажет. Бұдан кейін, милливольтметр 600°С температураны көрсеткен соң, пешті қыздыруды тоқтатады. Инерция күшінен милливольтметр бағдаршасы оңға қарай жылжуын жалғастырады. Милливольтметр көрсеткен максималды температураны және, сәйкесінше, манометр бойынша максималды қысымды жазып алады. Өлшеулер жүргізілген соң, пешті қайтадан қосады. Әрбір кезекті өлшеуді 10÷20 °C сайын жүзеге асырады. СО 2 қысымы 300÷350 мм сынап бағанасына жеткен кезде өлшеуді тоқтатады. Пешті ажыратып, оны 500 °С-қа дейін суытуға қалдырады. Өлшеу нәтижелерін кестеге толтырады.
 =К
т
=К
т
Алынған мәліметтер негізінде lgK Р - I/Т координаттар жүйесінде график тұрғызып, I/T өсіне түзу көлбеуі бұрышының тангенс шамасы бойынша реакцияның жылулық эффектісін анықтайды:
tgφ = - ∆ Н/2, 3 R
Бұдан басқа, ∆ Н° шамасын температуралардың үш интервалына арналған (2. 18) теңдеуі бойынша есептеп, оның орташа мәнін алады да, оны графиктік түрде табылған шамамен салыстырады. ∆ Н° және К т шамалары бойынша қандай-да бір температура кезінде (2. 19) теңдеуі бойынша тұрақтыны есептейді. Алынған теңдіктер көмегімен диссоциация температурасын, яғни СО 2 қысымы 1 атм. (10 5 Па) болатын кездегі температураны есептейді.
Төмендегі теңдеулер көмегімен тәжірибелік мәліметтерді қолдана отырып:
∆ G° = -RTlnК т
∆ G° = ∆ Н° - Т ∆ S°
осы реакция үшін изобаралық потенциал өзгерісі ∆ G ° мен энтропия өзгерісін ∆ S ° табады да, оларды анықтамалық мәліметтермен салыстырады.
№7, 8 зертханалық жұмыс.
Сірке қышқылының өзара араласпайтын екі еріткіште
таралу коэффициентін анықтау
Жұмыстың барысы: 2 н сірке қышқылы (CН 3 COOH) ерітіндісінен әр сынауыққа 2, 5 және 10 мл-ден алып, ішінде алдын-ала құйылып қойылған 10 мл бензолы (С 6 Н 6 ) (немесе толуолы) бар сынауыққа құяды да, тығынмен мезгіл-мезгіл ашып, әр сынауыққа 30 мл дейін дистелденген су (Н 2 О) құяды, содан соң 20 минуттай араластырғыш көмегімен араластырады.
Содан соң ерітінді екі қабатқа толық бөлінуі үшін 20 минуттай тыныш күйге қалдырамыз. Осы аралықта сынауықтың әр қабатындағы қышқылдың концентрациясын анықтаймыз. Ол үшін жоғарғы қабаттан тамызғышпен 2 мл алып, колбаға құяды да, 1 тамшы фенолфтолейн және 10 мл дистелденген Н 2 О қосып, 0, 1 н NaOH ертіндісімен титрлейді. Ерітінді солғын таңқурай түске боялғанда, титрлеуді тоқтатып, бюреткадан титрлеуге неше (мл) ерітінді (сілті) жұмсалғанын жазып алады. Бұл үрдісті әрбір ерітінді үшін 3 рет қайталап, жеке-жеке орта мәнді анықтау керек. Сонан соң тамызғыш арқылы қоспаның су қабатынен 2 мл алып, 1-2 тамшы фенолфталейн және 10 мл дистелденген Н 2 О қосып, жоғарыдағы тәжірибені қайталайды. Жоғарғы бензол қабатындағы қышқыл концентрациясын табу үшін келесі көрсетілген грамм эквивалент заңын пайдаланамыз:
С 1 V 1 =C 2 V 2 ; С 1 =С 2 •V 2 /V 1. (1)
Мұндағы: С 1 - бензол қабатындағы қышқылдың белгісіз концентрациясы;
V 1 - титрлеуге алынған ерітінді көлемі (2 мл) ;
С 2 - титрлеуге кеткен сілті концентрациясы;
V 2 - титрлеуге кеткен бюреткадағы сілті көлемі (орташа мәні) .
Төменгі су қабатындағы қышқылдың концентрациясын жоғарыдағыдай етіп анықтау керек:
С 1 'V 1 '=C 2 ' V 2 '; С 1 ' =С 2 ' •V 2 ' /V 1 ' . (1. 1)
Таралу коэффициентін (2) теңдік арқылы табамыз.
Қышқылдың бензол
қабатындағы ерітіндісі
Қышқылдың су
қабатындағы ерітіндісі
Алынған мәліметтер бойынша есептеулер:
1. Қышқылдың бензол қабатындағы концентрацияларын: С 1 , С 2 және С 3 есептейді;
2. Қышқылдың су қабатындағы концентрацияларын С´ 1 , С´ 2 және С´ 3 есептейді;
3. К n =С n /С n ' (2) формуласын пайдаланып, әртүрлі қоспа үшін бөліну коэффициентін анықтайды, яғни:
К 1 =С 1 /С 1 '; К 2 =С 2 /С 2 ' ; К 3 =С 3 /С 3 ' (2. 1)
№ 9, 10 зертханалық жұмыс.
Қаныққан бу қысымы
Қаныққан бу қысымын анықтау үшін студенттерге келесі: хлороформ, бензол, ксилол және т. б. сұйықтарды беруге болады. Осы сұйықтардың қаныққан буларының қысымдарын тәжірибелік түрде өлшеу үшін бұл жұмыста төмендегі суретте көрсетілген қондырғы қолданылады:
4
H 2
H 1
5
2
H 2 O
1
3
6
7
Сурет - Қаныққан бу қысымын өлшеуге арналған қондырғы сызбасы
Ішінде зерттелетін сұйықтығы бар ыдыс (1) қайтарымды мұздатқышпен (2) және колба қыздырғышпен (3) жабдықталады. Зерттелетін сұйықтың асқынқызып кетуін болдырмас үшін, ыдысқа шыны капилляр батырылады. Термометр (4) сұйықтың бетінде орналасуы тиіс.
Тәжірибе басында колба қыздырғышты (3) іске қосылып, қайтарымды мұздатқыш су кранына жалғанады да, су жіберіледі. Термометр 30-35 ºС температураны көрсеткен кезде, вакуумдық сорғышпен (насоспен) жүйедегі ауа манометрдегі (5) сынап бағаны шамамен 500 мм сынап бағанына теңелгенше сорылып алынады. Жүйедегі ауа бірінші кран (6) жабық кезде екінші кран (7) арқылы сорылып алынады. Белгілі-бір ауа сиретілуі орындалғаннан кейін екінші кран (7) жабылады. Жүйе қысымының өзгерісі 10-15 минут ішінде 1-2 мм сынап бағанынан артпаса, онда оның герметикалығы жеткілікті болып есептеледі. Ыдыстағы (1) сұйықтық қайнаған кезде, осы температура мен манометр (5) көрсеткішін белгілеп, жазып алады. Қайнау температурасын алғаш анықтаудан кейін, приборды атмосферамен қатынастырушы бірінші кранды (6) сақтықпен, жүйедегі қысым 40-50 мм сынап бағанына ұлғаятындай түрде баяу ашамыз. Бұл кезде жаңа қысымға жауап беретін сұйықтың қайнау температурасы, сәйкесінше жоғарылайды. Осылайша, 10-15 өлшеу жүргізу қажет. Тәжірибе соңында бірінші кран (6) толық ашылған күйдегі атмосфералық қысым кезінде сұйықтың қайнау температурасын өлшеу қажет.
Жүйедегі манометр (5) ашық болып, ондағы деңгейлер айырмасы атмосфералық қысымның прибор ішіндегі қысымнан артық екендігін көрсетеді. Сұйықтың қайнауы орын алатын қысым барометрлік қысым (Р бар ) мен манометр қысымы (Р мон ) арасындағы айырмаға, яғни Р қайн =P бap - (H 2 -H 1 ) тең.
Термометр бойынша есептеуді 0, 5 ºС-қа дейінгі дәлдікпен, ал манометр мен барометр бойынша есептеуді 0, 5 мм сынап бағанына дейінгі дәлдікпен жүргіземіз. Тәжірибелердің барлық нәтижелерін төмендегі кестеге саламыз:
1/Т
К -1
Н 2 -Н 1 ,
Па
Р б а р ,
Па
Алынған мәліметтер негізінде Р=ƒ(Т), lgР=ƒ(1/Т) графиктерін тұрғызамыз.
№ 11 зертханалық жұмыс. Торсионды таразы көмегімен дисперстік жүйелердің седиментациясын зерттеу
Құралдар мен реактивтер: Торзионды таразы, цилиндр, секундомер, түрлі суспензиялар (сазбалшық ұнтағы, барий сульфаты, алюминий оксиді, бор, цемент) .
Жұмыстың барысы: Алдымен торсионды таразыны жұмысқа даярлайды. Ол үшін столға тірек бұрандалар (1, 2) көмегімен приборды орналастырады. Ілгішке таразының табақшасын іледі. Содан соң арретирді (3) оңға («ашық белгісіне») жылжыту арқылы таразы иінін (5) босатады. Иін көмегімен бағдаршаны нөлге келтіреді. Таразы теңдігін көрсететін бағдаршаны қозғалмайтындай тілшемен (6) дәл келтіру керек. Егер олар теңеспесе, бұранданы (7) бұрып теңестіреді. Таразы жұмысқа даяр болған соң, арретирді солға қарай «жабық» белгісіне жылжытып, таразы иінін (5) бекітеді. Табақшаның салмағы (m) және оның суға батып тұрған (Н) биіктігін өлшеу үшін цилиндрге дистилденген су құйып, оған табақшаны батырады. Онан соң арретирді (3) жылжытып иінді (5) босатады да, иін мен бағдаршаны қозғап, таразы теңдігін көрсететін бағдаршамен тілшемен (6) теңестіреді. Арретирді (3) жабады. Табақшаның массасын бағдаршаға қарсы тұрған шкаладан анықтайды. Таразының өлшеу шегіне және әрбір бөліктің мөлшеріне көңіл бөліңіздер. Сонымен қатар «Н» мәнін анықтайды. Ол судың беткі қабаты мен табақшаның түбіне дейінгі аралыққа дейін болады. Ол шамамен 10-12 см болуы керек. Табақша цилиндр түбінен және бүйірінен 2-3 см алшақ орналасуы керек.
1, 2 - тірек бұрандалары; 3 - арретир; 4 - таразы бағдаршасы; 5 - бағдарша иіні; 6 - тепе-теңдікті көрсеткіш бағдарша; 7 - бұранда; 8 - суспензияға арналған ыдыс; 9 - миллиметрлік шкала (сызғыш) ; 10 - седиментациялық тұнбаға арналған ыдыс.
Сурет - Дисперсті жүйелердің седиментациясын зерттеуге
арналған қондырғы сызбасы
Тәжірибені орындау үшін цилиндрден табақшаны алып, ондағы суға 0, 8 г зерттелетін заттың ұнтағын салып, мұқият араластырып, суспензия дайындайды. Цилиндрге тезірек табақшаны батырып, арретирді ашады да, секундомерді іске қосады. Табақшаға жинала бастаған тұнбаның массасын (m) 15 сек, 30 сек, 1 мин, 1, 5 мин, 2 мин, 5 мин, 10 мин сайын өлшейді. Масса тұрақтанғанда жұмысты тоқтатады. Алынған сандық мәліметтерді пайдаланып есептеулер жүргізеді.
1. Әрбір t уақыттағы тұнбаның массасын анықтайды:
m t = m ж - m т
Мұндағы:
m t - әр уақытта табақшаға жиналған тұнбаның салмағы, мг; саны тәжірибе кезінде өлшеу санына тең болады.
m ж - табақша мен ондағы тұнбаның салмағы, мг.
m т - табақшаның өз салмағы, мг.
2. Тұнбаның жалпы массасын келесі формуламен анықтаймыз:
m max = πR 2 НС/V•(d r d 0 /d 1 )
Мұндағы:
m mах - тұнбаның жалпы массасы;
π - пи мәні, яғни: 3, 14;
R - табақшаның радиусы, см (диаметр арқылы табылады) ;
Н - бөлшектердің шөгу биіктігі, см;
С - суспензия концентрациясы (100 мл судағы 100 мг,
η 0 =1 сП тұтқырлық) ;
V - сұйықтық көлемі, мл;
d r - дисперсті фазаның тығыздығы, г/см 3;
d 0 - дисперсті орта тығыздығы, г/см 3 ;
d 1 - дисперстік жүйе тығыздығы, г/см 3 .
3. Әрбір t уақыттағы бөлінген тұнбаның салыстырмалы массасын анықтайды:
Q τ =m τ /m max •100;
Мұндағы:
Q τ - әр уақыттағы бөлінген тұнбаның салыстырмалы массасы,
Алынған мәліметтерді төмендегі үлгіде жазады:
Уақыты,
t мин
Табақша мен тұнбаның салмағы,
m ж , мг
Тұнбаның салмағы,
m t , мг
Бөлшектердің радиусы,
r, мкм
4. Абцисса өсі бойымен уақыт (мин), ордината өсі бойымен салыстырмалы салмақ (%) алып, седиментация қисығын (Q=f(τ),
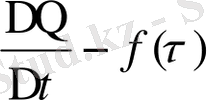 ) сызады.
) сызады.
Бақылау сұрақтары
1. Седиментация дегеніміз не?
2. Седиментациялық талдауды қандай жүйелер үшін қолданады?
3. Седиментациялық талдау қандай заңдылыққа негізделген?
№12 зертханалық жұмыс. Түрлі әдістермен коллоидты ертінділерді алу
Күміс йодиді золін алу (қосарлы алмасу реакциясы)
Қондырғы және реактивтер: 100 мл-лік алты конустық колба; 20 мл-лік екі тамызғыш; бөлініс шекарасы 0, 1 мл-лік екі бюретка; 0, 05 н КІ, 0, 5 н AgNO 3 ертінділері.
Күміс йодидінің түзілу реакциясы:
AgNO 3 + KI = AgI + KNO 3 ↓
AgI - суда аз ериді.
Коллоид заряды ол түзілу басында артықша мөлшерде болған иондармен анықталады. Осы ұғымдарға сүйене отырып, түрлі заряд таңбасы бар AgI золінің бөлшектерін алуға болады. AgNO 3 артықша мөлшерде болғанда, түзілген коллоидты AgI бөлшек оң зарядқа ие болып, бұл жағдайда таңдамалы Ag + ионы адсорбцияланады; осылайша подобным же образом можно получить и отрицательно заряженные частицы при избытке артықша KI мөлшері кезінде оң зарядталған бөлшектерді алуға болады.
Артықша AgNO 3 мөлшері болған кезде AgI молекулаларының үлкен санынан тұратын бөлшектер ядросы Ag + иондары адсорбцияланып, нәтижесінде төмендегі мицелла түзіледі:
{[AgI] m n Ag + ( n - x ) NO 3 - } x+ x NO 3 -
Артықша KI мөлшері болған кезде мицелла формуласы келесі түрге ие болады:
{[AgI] m nI - ( n - x ) K + } x- x K+
1 тәжірибе.
Үш конустық колбаға 20 мл-лік тамызғышпен 0, 05 н. KI ертіндісін тамызып, кейін баяу, қатты шайқай отырып, бюреткадан бірінші колбаға 16 мл, екіншісіне 18 мл және үшіншісіне 20 мл 0, 5 н AgNO 3 ертіндісін қосады.
2 тәжірибе.
Алдыңғы тәжірибені келесі айырмашылықпен қайталайды: алдымен колбаға 20 мл 0, 5 н AgNO 3 ертіндісін өлшеп алып, ал кейін бююреткадан 16, 18 және 20 мл-ден KI ертіндісін қосады.
Электрофорездік зонд көмегімен қандай жағдайда оң зарядталған бөлшектердің, ал қандай жағдайда теріс зарядталған бөлшектердің алынатындығын тексеріп көруге болады.
Күміс гидрозолдерін алу (тотықсыздану реакциясы)
Қондырғы және реактивтер: 250 мл-лік колбалар; 100 мл-лік өлшеуіш цилиндр, ертінділер: 1-пайыздық Na 2 CO 3 ; 1-пайыздық танин ертіндісі; 0, 1 н. AgNO 3 .
Тәжірибе .
100 мл дистелденген суы бар колбаға 1 мл 1-пайыздық Na 2 CO 3 және 2-3 тамшы жаңадан дайындалған танин ертіндісін қосады. Ертінді сары-қоңыр түске ие болып, әлсіз қыздыру кезінде оның түсі барынша қоюлана түседі.
Тотығу әдісімен күкірт гидрозолін алу
Қондырғы және реактивтер: 300 мл-лік үш стақан; тамшылық құйғы; су моншасы; газды жандырғы; термометр; шыны мақта; мұз; концентрленген H 2 SO 4 (тығыздығы 1, 84) ; қаныққан таза NaCl ертіндісі; кристалдық натрий тиосульфаты Na 2 S 2 O 3 ⋅5H 2 O.
Күкіртсутекті ауа оттегісімен немесе күкіртті ангидридпен тотықтыру кезінде күкірт коллоидты күйде шөгеді:
2H 2 S + SO 2 = 3S + 2H 2 O
Күкірт қышқылымен әсер ете отырып, натрий тиосульфаты ертіндісінен күкірт золін алу өте ыңғайлы:
Na 2 S 2 O 3 + H 2 SO 4 = S + SO 2 + Na 2 SO 4 + H 2 O
Тәжірибе .
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz