Химиялық кинетика және катализ: дәрістер жинағы


Ф. 7. 03-03
ТІлеуова С. Т.
«Химиялық кинетика және катализ» пәнінен
ДӘРІСТЕР ЖИНАҒЫ
Шымкент, 2019 ж
ҚАЗАҚСТАН РЕСПУБЛИКАСЫНЫҢ БІЛІМ ЖӘНЕ ҒЫЛЫМ МИНИСТРЛІГІ
М. ӘУЕЗОВ атындағы ОҢТҮСТІК ҚАЗАҚСТАН МЕМЛЕКЕТТІК УНИВЕРСИТЕТІ
Тілеуова С. Т.
«Химиялық кинетика және катализ»
пәнінен
ДӘРІСТЕР ЖИНАҒЫ
5В072000-Бейорганикалық заттардың химиялық технологиясы
Шымкент, 2019ж
Лекция 1. Химиялық кинетиканың негізгі постулаттары
Химиялық реакцияларды уақытқа байланысты зерттейтін физикалық химияның бөлімі (тарауы) химиялық кинетика деп аталады. Ол химиялық процестердің жылдамдықтары (химиялық реакциялардың кинетикасы) мен фазалардың өзгеру жылдамдықтарын (гетерогендік процестердің кинетикасы) қарастырады.
Химиялық кинетика деп химиялық реакциялардың механизмдері жайлы ілім. Бұл салада әрбір реакция жылдамдығы және оған әсер етуші концентрация, қысым, температура, катализатор, реакция жүретін орта (еріткіш) мен реакцияға түсетін заттардың табиғаты қарастырылады.
Реакциялардың жылдамдықтары көптеген факторларға байланысты. Атап айтқанда: реакцияларға түсетін заттардың табиғаты, олардың концентрациясы, температурасы, қысымы, катализатордың қатысуы, ал фазалардың өзгеру жағдайындағы басқа да факторлары (фазалардың бөлу беттерінің шамасы мен масса және жылу алмасу жағдайлары) . Міне, осы факторлардың химиялық жылдамдыққа әсері етуі мен реакция механизімдерін түсіндіру химиялық кинетиканың негізгі мәселесі болып табылады.
Химиялық реакцияларды бір-бірінен ерекше сипатымен ғана өзгешеленетіндей бірнеше топшаларға бөлуге болады. Мысалы, ортаның агрегаттық құрамына орай газды фазадағы реакциялар; ерітінді (сұйық) күйінде жүретін реакциялар; қатты ортада жүретін реакциялар болып топтасады. Ал, реакцияға түсетін, одан алынатын өнім мен реакция жүретін орта күйіне сәйкес: гомогенді (біркелкі, бір күйдегі) химиялық реакциялар; гетерогенді (әр күйдегі) химиялық реакциялар болып бөлінеді. Сол сияқты реакциялар кейбір ерекшеліктері мен жекеленген сипатына, әрекетіне орай келесі топтардың біріне жатуы мүмкін: каталиттік емес реакциялар; каталиттік реакциялар, оның өзі гомогенді каталиттік реакция; гетерогенді каталиттік реакция болып жіктеледі; фото-химиялық (сәуле химиясы) реакциялар; тізбекті реакциялар; электрохимиялық реакциялар. Ал, реакциялар кинетикалық қайтымдылығы бойынша екіге бөлінеді: бір жақты (бір бағытта ғана) жүретін, яғни қайтымсыз реакциялар; екі жақка бірдей немесе тепе-теңдік күйі орнағанша жүретін қайтымды реакциялар.
Химиялық реакциялардың кинетикасы -негізгі екі бөлімнен тұрады: біріншісі формальдық кинетика: ол реакцияның механизмін қарастырмай, реакция жылдамдығын тек формальдық -математикалық түрде сипаттайды, ал екіншісі -химиялық әрекеттесудің механизмі туралы ілім.
Химиялық кинетика реакция компоненттерінің бір және бірнеше фазалардан тұратына байланысты гомогендік реакциялардың кинетикасы және гетерогенді реакциялардың кинетикасы болып екіге бөлінеді.
Гетерогендік жүйелерде процесс тізбектелініп, бірнеше сатыдан тұруы мүмкін. Әдетте ол 4-5 сатыдан немесе кем дегенде мынандай екі сатыдан тұруы керек: фазалардың бөлу бетінде реакцияға түсетін заттардың диффузиясы және беттегі химиялық реакция.
Егер процесс тізбектелген бірнеше сатымен жүретін болса, онда процестің жалпы жылдамдығы ең баяу жүретін сатының жылдамдығымен анықталады, ол баяу саты процестің анықтаушы немесе лимиттеуші сатысы деп аталады. Егер жалпы жылдамдық беттегі жүретін химиялық әрекеттесу жылдамдығымен анықталса, саты реакцияға кинетикалық аймақта, егер анықтаушы саты реакцияға түсетін заттарды диффузия арқылы реакция зонасына жеткізетін болса, онда реакция диффузиялық аймақта жүреді деп қарастырады. Реакция және диффузия жылдамдықтары шамалас болса, онда процесс аралық аймақта жүретін болады.
Химиялық кинетиканың негізгі шамаларының бірі реакция жылдамдығы. Химиялық реакцияның жылдамдығы уақыт бірлігінде реакцияға түсетін заттардың концентрацияларыны өзгеруімен сипатталады. Реакция жылдамдығы уақыттың функциясы болғандықтан, әдетте орташа жылдамдық және шын жылдамдық деген шамалар қолданылады.
Орташа жылдамдық мына теңдеумен анықталады:
V ор =±(С 2 -С 1 ) /(t 2 -t 1 )
мұндағы t -уақыт, С -реагенттің концентрациясы.
Шын жылдамдық, яғни қарастырылып отырған кездегі жылдамдық концентрацияның уақыт бойынша туындысымен анықталады:
V=±dC/dt
Бұдан былай біз көбіне шын жылдамдықты пайдаланамыз.
Химиялық реакциялардың жылдамдықтары әртүрлі болады. Мысалы, қопарылыс реакцияларындағы немесе ерітінділердегі иондар арасындағы реакциялар жылдамдығы өте жоғары болады да, реакциялар әп -сәтте -ақ жүріп бітеді.
Ал баяу тотығу реакцияларындағы немесе радиоактивтік ыдырау реакцияларындағы жылдамдықтардың өте баяу болатыны соншалықты, ондай реакциялардың өнімдерін байқауға бірнеше жылдай уақыт кетеді. .
Химиялық реакциялардың жылдамдықтары туралы ілімдерді дамытуда Я. Вант-Гофф, С. Аррениус, Н. А. Меншуткин, Н. А. Шилов, Н. Н. Семенов т. б. ғалымдардың еңбектері зор болды.
Лекция 2. Химиялық реакциялардың кинетикалық классификация-сы
Кинетикалық классификацияға сәйкес, реакцияларды жай (қарапайым) және күрделі деп бөледі. Жай реакцияларда аралық өнім түзілмейді, реагенттер тікелей реакцияның соңғы өніміне айналады, жүйеде катализаторлар және ингибиторлар болмайды, ал химиялық процес бір типті элементарлы актыден тұрады. Күрделі (көп сатылы) реакциялар реагентер немесе өнім арқылы өзара байланысатын элементарлы сатылардан тұрады. Кинетикалық жай және күрделі реакциялардың жалпы белгілері 2. 1 кестеде келтірілген.
Кесте 2. 1
Күрделі реакциялар
Әрекеттесетін заттар саны үлкен емес, ал реакция өнімдерінің мөлшерлік құрамы салыстырмалы қарапайым.
Өнімдердің мөлшерлік қатынасы реакцияның жүру жағдайына тәуелді болмайды. (уақыт, температура, бастапқы әреттесетін қоспаның құрамы, қысым)
Реакция жылдамдығы температура-ның көтерілуімен монотоды артады;
Белсендіру энергиясы әруақытта оң және кейде тәжірибе температурасына тәуелді болады.
Реакциялардың химиялық әрекеттесудің элементарлық актісіне қатысатын молекулалардың санымен, яғни реакция молекулалығымен жіктеуге болады. Мұндай жіктеу бір сатымен жүретін, механизмі қарапайым реакцияларға қолданылады. Реакция молекулалығы бойынша реакциялар мономолекулалық (бір молекулалық), бимолекулалық (екі молекулалық) және тримолекулалық (үш молекулалық) болып бөлінеді. Мономолекулалық реакциялардың әрекеттесудің элементарлық актісіне тек бір молекула қатысады. Мысалы, кейбір атомдар ядроларының радиоактивтік ыдырауы, газ не ерітінділердегі кейбір күрделі молекулалардың ыдыраулары мен изомерлік түрленулері және т. б. бимолекулярлы реакция -өзгеріске екі бөлшек (молекула, радикал, ион) түсетін; тримолекулярлы реакция -бір мезгілде үш бөлшектің соқтығысуна байланысты жүретін реакциця.
Жай мономолекулярлы және бимолекулалы реакциялардың негізгі типтері 2. 2 кестеден келтірілген.
Таблица 2. 2
Жай мономолекулярлы және бимолекулалы реакциялардың негізгі типтері
Изомеризация р еакциясы -бір реагенттің бір өнімге айналуы:

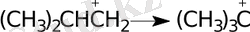
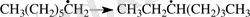
Диссоциация - бір байланыстың үзілуіне байланысты молекулалардың ыдырауы:


Қосылу реакциясы -кем дегенде біреуі молекула болып табылатын екі реагенттің әрекеттесуі:
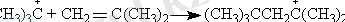
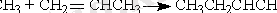
Электрофильді және нуклеофильды алмасу реакциясы - молекуладағы белсенді топтың басқа топқа алмасуы:
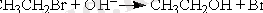
Ыдырау реакциясы -бір молекуланың екі немесе бірнеше бөлшектерге (молекула, радикал, ион) ыдырауы:

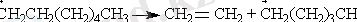
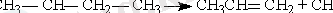
Элиминирлеу реакциясы -көп атомды молекуланың бірнеше молекулаға ыдырауы:
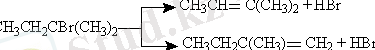
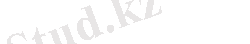
Бөліну реакциясы - жаңа молекулалық өнімнің немесе жаңа белсенді бөлшектің түзілуіне алып келетін молекуланың атоммен, радикалмен немесе ионмен әрекеттесуі :

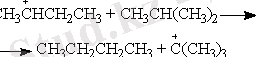
Рекомбинация реакциясы -
Молекулалық өнімнің түзілуіне алып келетін екі атомның, радикалдың, ионның әрекеттесуі:
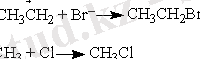
Диспропорция реакциясы - әрекеттесу нәтижесінде атомдардың қайта таралуы немесе екі бірдей молекулалар, радикалдар арасында қайта таралуы:
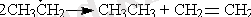
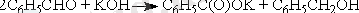
Тримолекулалық реакциялар каталитикалық және ингибирленген процестерге, сонымен қатар, бимолекулалық химиялық реакция кезінде пайда болған молекуланың тұрақтылығына энергияны үшінші бөлшекке беру арқылы қол жеткізілгенде маңызды энергия бөлінуімен жүретін процестерге тән.
Лекция 3. Элементарлы реакциялар
Элементарлы реакциялар бір немесе бірнеше химиялық түрлер реакцияның бір сатысында тікелей және бір аралық кезең арқылы реакция өніміне айналатын химиялық реакциялар болып табылады.
Іс жүзінде, егер реакцияның аралық өнімдері анықталмаса немесе реакцияны молекулалық деңгейде сипаттау үшін постулирование керек болса, қарапайым реакцияға қабылданады. Шамасы-элементарлы реакциялар шын мәнінде сатылы реакция болуы мүмкін, яғни өзгермелі құрамды аралық өнімдердің түзілуімен жүруі мүмкін.
Мономолекулалы элементарлы реакцияда молекула диссоцияланып немесе изомеризациялану нәтижесінде өнім түзіледі:
A → товары. {\ Displaystyle {\ Mbox {A}} \ Rightarrow {\ Mbox {продукты. }}}
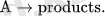
Тұрақты температурада мұндай реакцияның жылдамдығы А концентрация түріне пропорциональды
d [ A ] d T знак равно - К [ A ] , {\ Displaystyle {\ гидроразрыва {d [{\ Mbox {А}}] } {дт}} = -. К [{\ Mbox {А}}] }
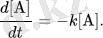
Бимолекулярлық элементар реакция кезінде екі атом, молекулалар, иондар немесе радикалдар, А және В, бір-бірімен әрекеттесіп, өнім түзеді. А + В → товары. {\ Displaystyle {\ Mbox {А + B}} \ Rightarrow {\ {Mbox продукты. }}}
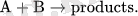
Мұндай реакцияның жылдамдығы тұрақты температурада А және В типтегі концентрациялардың көбейтіндісіне пропорционалd [ A ] d T знак равно d [ В ] d T знак равно - К [ A ] [ В ] , {\ Displaystyle {\ гидроразрыва {d [{\ Mbox {А}}] } {дт}} = {\ гидроразрыва {d [{\ Mbox {В}}] } {дт}} = - к [{\ Mbox { А}}] [{\ Mbox {В}}] . }
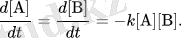
Бастапқы бимолекулалық реакцияның жылдамдығын кейде оны 1864 жылы Гулдберг пен Вааг ұсынғандықтан, массалар әрекеттесу заңы деп те атайды. Реакцияның бұл түріне мысал ретінде реакцияның циклды жүктемесі табылады. Жылдамдықтың бұл өрнегін идеалды газдар үшін соқтығысу теориясын қолдана отырып алғашқы қағидалардан алуға болады. Ерітілген ерітінділер үшін қарапайым ықтималды дәлелдерден балама нәтижелер алынды.
Соқтығысу теориясына сәйкес, үш химиялық қосылыстардың бір-бірімен элементарлық реакцияның молекулааралық реакцияға түсу ықтималдығын елемеуге болады. Сондықтан мұндай молекулааралық реакцияны әдетте элементарлы емес реакциялар деп атайды және бұқаралық әсер ету заңына сәйкес биолекулалық реакциялардың неғұрлым іргелі жиынтығына бөлуге болады. Алайда жалпы реакция схемаларын алу әрдайым мүмкін емес, бірақ жылдамдық теңдеуіне негізделген шешімдер стационарлы немесе Майклис-Ментный жақындау кезінде мүмкін болады.
Лекция 4. Күрделі реакциялар типтері.
Жалпы сипаттама.
Бірнеше кезеңнен тұратын күрделі химиялық реакциялар күрделі деп аталады. Мысал ретінде кинетикасы мен механизмін жақсы түсінетін күрделі реакциялардың бірін қарастырайық:
2НI + Н 2 О 2 --> I 2 + 2Н 2 О
Бұл реакция екінші ретті реакция; оның кинетикалық теңдеуі келесі түрде болады:
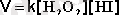 (II. 28)
(II. 28)
Реакция механизмін зерттеу оның екі сатылы екенін көрсетті (екі сатыда жүреді) :
1) НI + Н 2 О 2 --> НIО + Н 2 О
2) НIО + НI --> I 2 + Н 2 О
Бірніші сатының жылдамыдығы V 1 екінші сатының жылдамдығынан V 2 көп артық және реакцияның жалпы жылдамдығы реакцияның лимиттеуші немесе жылдамдық анықтаушы деп аталатын реакция жылдамдығы төмен сатысымен анықталады.
Реакцияны қарапайым немесе күрделі деп тұжырым жасау үшін оның кинетикасын зерттеу нәтижелеріне негізделеді. Егер экспериментпен анықталған нақты реакция реті стехиометриялық реакция теңдеуіндегі бастапқы материалдардың коэффициенттерімен сәйкес келмесе, реакция күрделі болады; Күрделі реакцияның реттілігі бөлшек немесе теріс болуы мүмкін, күрделі реакцияның кинетикалық теңдеуі тек бастапқы материалдардың ғана емес, сонымен қатар реакция өнімдерінің де шоғырлануын қамтуы мүмкін.
2. Күрделі реакция деп жалпы кинетикалық теңдеулерінің құрамында жай реакциялармен салыстырғанда бірнеше жылдамдық константасы бар реакцияларды айтады. Күрделі реакциялар қатарына қайтымды, параллельді (қосарлы), тізбекті және басқа реакциялар енеді. Бұл реакциялардың теориялық негізі системада бір мезгілде бірімен-бірі қатарынан әркайсысына жай реакциялардың кинетикалық теңдеуін қолдануға болатын құбылыстардың жүруі деп есептелетіндігі.
Параллельді немесе қосарлы реакция деп берілген бір қосылыстан не заттан бір сәтте қатарынан екі не одан да көп өнім алынатын күрделі реакцияларды айтады. Оны жалпы мына төмендегідей етіп жазады:
Бір бастапқы заттан бір мезгілде әртүрлі реакция өнімдері түзілетін, реакцияны параллельді реакция дейміз, мысалы екі немесе бірнеше изомерлері түзілуі мүмкін:
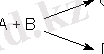
ABC немесе берілген А реагентінен реакция нәтижесінде В және С одан да көп өнімдері бірімен-бірі қатарынан қосарласа шығады. Бұған екі бағытта жүретін бертолле тұзының ыдырауы жақсы мысал болады:
2КCl +3O 2
3КClO 4 +KCl
Сатылы реакциялар
Бір сатыда түзілген реакция нәтижесі (яғни осы сатының өнімдері), басқа саты үшін бастапқы өнім болатын реакциялар тізбекті реакциялар де аталады. Сатылы реакцияларды сызба түрінде былай көрсетуге болады:
А --> В --> С --> . . .
Саты саны және әр сатыда әрекеттесетін заттар саны әртүрлі болуы мүмкін.
Жалғасымды немесе сатылы реакция деп бірінен кейін бірі жалғасып жүретін күрделі химиялық реакциялар түрін айтады. Оған мысал ретінде берілген А затынан В қосылысы түзіліп, реакция онан әрі жалғасып, сатылай жүріп С өнімі шығатын реакцияны келтіруге болады. Бұл реакциялар табиғатта кең таралған. Олар екі, үш не одан да артық жекеленген сатылы реакциялардан тұрады және олардың әрқайсысы әр түрлі молекулалық та, күрделі де болуы мүмкін. Дикарбон қышқылдары күрделі эфирлерінің немесе гликольдердің күрделі эфирлерінің, дигалоген туындыларының, майлардың және т. б. гидролиздеу реакциялары, яғни суда ыдырауы осы жалғасымды реакцияға жа-тады. Сол секілді үш сахаридті гидролиздегенде, әуелі дисахаридке ыдырап, онан әрі бұл дисахарид моносахаридке жіктеледі. Оны үш сахаридті рафиноза дейді, оның гидролиздену реакциясы екі сатыдан тұрады:
1. C 18 H 32 O 16 +H 2 O→C 6 H 12 O 6 +C 12 H 22 O 11 дисахарид,
2. C 12 H 22 O 11 +Н 2 О→С 6 Н 12 О 6 + С 6 Н 12 O 6 моносахарид.
Жалғасымды реакциялардың жалпы немесе берілген жағдайдағы кинетикалық теңдеуін тауып, оны есептеу өте күрделі. Сондықтан оларды құрамына енетін жай реакцияларға жіктеп, олардың әрбір сатылы реакцияларын ескереді. Егер берілген реакция бірнеше сатылы реакциялардан тұрса және олардың реакция жылдамдығы біріне-бірі тең болмаса, онда жылдамдығы төмен болатын реакция берілген реакцияның жылдамдығын анықтайды.
Кейде бір реакция өздігінен жүрмейді. Ал егер онда басқа бір реакция жүрсе, соған ілесіп, яғни соның жүруіне үйлесімді жүретін күрделі реакциялар түрі кездеседі. Мұндайларды ілесімді не орайластық реакциялар дейді. Мұндай реакцияларды жалпы түрде былай көрсетуге болады:
1. А + В→М, 2. A+C → N
Демек, ілесімді реакциялар екі сатыдан тұрады. Оның бірінші сатысындағы реакция ешнәрсеге тәуелсіз, өздігінен жүре береді, яғни А және В реагенттері М өнімін түзеді. Ал екінші реакциядағы А мен С реагенттері өздігінен реакцияға түспейді және N өнімі шықпайды. Ал, егер А, В және С реагенттерін бір реакторға салса, онда әуелі М түзіледі де оған ілесе екінші реакция жүріп, оған орай N өнімі пайда болады. Оған екі мысал келтірейік:
1. H 2 O 2 (A) + Fе 2+ → Fe 3+ (M) + 2H 2 O
2. Н 2 О 2 (A) + 2НІ(С) → І 2 (N) + 2Н 2 О
Мұндағы бірінші реакция бойынша екі валентті темір тұздары, айталық FеSО 4 , сутектің пероксидінде ешнәрсеге тәуелсіз өздігінен жүреді, яғни темір (II) сульфаты тотығып, үш валентті темір сульфатына айналады. Ал екінші реакцияны жеке бөліп алса, ол өздігінен жүрмейді. Ол тек бірінші реакция жүріп, темір (III) сульфаты пайда болғанда ғана сол реакцияға ілесе жүреді де, иодты сутек қышқылындағы иодтың тотықсыздануы темір (III) сульфатына орайлы келеді. Мұндай реакциялар органикалық химияда, әсіресе, биохимияда жиі кездеседі. Мысалы, индиго деп аталатын қара көк бояудың судағы ерітіндісі ауадағы не ерітіндідегі оттекпен тотықпайды, ерітінді реңі оңалмайды, Ал, егер осы ерітіндіге бензальдегидті қосса, ерітінді бояуы оңалады. Сөйтсе, бояу ерітіндісіне қосылған бензальдегид ондағы оттекпен әрекеттесіп, тотыққанда бензой қышқылы түзіледі де, оған ілесе индиго тотығып, бояу оңалады да, изатин дейтін әлсіз органикалық қышқыл түзіледі:
1. O 2 (А) +С 16 Н 10 О 2 N 2 (В) →2С 8 Н 5 О 2 N 2 (M) -изатин индиго
2. О 2 (А) +С 7 Н 6 О(С) → С 7 Н 7 О 2 (N) -бензои қышқылы. бензальдегид
Бұл құбылысты 1905 жылы Н. А. Шилов жан-жақты зерттеген және оны химиялық ивдукция (ыкпал) депатады. Осы реакциялардағы ортақ А реагент-терін (сутек пероксиді және оттек) актор, В қосылыстарын -акцептор, ал С - индуктор дейді.
Қайтымды реакция деп жылдамдығы тура және кері жүретін реакциялардың жылдамдық айырымына теңелетін реакцияларды айтады. Қайтымды реакцияға мысал ретінде сірке қышқылы мен этил спиртінің арасында жүріп, күрделі эфир мен судың түзілетін реакциясын алуға болады:
Н 3 ССООН + С 2 Н 5 ОН ↔︎Н 3 ССООС 2 Н 5 + Н 2 О.
Мұнда тура реакцияның жылдамдығы уакыт өткен сайын төмендеп, кері реакцияныкі артады және бұл құбылыс осы екі реакцияның жылдамдықтары өзара теңелгенше, динамикалық тепе-теңдік орнағанша жүреді. Мұндай реакцияның константасы тура және кері реакциялардың жылдамдық константаларының қатынасына тең:
A және В азаяды (141 а)
v 2 =-dC/dt = k 2 C A1 ∙ C B1
A1 және В 2 көбейеді (141)
v = v 1 -v 2 = K 1 ∙C A ∙C B - K 2 C A1 ∙C B1 (141) болса
K 1 ∙ C A ∙ C B = K 2 C A1 ∙ C B1 (142)
K 1 /K 2 = C A1 ∙ C B1 / C A ∙ C B (143)
Тізбекті реакциялардың жылдамдығы.
Оған сутек пен оттек арасындағы реакцияны мысал ретінде көрсетуге болады: 2Н 2 + О 2 =2Н 2 О. Осы келтірілген теңдеу бұл реакцияның жалпы түрдегі, бірден-бір қарапайым және оның бастапқы мен соңғы сатысын ғана көрсетеді де ондағы реакция механизмі жайлы ешбір дерек бермейді. Қаныкқан молекулалар -оттек пен сутек арасындағы реакцияның басталуы, не осы екі газ қоспасын қыздырғанда, не электр разрядымен (ұшқынымен) әсер еткенде, не қысқа толқынды сәуле таратқанда пайда болатын бос радикалмен байланысты:
Н 2 + О 2 + Ь =-ОН+-ОН
мұндағы бос радикалдар -ОН сутек молекуласымен ешбір кедергісіз және өте оқай әрекеттеседі:
-НО+Н 2 = Н 2 О+Н
Реакцияның осы сатысындағы пайда болған сутектің активті атомы оттек молекуласына ықпал етіп, әуелі оны қоздырып, сосын олардың арасында реакция нәтижесінде бос валенттілігі бар бірден екі бөлшек пайда болады: олардың біреуі гидроксил тобы (•ОН) да, екіншісі оттек атомындағы бірден екі бос валенттілік (О) :
Осылайша активті бөлшектер мен бос радикалдар әп-сәтте еселей артады да, реакция жүретің активті орталықтар көбейеді.
Тізбекті реакциалардың механизмін активті орталықтардың пайда болуымен байланыстыра келіп, 1904 жылы А. Н. Шилов бірінші болып түсіңдірді. Бұл реакциалардың механизмін зерттеу ісіне Н. Н. Семенов үлкен үлес қосты. Оған осы саладағы жемісті еңбегі үшін Нобель атындағы сыйлық берілді.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz