Химиялық байланыстар мен комплексті қосылыстар: түрлері, қалыптасу механизмдері және қасиеттері


Химиялық байланыс
деген менің ойымша электртерістілігі бірдей немесе әртүрлі атомдар. Оның атомдық күйіне қарағанда молекулалық күй едәуір тұрақты болады.
Химиялық байланыстардың өзі екіге бөлінеді.
Олар:
1. Молекула ішіндегі химиялық байланыстар:коваленттік, иондық, донорлы-акцепторлы!
2. Молекулалар арасында химиялық байланыс:сутектік, металдық
Коваленттік байланыс
дегеніміз ол менің ойымша
ортақ электронды жұбын түзіп химиялық байланыс пайда болады. Менің түсінгенімше коваленттік байланыс ол түзілуінің үрдісін жоба түрінде береді ондағы электрондар нүктемен белгіленеді және атомдары арасында бір коваленттік байланыс пайда болса, онда ол дара, егер екеу болса, қос, үштік болса үштік ортақ болып қала береді.
Коваленттік байланыстың өзі
2 түрі бар.
1. Ковалентті полюссіз!
2. Ковалентті полюсті!
1. Ковалентті полюссіз
дегенім ол электртерістігі бірдей элемент атомдарының арасында бірдей ортақ жұп электрондарымен химиялық байланыс түзіледі, яғни бір элемент атомдарынан тұратын молекула түзіледі.
Мысалы:H2, F2, Cl2, O2, N2.
2. Ковалентті полюсті
ол электртерістігі әр түрлі бейметалдардың арасында ортақ болад және бұл да жұп электрондарымен химиялық байланыс түзеді. Ковалентті полюсті байланысында электрондар бүркесу аймағы нәтижесінде үлкен электртерістігі атомға қарай ығысады.
Мысал ретінде бромсутектің түзілуін қарастырдым!
Электрон жұбы бромның атомына қарай ығысады, себебі бром атомы салыстырмалы түрде көп сутек атомына қарағанда!
Ковалентті байланыстың өзі екі сипаттамасы бар!
Олар:
1. Байланыс ұзындығы
2. Байланыс энергиясы
1. Байланыс ұзындығы:
бұны айта кетсек бұда ядроаарлық қашықтыққа тең болады. Байланысы неғұрлым аз болса химиялық байланыс соғырлұм берік болу керек. Өлшем бірлігі нм!
2. Байланыс энергиясы:
бұл жерде молекуладағы бір байланысты үзуге қажет энергияға тең болады.
Өлшем бірлігі кДж/моль.
Ковалентті байланыс түзілуінің механизмдері
1. Екі электрон бұлтының ортақтасуы есебінен:
Менің түсінгенімше екі электрон бұлтының ортақтасуы есебінен ковалентті полюсті және полюссіз байланыс ортақ электрон бұлтының есебінен жүзеге асады.
2. Донорлы-акцепторлы механизм:
Донор жұп электроны бар атом болып табылады ал акцептор деген электрон жұбын қабылдауға қабілетті бос орбитальі бар бөлшек. Ковалентті байланыс ол донордың қос электрондық бұлты мен акцептордың бос орбиталінің есебінен пайда болады.
Мысалы:
оксоний ионының түзілу механизмі. Бұл жерде айта кетсем су молекуласы донор ал сутек ионы акцептор болып тұр.
Ковалентті байланыстың қасиеттері. Атомдық орбитальдардың
гибридтенуі.
Ковалентті байланыстың мынадай қасиеттері бар:
қаныққандағы, полярлығы, бағытталуы.
Байланыстың қаныққандығы -
атомның қанша ковалентті байланыс түзе алатынын көрсетеді.
Байланыстың полярлығы
-
байланысушы атомдардың электртерістілігінің айырмасымен анықталатын, яғни байланыстырушысы электрон жұбы бұлтының қалай ығысқанын осы бағытта галогендердің электерістіліктері кемиді.
Байланыстың бағытталуы
-
түсінгенім бойынша олар түзетін электрон бұлттарының кеңістіктегі құрылысын, оның пішінін анықтайды. Ол әрекеттесуші атомдардың өзі электрон бұлттарының мейлінше толық қабысуы бағытында түзіледі.
Гибридті орбитальддар түзілу үшін орындалуы қажет жағдайлар:
1.
Гибридтелетін электрондардың энергиялары шамалас болуы, яғни олар бір деңгейдің әр деңгейшелеріне орналасуы керек!
2.
Гибридті орбитальдар басқа элементтің электрон бұлттарымен мүмкіндігінше толық қабыса алуы тиіс!
3.
Гибридтелуге қанша орбиталь түссе пайда болатын гибридті орбитальдар саны сонша болады.
Мысалы:
BeCl2 молекуласын зерттесек молекулада химиялық байланыс түзу үшін бериллий атомының бір s пен бір p электрондары болады. Бұл кезде sp- гибридтену процесі пайда болады.
Иондық байланыс
Менің түсінігім бойынша бұл қарама қарсы зарядталған иондар арасындағы электростатикалық тартылыс күші әсерімен жүзеге асатын байланыс.
Иондық байланыс
металдық және бейметалдық
қасиеттері бар. Олардың электртерістік мәндері бойынша күшті ерекшеленетін элементтердің атомдары әрекеттескен жағдай да түзіледі.
Мысалы:
NaCl, CaBr2, K2O, All3, MgH2
Белсенді бейметалдар -
сілтілік және сілтілік жер элементтері белсенді бейметалдар галоген иондық байланыспен қосылады.
Мысалы:натрий атомы мен хлоар атомы әрекеттескенде натрий атомы хлор атомына бір электронды беріп, есебінен натрийх хлориді түзіледі.
Металдық байланыс
Менің ойымша металл иондары мен бос электрондар арасында түзілетін байланысты.
Металл атомдарының сыртқы қабатында бір, екі немесе үш электроннан болады. Металда иондар өзара байланыстарды бұзбай ығыстыры алады.
Металдық байланыс ойымша ол коваленттік байланыспен ұқсас өйткені
олардың екеуі де валенттілік электрондардың ортақтасуы арқылы түзіледі.
Бірақ ол коваленттік байланыс екі атомның арасында түзілсе, металдық
байланыста ортақ электрондар тұтас кристалға тиесілі болады.
Сутектік байланыс
Сутектік байланыс өзі 2 бөлінеді!
1. Молекулаішілік:
ақуыз құрамында.
2. Молекулааралық:
HF, H2O, NH3, HCl, H2S және спирттерде, карбон қышқылдарында.
Сутектік байланыс ол өзі бір молекуладағы оң полюстенген сутек атомы мен екінші бір молекуладағы теріс полюстенген фтор, оттек және азот атомы арасында түзілетін ерекше байланыс.
Мысалы:
HF, H2O, NH3
Жоғарыда тек екі элементтен тұратын қосылыстарды қарастырдым ал егер қосылыстар бірнеше болса құралып, арасында химиялық байланыс түрлері бір бірімен тікелей байланысқан атомдардың табиғатына байланысты!
Мысалы:
Na2SO4 қосылысының құрылымдық формуласын алсақ болады. Натрий мен оттек атомдарының арасындағы байланыс иондық, ал оттекпен пен күкірт атомдарының арасындағы байланыс ол ковалентті полюсті болып келеді.
Кристалдық торлар
Кристалдық торлар түсінігім бойынша ол кеңістіктің белгілі нүктелерінде зат бөлшектерінің белгілі бір заңдылықпен орналасады.
Атомдар, молекулалар, иондар бөлшектерінің орналасуын кристалдық тор түйіндері деп аталады.
Байланысы олардың типтердің және бөлшек түрлеріне қарай кристалдық торлар
металдық, иондық, атомдық
және
молекулалық
деп бөлінеді.
Құрылымдық формулалар
Қосылыстың құрамы химиялық формулалар түрінде бейнеленген:
эмпирикалық, электрондық
және
құрылымдық
.
Мысал ретінде
: сутек, су, амин және метан молекулаларына сәйкес формулаларды жаздым!
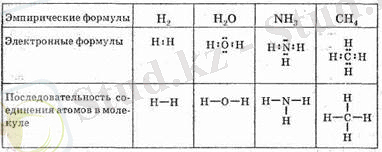
Эмпирикалық немесе молекулалық формулалар
: молекулалардың тек сапалық және сандық құрамын, қосылыстағы атомдардың түрі мен санын ғана көрсетеді.
Электрондық формулалар
:ол элементтердің шартты белгілерінен тұрады, олардың айналасында нүктелер сыртқы деңгейдегі электрондарды, ал атомдар арасында байланыстырушы электрон жұптарын көрсетеді. Менің түсінігім бойынша олар молекуладағы атомдардың қосылу ретін көрсетеді. Сонымен қатар химиялық байланыстың табиғаты және атомдардан молекула түзілу механизмі, сондықтанда қосылыстардың әр түрлі реакциялардағы әрекетін түсіндіру үшін жиі қолданылады.
Менің ойымша электрондық формулалардағы атомдар арасындағы екі нүкте электронды бұлттардың қабаттасу орындары болып табылады, демек, қосылатын екі электронды бұлттың ең жоғары тығыздығын білдіреді.
Құрылымдық электронды формулалар:
бұл әр байланыстырушы электрон жұбы сызықшамен көрсетілген формулалар болып табылады, олар электронды формулалар сияқты болып келеді, атомдардың молекулада қосылу ретін көрсетеді. Бір бірімен байланысынан қарапайымдылығы үшін құрылымдық формулалар әдетте
қысқартылған түрде көрсетеді, тек тізбекті құрайтын атомдар арасындағы байланыстарды ғана атап өтеді.
Мысалы:
этан, этилен, ацетилен, бутан.
Тотығу дәрежесі
Атомның тотығу дәрежесі химияның негізгі тұжырымдамасы болып саналады, ол атомның қосылыс күйін сипаттау үшін негізделген болатын.
Бұл ұғымға анықтама берген кезімде түсінгенім, шартты түрде қосылыста байланыстырушы электрондар көп электронды атомдарға өтеді, демек қосылыстар оң және теріс зарядталған иондардан тұрады.
Тотығу дәрежесі дегеніміз менің түсінігім бойынша бұл иондардан тұрады, негізінде есептелген қосылыстағы атомдардың шартты зарядтар болып табылады.
Комплексті қосылыстар.
Комплексті қосылыстар дегеніміз құрамында комплексті иондары бар, тотығу дәрежесі белглі орталық атомы иондарымен және молекулалармен байланысқан күрделі заттар болып табылады.
Олар суда ерітінділері иондаға диссоциацияланады.
Осы өмірде тіршілік үшін керек биокомплекстер олар:Fe, Co, Mn, CuMo, Zn бұлар организмде де кездеседі.
Химиялық қосылыстар барлығы
қарапайым
немесе
атомдық
қосылыстар және
комплексті
немесе
молекулалық
қосылыстар деп екіге бөлінеді.
Бұларды 1-реттік қоспалар деп атайды.
2
-реттік қоспаларға жататын күрделі коспалар олар молекулалардан немесе иондардан құралады.
Комплексті қосылыстардың химиялық байланыстың табиғаты.
Қазіргі кезде комплексті қосылыстарда байланыстың табиғатын қарастыратын үш теориялық әдіс бар.
Олар:
1. Валенттік байланыс әдісі.
2. Кристалдық өріс теория.
3. Молекулалық орбитальдар әдісі.
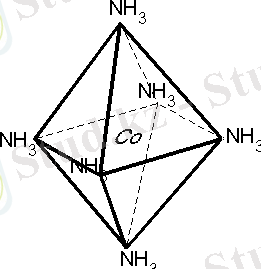
Валенттік байланыс әдісі:
менің түсінігім бойынша орталық атом мен лиганд донорлы-акцепторлы жол мен байланысады. Орталық атом байланыс түзуге бос орбитальдарын, ал лиганд пайдаланылмаған электрон жұбын жұмсайды.
Мысалы
:[ Co(NH
3
)
6
]
3+
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz