Химиялық тепе-теңдік: тепе-теңдік константалары, термодинамикалық потенциалдар және температураға тәуелділік


Химиялық тепе - теңдік туралы түсінік
Химиялық тепе-теңдік сандық жағынан берілген температура үшін тұрақты шама тепе-теңдік константасымен сипатталады. Тепе-теңдік константасы реакция өнімдерінің стехиометриялық коэффициентеріне дәрежеленген тепе - теңдік концентрация көбейтіндісінің бастапқы заттардың сондай концентрация көбейтіндісінің қатынасымен анықталады. Келесі реакция үшін:

 (6. 1)
(6. 1)
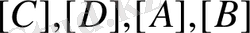 - реакция реагенттерінің тепе - теңдік концентрациялары,
a, b, c, d-
стехиометриялық коэффициенттер,
K
c
-химиялық тепе-теңдік константасы.
- реакция реагенттерінің тепе - теңдік концентрациялары,
a, b, c, d-
стехиометриялық коэффициенттер,
K
c
-химиялық тепе-теңдік константасы.
Тепе - теңдік реагенттердің парциаль қысымдары арқылы өрнектелсе, химиялық тепе - теңдік константасы келесідей тәуелділікті көрсетеді:
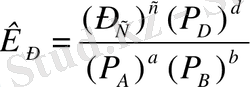 (6. 2)
(6. 2)
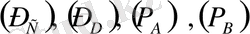 - реакция реагенттерінің парциальды қысымдары,
a, b, c, d-
стехиометриялық коэффициенттер,
K
р
-химиялық тепе-теңдік константасы.
- реакция реагенттерінің парциальды қысымдары,
a, b, c, d-
стехиометриялық коэффициенттер,
K
р
-химиялық тепе-теңдік константасы.
Тепе-теңдік константасы әрекеттесуші заттар табиғатынан, температурадан тәуелді, концентрациядан, активтіліктен, қысымнан тәуелсіз. K c , K р - газтәріздес реагентердің моль сандары өзгере жүретін реакциялар үшін өлшемсіз шамалар. Басқа жағдайларда:
K р - қысым өлшемімен,
K c - ∆ n дәрежедегі концентрация өлшемімен өрнектеледі. ∆ n - стехиометриялық коэффициенттердің алгебралық қосындыларының айырымы:
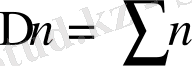 ( өнім)
-
( өнім)
-
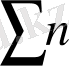 (баст. зат)
=
(баст. зат)
=
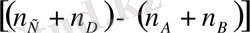 (6. 3)
(6. 3)
K c және K р келесідей байланыста:
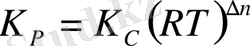 (6. 4)
(6. 4)
Химиялық реакцияның изотерма теңдеуі
Химиялық тепе-теңдік константасы стандартты жағдайда химиялық реакцияның ∆ G және ∆ F шамаларымен байланысты:
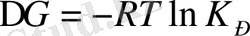 (6. 5)
(6. 5)
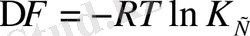 (6. 6)
(6. 6)
Әрекеттесуші заттардың берілген концентрациялары немесе парциал қысымдарындағы химиялық реакцияларда ∆ G және ∆ F өзгерістерін химиялық реакцияның изотерма теңдеуі арқылы есептеуге болады.
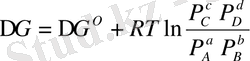 (6. 7)
(6. 7)
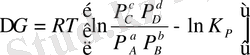 (6. 8)
(6. 8)
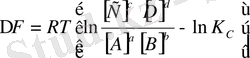 (6. 9)
(6. 9)
Бұл теңдеулер (6. 8), (6. 9) химиялық реакцияның изотерма теңдеулері. (6. 8) - теңдеуі изобаралы - изотермиялық процесс үшін, (6. 9) - изохоралы - изотермиялық үшін. Көрсетілген теңдеулер термодинамикалық потенциалдар ∆ G , ∆ F өзгеруі мен химиялық тепе - теңдік константалар K р , K c арасындағы тәуелділікті көрсетеді. Химиялық реакция изотерма теңдеулері бойынша берілген жағдайда Гиббс және Гельмгольц энергиялар өзгерісін есептеуге, процестің өздігінен өту бағытын анықтауға болады.
Егер
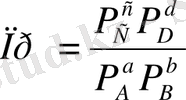
Химиялық реакция изотерма теңдеуінен Гиббс энергиясының мәні және таңбасы
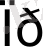 және
және
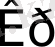 салыстырмалы мәндерінен тәуелді екенін көруге болады. (
салыстырмалы мәндерінен тәуелді екенін көруге болады. (

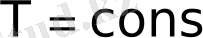 ) Егер
) Егер
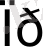 <
<
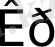 болса,
болса,
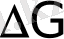 < 0
< 0
(6. 8) теңдеуге сәйкес реакция өздігінен солдан оңға қарай өтеді.
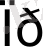 >
>
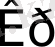
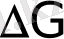 > 0
> 0
(6. 8) теңдеуге сәйкес реакция өздігінен кері бағытта (оңнан солға) өтеді.
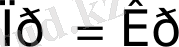
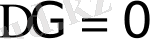
реакция тепе - теңдік күйде.
Тепе - теңдік константасының температурадан тәуелділігі. Изобара және изохора теңдеулері
Температураны жоғарлату тепе-теңдікті эндотермиялық реакция(жылу сіңіру) өту бағытына қарай ығыстырады.
Температураны төмендету тепе - теңдікті экзотермиялық реакция (жылу бөлу) бағытына қарай ығыстырады. Мысалы аммиактың синтезделу реакциясы үшін:
N 2 + 3H 2 ⇔2NH 3 + 92, 3 кДж
Температураны арттыру тепе - теңдікті солға (себебі ∆Н > 0 ), ал төмендету - оңға (себебі ∆Н < 0) ығыстырады.
Температура өзгерісінің тепе- теңдік константасына әсерін сандық жағынан изобара және изохора теңдеулері көрсетеді.
Химиялық реакцияның изобара теңдеуі р = соnst.
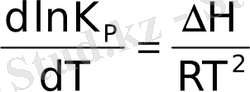 (6. 10)
(6. 10)
Химиялық реакцияның изохора теңдеуі V =const.
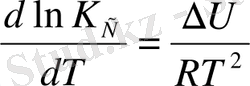 (6. 11)
(6. 11)
Изобара және изохора теңдеулері реакция бағытын анықтауға, тепе - теңдік константасының температурадан тәуелділігін бағалауға мүмкіндік береді.
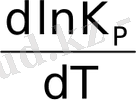 және
және
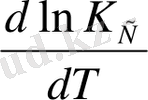 шамаларын химиялық тепе - теңдік константасы логарифмінің температуралық коэффициенті дейді. Тепе-теңдік константасының температурадан тәуелділігі химиялық реакцияның жылу эффектісі таңбасы мен мәнімен анықталады.
шамаларын химиялық тепе - теңдік константасы логарифмінің температуралық коэффициенті дейді. Тепе-теңдік константасының температурадан тәуелділігі химиялық реакцияның жылу эффектісі таңбасы мен мәнімен анықталады.
Егер ∆Н < 0, Т - ның өсуімен K р кемиді;
∆Н > 0, Т - ның өсуімен
K
р
 артады;
артады;
∆Н = 0, K р температурадан тәуелсіз
Теңдеуді Т
1
- ден Т
2
аралығында интегралдасақ:
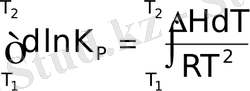
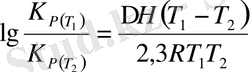 (6. 12)
(6. 12)
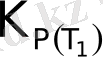 ,
,
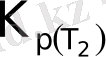 - Т
1
және Т
2
температурадағы тепе - теңдік константалары.
- Т
1
және Т
2
температурадағы тепе - теңдік константалары.
Егер химиялық реакцияның жылу эффектісі және қандай да бір температурадағы тепе - теңдік константасы белгілі болса, соңғы теңдеу арқылы басқа температурадағы тепе - теңдік константасын есептеуге болады.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz