Электрохимиялық процестер және металдардың коррозиясы


ҚАЗАҚСТАН РЕСПУБЛИКАСЫНЫҢ ҒЫЛЫМ ЖӘНЕ БІЛІМ МИНИСТРЛІГІ
ҚАЗАҚ ҰЛТТЫҚ ҚЫЗДАР ПЕДАГОГИКАЛЫҚ УНИВЕРСИТЕТІ
ЖАРАТЫЛЫСТАНУ ИНСТИТУТЫ ХИМИЯ КАФЕДРАСЫ

Студенттің өзіндік жұмысы №5
Пән атауы: Бейорганикалық химия
Тақырыбы: Электрохимиялық процестер. Металдардың коррозиясы
Орындаған : Темірбекқызы Назерке
Мамандық : 6В01507-Химия
Топ:101
Тексерген :Азимбаева Гулбайра Ералиевна
Алматы, 2021 жыл
Электрохимиялық процестер. Металдардың коррозиясы
ЖОСПАР
Кіріспе
Негізгі бөлім
- Электрохимия негіздері
- Электродық потенциалдың түзілу принципі
- Гальваникалық элементтер
- Электролиз және оның заңдары
- Металдардың коррозиясы және түрлері
- Электрохимиялық қорғау жолдары
Қорытынды
Пайдаланылған әдебиеттер тізімі
Электрохимия - тотығу-тотықсыздану реакцияларының нәтижесінде электр тогы пайда болуын және электр тогының әсерінен тотығу-тотықсыздану реакцияларының жүру заңдылықтарын зерттейтін химияның бір бөлімі.
Химиялық реакциялардың энергиясын электр энергиясына айналдыру гальваникалық элементтерде жүреді, ал электр тогының жәрдемімен химиялық реакциялар жүргізу электролиттік ванналарда іске асырылады.
Электрохимияның пайда болуы Л. Гальвани және А. Вольта сияқты ғалымдардың есімдерімен тығыз байланысты. Бақа бұлшық етінің қозғалысын зерттеу кезінде, Гальвани күтпеген жерден металл пластинкасы мен бақаның табанынан тұратын электр тізбегін алады. Ол өз тәжірибесіне сүйеніп, электр тоғының пайда болуын тек тірі организммен байланыстырады. Ал, 1799 жылы ғылым тарихында бірінші болып Вольт гальваникалық злементтердің батареясын жасайды. Мұны сол кезде вольттық электрлік бағана дейтін. Әрине, бұл құбылыс Гальванидің “жаны бар электр ток” атты болжамын жоққа шығарып, бұл салада жаңа ұғым, тың бағыт тудырды. Ол кездегі бірінші гальваникалық элементтер аралары электролит ерітінділеріне малынған матамен бөлінген мыс және мырыш пластинкаларынан тұратын. 1834 жылы М. Фарадей электролиздің негізгі екі заңын ашып, тұжырымдады. Бұл электрохимия саласындағы аса үлкен заңдылык болды. Фарадейдің электролиз заңына сүйеніп, элбктрлік құбылыс пен материя арасындағы тығыз байланысты тура көрсетті және Стоней ең кішкене элементар электрлік зарядтың өлшемі ретінде 1891 жылы “электрон” деген терминді енгізді.
Электрохимия С. Аррениус, Ф. Кольрауш, В. Оствальд және басқа да көптеген ғалымдардың түбегейлі еңбектерінің негізінде, тек XIX ғасырдың соңында ғана физикалық химияның бір саласына айналды.
Қазіргі көзқарас тұрғысынан металдардың электродтық потенциалдарының түзілуін былай түсіндіруге болады. Металды суға батырғанда полюсті су молекулаларының әсерінен металдың бет жағы ептеп ериді. Осының нәтижесінде электрондар металл пластинкасының бетінде қалып, ал катиондар ерітіндіге көшеді. Бірақ металдардың еру процесі көпке бармайды, аздан кейін тепе-теңдік күйге көшеді, яғни белгілі бір уақыт ішінде қанша катион ерітіндіге көшсе, сонша катион қайтадан металл пластинкасына ауысады. Бұл процесті мынадай жалпы теңдеумен көрсетуге болады:
Me°+ m H 2 O=Me n + m H2O+ ne
Металдың бетінде қалған электрондардың есебінен металл пластинкасы теріс зарядталады, ал ерітіндіге көшкен металл катиондары оны оң зарядтайды. Сөйтіп металл пластинкасы теріс зарядталып, ал ерітіндінің оған таяу жатқан беті оң зарядталып қос электрлі қабат түзіледі.
Металдардың активтігіне байланысты суда немесе өз тұздарының ерітінділерінде олардың ерігіштік қабілеттері де әр түрлі болады.
Іс жүзінде актив металдар тұздарының ерітінділеріне батырғанда еріп теріс зарядталады. Активтігі кем металдарды тұздарынын ерітінділеріне батырғанда, металл ерімейді, керісінше, ерітіндідегі катиондар металдың бетіне көшеді де оны оң зарядтайды, ол қалған аниондар оң пластинкаға тартылып ерітіндіні теріс зарядтайды. Бұл жағдайда да қос электрлі қабат түзіледі.
Төменде актив (а) және пассив (б) металдар мен олардың тұздары ерітінділерінің арасында қос электрлі қабат түзілу схемасы көрсетілген:

Сонымен металл мен ерітіндінің (немесе сұйықтың) жанаскан бетінде потенциалдар айырмасы пайда болады. Қос электрлі қабат белгілі бір потенциалдар айырмасы бар конденсатор сияқты болады.
Металл мен ерітіндінің (судың) арасында пайда болған потенциалдар айырмасын металдыц электродтық потенциалы деп атайды.
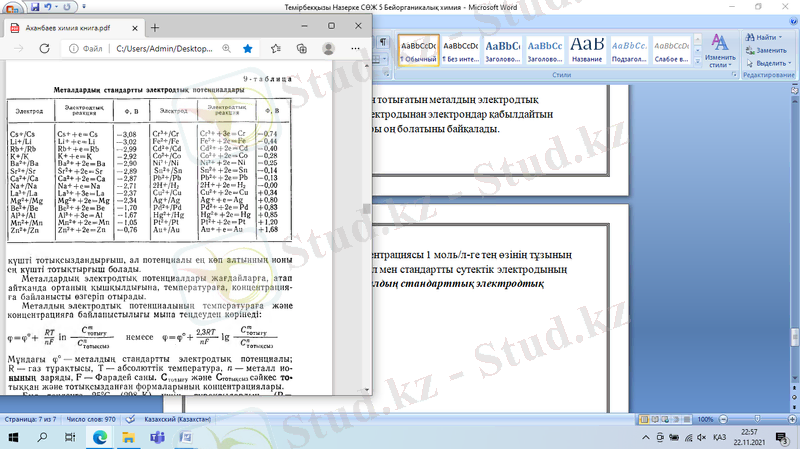
Металдардың электродтық потенциалдарының сандық мәні металдардың табиғатына (активтігіне), ерітіндідегі иондардың концентрациясына, температураға байланысты.
Металл активтірек, ал ерітіндідегі иондардың концентрациясы неғұрлым азырақ болса, металдардың электродтық потенциалдарының мәндері солғұрлым азырақ болады, ал металдың активтілігі кемірек, оның ерітінділеріндегі нондарының концентрациясы көбірек болса электродтық потенциалдарының мәндері де көбірек болады.
Металдардың электродтық потенциалдарының абсолюттік мәндерін тікелей өлшеу осы уақытқа дейін мүмкін болмай отыр. Сондықтан металдардың электродтық потенциалдарын басқа бір электродпен салыстырып олардың салыстырмалы потенциалдарын өлшейді. Бұл мақсат үшін салыстырмалы электрод ретінде стандартты сутектік электрод қолданылады да оның потенциалы нөлге тең деп алынады.
Стандартты сутектік электрод дегеніміз сутегі иондарының (H+) активтік концентрациясы 1 моль/л-ге тең күкірт қышқылына батырылған беті электролиттік жолмен кеуек платинамен қапталған платина электроды. Платина пластинкасы (электроды) арқылы атмосфералық қысыммен сутегі газы жіберіледі. Сутегі молекулалары кеуек платинада адсорбцияланады және онда жақсы ериді. Платинаның катализатор ретінде әсер етуінің нәтижесінде сутегі молекулалары аздап атомдарға ыдырайды.
Н 2 =2Н
Стандартты сутегі электроды
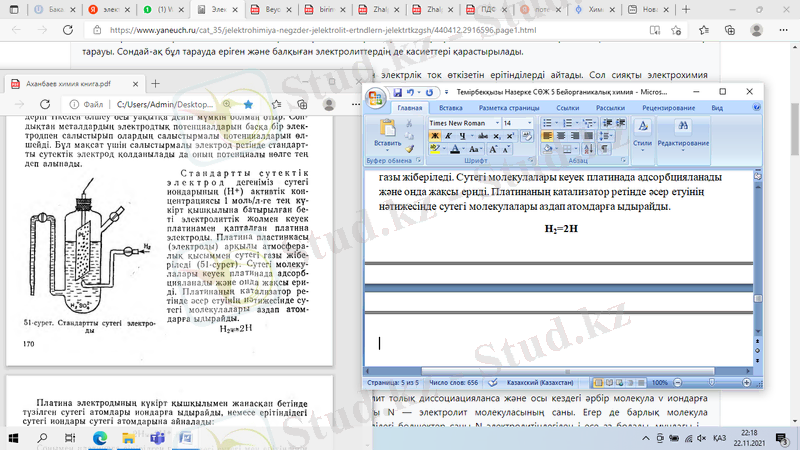
Платина электродының күкірт қышқылымен жанасқан бетінде түзілген сутегі атомдары иондарға ыдырайды, немесе ерітіндідегі сутегі нондары сутегі атомдарына айналады:
2H=2H + +2е
Сонымен платинаға сіңірілген газ күйдегі сутегі мен ерітіндінің арасында мынадай тепе-теңдік күйдегі процестер жүреді:
H 2 =2H=2H + +2е
Бұл тотығу-тотықсыздану процестерінің жүруіне платина тікелей қатыспайды, бірақ ол газ күйдегі сутегіні көп мөлшерде сіңіріп алып, процестердің жүруіне катализатор ретінде әсер етеді және сутегінен жасалған электрод сияқты жұмыс істейді. Осы процестердің нәтижесінде түзілген сутегі электродының потенциалын нөлге тең деп алады.
Металдардың электродтық потенциалдарының сандық мәндері олардың химиялық активтігін көрсетеді. Сондықтан металдардың химиялық активтігін бір-бірімен салыстыру үшін олардың потенциалдарын өлшейтін ерітінділердегі иондарының концентрациялары бірдей болуы керек.
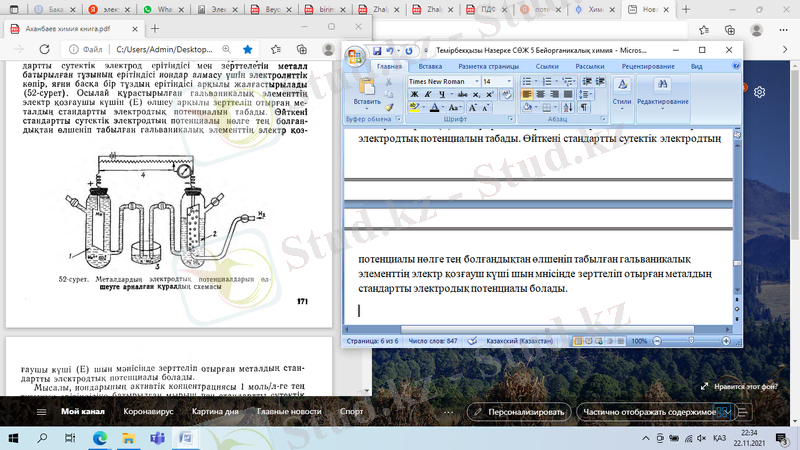
Металдардың стандарттық потенциалдарын (ф ˚ 298 ) өлшеу үшін стандартты сутектік электрод пен иондарының активтік концентрациясы 1 моль/л-ге тең тұзының ерітіндісіне батырылған зерттелетін электродтан гальваникалық элемент құрастырады. Стандартты сутектік электрод ерітіндісі мен зерттелетін металл батырылған тұзының ерітіндісі иондар алмасу үшін электролиттік көпір, яғни басқа бір тұздың ерітіндісі арқылы жалғастырылады. Осылай құрастырылған гальваникалық элементтің электр қозғаушы күшін (E) өлшеу арқылы зерттеліп отырған металдың стандартты электродтық потенциалын табады. Өйткені стандартты сутектік электродтың потенциалы нөлге тең болғандықтан өлшеніп табылған гальваникалық элементтің электр қозғауш күші шын мнісінде зерттеліп отырған металдың стандартты электродық потенциалы болады.
Металдардың электродық потенциалдарын өлшеуге арналған құралдың схемасы
Мысалы, иондарының активтік концентрациясы 1 моль/л-ге тең тұзының ерітіндісіне батырылған мырыш пен стандартты сутектік электродын жалғастырудан шыққан гальваникалық элементтің схемасы мынадай болады:
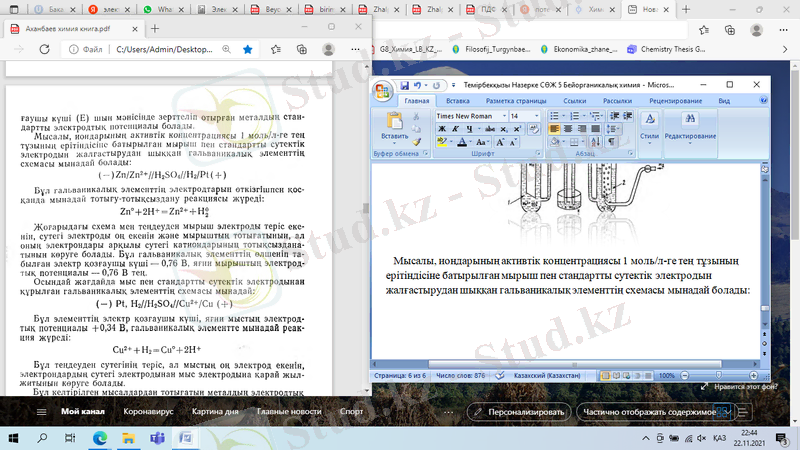
Бұл гальваникалық элементтің электродтарын өткізгішпен қосқанда мынадай тотығу-тотықсыздану реакциясы жүреді:
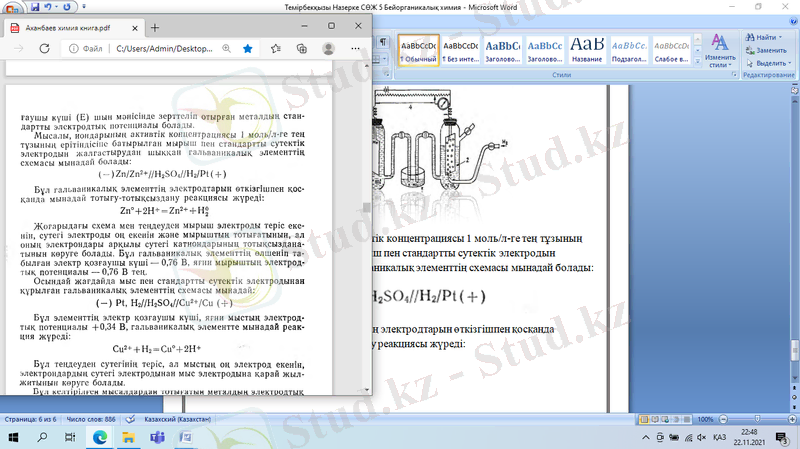
Жоғарыдағы схема мен теңдеуден мырыш электроды теріс екенін, сутегі электроды оң екенін және мырыштың тотығатынын, ал оның электрондары арқылы сутегі катиондарының тотықсызданатынын көруге болады. Бұл гальваникалық элементтің өлшеніп табылған электр қозғаушы күші - 0, 76 В, яғни мырыштың электродтық потенциалы - 0, 76 В тең.
Бұл келтірілғен мысалдардан тотығатын металдың электродтық потенциалы теріс, ал сутегі электродынан электрондар қабылдайтын электродтардың потенциалдары оң болатыны байқалады.
Сонымен иондарының концентрациясы 1 моль/л-ге тең өзінің тұзының ерітіндісіне батырылған металл мен стандартты сутектік электродының потенциалдар айырмасы металдың стандарттық электродтық потенциалы деп аталады.
Металдардың электродтық потенциалдары жағдайларға, атап айтканда ортаның кышқылдығына, температураға, концентрацияға байланысты өзгеріп отырады.
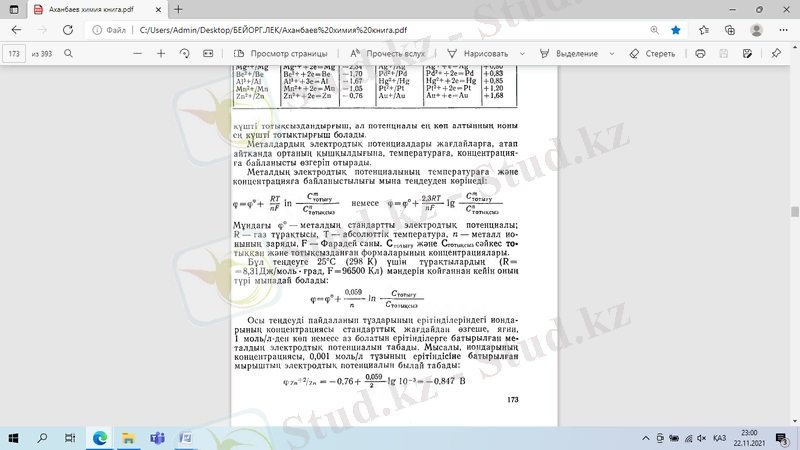
Металдың электродтық потенциалының температураға және концентрацияға байланыстылығы мына тендеуден көрінеді:
Гальваникалық элемент дегеніміз- химиялық тотығу - тотықсыздану реакцияларының энергиясын электр энергиясына айналдыратын қондырғы. Қарапайым гальваникалық элемент электролит ерітінділеріне (1-текті өткізгіштер) батырылған кез келген екі металл электродтан тұрады. Көбінде металл өз тұзының ерітіндісіне батырылады. Ерітінділер бір - бірінен кеуекті қалқа арқылы немесе электролиттік көпірше арқылы бөлінеді. Сызба нұсқа түрінде электродты электрохимиялық сызбанұсқа жазады, онда электрод - ерітінді фазалар бөлімінің шекарасы тік сызықпен бөлінген.
Гальваникалық элементті алғаш рет 1774 жылы Луиджи Гальвани бақаға тәжірибе жасай отырып, тірі электр тоғын ашады. Осындай тәжірибе жүргізе отырып, Луиджи Гальвани тоқ көзі ретінде табиғи электр қуатын пайдаланғысы келді, алайда ол күні аспан ашық болды да, аспанда бір шөкім де бұлт болған жоқ. Ғалым бақаның жұлынына енгізіп қойған электродтарды бақа жатқан темір торға байқамай тигізіп басып кетеді. Гальвани тура найзағай ойнаған кезде жасаған тәжірибе кезіндегідей жиырылу пайда болғанын көргенде, өте қатты таңданады. Бұлшықеттер сыртқы тоқ көзі болмаған кезде де жиырылатынын анықтағанда, Луиджи Гальвани одан да көбірек таңырқады. Өткізгішпен жалғасқан әртүрлі екі металл тіліктерін бұлшық еттерге жай ғана салған кезде де, олар жиырылады екен.
Мыс-мырыштық гальваникалық элементі ZnSO 4 ерітіндісіне батырылған мырыш электроды мен CuSO 4 ерітіндісіне батырылған мыс электродынан тұрады. Берілген электрохимиялық жүйеде мырыш электроды оң, ал мыс электроды теріс зарядталған. Мырыш электродында тотығу процесі жүреді:
Zn - 2e = Zn 2+
ал мыс электродында тотықсыздану реакциясы жүреді:
Сu 2+ + 2e = Cu

Гальваникалық элемент жұмыс істегенде сол электродтарда мырыштың тотығуы және оң электродта мыс катионының тотықсыздануы нәтижесінде оң жақтағы жартылай элементте аниондарының артық мөлшері, ал сол жағында - оның жетіспеушілігі туады. Яғни элементтің жұмысы оң жақтағы жартылай элементтен солға қарай иондарын тасымалдау. Сондықтан екі жартылай элементтен құралған. Элемент жұмыс істеуі үшін ерітінділер жанасуы қажет. Екі ерітіндіні де электролиті бар кеуекті қалқа немесе жалғағыш көпірше арқылы бөледі.
Осы гальваникалық элементтің электродтарында жүретін тотығу-тотықсыздану реакциясының жиынтық теңдеуін былай жазуға болады:

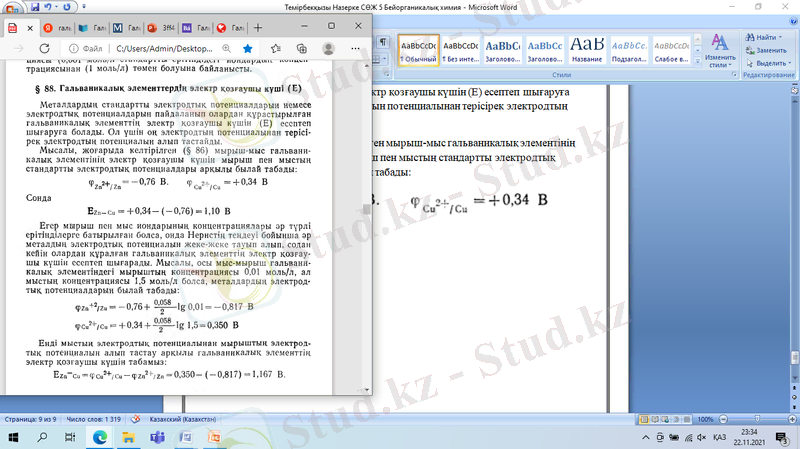
Металдардың стандартты электродтық потенциалдарын немесе электродтық потенциалдарын пайдаланып олардан кұрастырылған гальваникалық элементтің электр қозғаушы күшін (E) есептеп шығаруға болады. Ол үшін оң электродтын потенциалынан терісірек электродтың потенциалын алып тастайды.
Мысалы, жоғарыда келтірілген мырыш-мыс гальваникалық элементінің электр қозғаушы күшін мырыш пен мыстың стандартты электродтық потенциалдары арқылы былай табады:
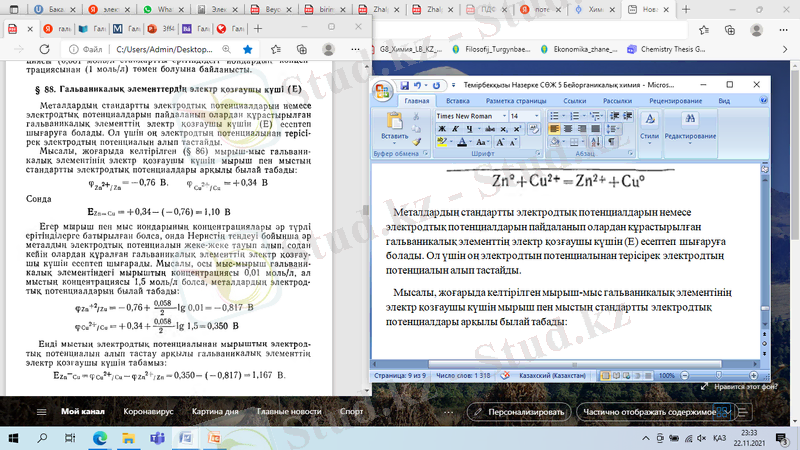
Сонда
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz