Электролиттік диссоциация мен Фарадей заңдары: электрохимиялық эквиваленттер және электролиздің қолданбалы технологиялары


алмады. Орыс химиктері И. А. Каблуков және В. А. Кистяковский электролиттік диссоциацияға Д. И. Менделеевтің химиялық теориясын қолданып, электролиттің суменен әрекетесіп, гидраттарға әкелетінін, ал сонан кейін диссоциацияға түсіп иондарға ыдырайтының көрсетті. Электролит ішіндегі молекулалар диссоциациясы келесі ретпенен өтеді:
- су молекулалары электролит молекулаларының айналасында полюске қарап бағытталады;
- электролит молекулалары гидратталынады;
- олар иондалынады;
- гидратталынған иондарға ыдырайды.
Электролиттер диссоциация екі топқа бөлінеді - күшті және әлсіз топтарға.
- Күшті электролиттерде - ерітінділер толық диссоциацияға түседі, ыдырайды, диссоциация дәріжесі бірге тең болатын мәнділікке ұмтылады;
- Әлсіз электролиттерде - диссоциация дәрежесі нөлге ұмтылады.
Электролиттер кедергісінің температурадан тәуелділігі келесідей - температура жоғарылағанда диссоциация жеңілденіп, иондардың қозғалтқыштығы өсіп, кедергісі төмендейді. Электр тоғы иондарға қалай әсер етеді? Өзіміздің тәжірибемізге оралайық:
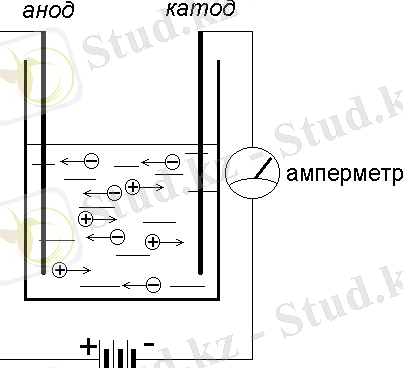
2-ші сурет. Тәжірибелік электролизер
Біздің жағдайымыздағы CuSO 4 ерітіндісі Cu 2+ және SO 4 2- иондарына диссоцияланады. Оң зарядталған Cu 2+ (катион) теріс зарядталған катодқа ұмтылады да металлдық мысқа айналып катодтың бетіне отырады, ал теріс зарядталған оттегі аниондары оң зарядталған анодқа барады да, газ ретінде сыртқа бөлініп шығады.
Фарадейдің бірінші заңы
Ал енді біз жоғарыда айтылған тәжірибемізде катодта қанша мыс массасы бөлініп шыққанын анықтайық? Катодта отырған мыс массасын біз катодтың электролизге дейінгі және электролизден кейінгі массаларының айырымы бойынша өлшеп білеміз. Өлшем көрсеткендей, катодтағы мыс массасы ерітіндіден өткен тоқ шамасы мен электролиз уақытынан тәуелді:
m=K×I×t
мұнда K -пропорционалдық коэффиенті, ол электрохимиялық эквиваленті деп аталынады. Осы формуладан катодтағы мыс массасы ерітіндіден өткен тоқ шамасы мен уақытқа тікелей тәуелділікте тұрғанын анықтаймыз. Ал:
q=I×t
заряд ерітіндіден өткен заряд шамасы екенін көреміз. Қорытындылай отырып, біз электродтағы бөлініп шығатын заттар массасы келесі формуламен есептелінетіне келеміз: M=K×q
Бұл тәуелділікті 1843 жылы ағылшын ғалымы Майкл Фарадей ашты. Ол Фарадейдің бірінші заңы деп аталынады.
Фарадейдің екінші заңы
Ал енді электрохимиялық эквивалент дегеніміз не екенін түсінейік? Майкл Фарадей бұл сұраққа да жауап берді. Көптеген тәжірибелер арқылы ол бұл шаманың әрбір затқа әр түрлі мәнді шама екенін көрсетті. Мысалы, ол ляпис (азотқышқылды AgNO 3 ) ерітіндісінің электролизінде 1 кулон заряд шамасы арқылы 1, 1180 мг күміс бөлініп шығатынын көрді. Сонымен қатар, тура осындай 1 кулон заряд шамасы 1, 1180 мг күмісті кез келген күміс тұзынан шығаратынын анықтады. Демек, 1 кулон заряд басқа металлдардың тұз ерітінделірінен басқа шамалы зат бөлігін шығаратынын көрді. Осы тұғырдан айтсақ, 1 кулон заряд бөліп шығаратын зат мөлшерін электрохимиялық эквивалент деп атаймыз. Кейбір заттар үшін оның мәндері келесідей:
1-ші кесте. Заттардың электрохимиялық эквиваленттері
Таблицадан көрініп тұрғандай, әрбір заттар үшін электрохимиялық эквиваленттің әрқилы мәнді екенін көріп тұрмыз. Сонда, электрохимиялық эквивалент заттардың қандай қасиеттерінен тәуелді? Бұл сұраққа Фарадей тағы жауап берді:
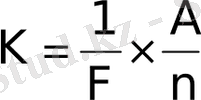
Әртүрлі заттардың электрохимиялық эквиваленттері олардың атомдық салмақтарына және химиялық валенттілігіне кері пропорционал екенін көрсетті. Мұнда: n - зат валенттілігі, A - атомдық салмағы,
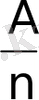 - заттың химиялық эквиваленті,
- заттың химиялық эквиваленті,
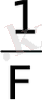 -пропорционалдық коэффициент, ол барлық заттар үшін бір шамалы Фарадей саны деп аталынады, егерде электрохимиялық эквивалент г/к болса, онда оның мәні 1, 037×10
-5
г/к .
-пропорционалдық коэффициент, ол барлық заттар үшін бір шамалы Фарадей саны деп аталынады, егерде электрохимиялық эквивалент г/к болса, онда оның мәні 1, 037×10
-5
г/к .
Фарадейдің бірінші және екінші заңдарын бірітіре отырып, алатынымыз:
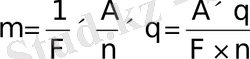
Мұнда F 96400 к/г.
Білімгерлердің тағыда естеріне салсақ, онда біз барлық химиялық реакцияларға қатысатын заттардың шамалары бір ғана шама - моль мен өлшенетіндігін құптаймыз. Бір моль затты өлшеп алу үшін, ол заттың салыстырмалы молекулалық салмағына тең грамм салмақ алымыз керек. Мысалы, 1 моль судағы ( H 2 O ) 18 граммға тең болады (1+1+16=18), ал 1 моль оттегіде ( O 2 ) - 32 граммға, 1 моль темірде ( Fe ) - 56 граммға тең . Тұжырымдап айтқанда, 1 Моль - затта 6×10 23 молекулалар бар екеніне келеміз.
Бұл санды ашқан итальян ғалымы Авогадро, сондықтан ол сан Авогадро саны деп аталынады. Егерде біз,
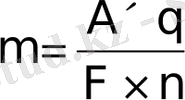 формуласынан,
q=F
, деп алсақ онда
формуласынан,
q=F
, деп алсақ онда
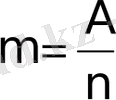 , демек электролит арқылы 96400 кулон заряд өтсе онда,
, демек электролит арқылы 96400 кулон заряд өтсе онда,
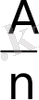 грамм кез келген зат бөлініп шығады. Басқаша айтқанда, бірваленттілік 1 моль зат бөлініп шығу үшін электролит арқылы q=F кулонға тең заряд өкізуіміз қажет. Бірақ біз 1 моль затта - N=6x10
23
молекулалар бар екенін білеміз, сондықтан да бір валенттілік заттың бір ион зарядын - яғни, бір элементарлы заряд - (!) 1электронның зарядын анықтай аламыз :
грамм кез келген зат бөлініп шығады. Басқаша айтқанда, бірваленттілік 1 моль зат бөлініп шығу үшін электролит арқылы q=F кулонға тең заряд өкізуіміз қажет. Бірақ біз 1 моль затта - N=6x10
23
молекулалар бар екенін білеміз, сондықтан да бір валенттілік заттың бір ион зарядын - яғни, бір элементарлы заряд - (!) 1электронның зарядын анықтай аламыз :
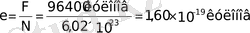
Білімгерлерге қайталап айтсақ , электролиз дегеніміз - кез келген заттардың ерітінділері арқылы электр тоғы өтетін және олар үшін Фарадей заңдары сақталынатын құбылысты айтамыз. Электролиз арқылы өндірістерде көптеген аса таза тірлі-түсті қымбат металлдарды алуға болады, олар (рафинирлеу, аффинаж) сияқты күрделі технологиялық өндірістік процесстерарқылы алынады. Мысалы, аса таза мыс металлын алу үшін, құрамында мыс металлы бар руданы анод арқылы рафинирлеп, яғни ерітіп, тазалағанда, руда құрамындағы басқа қоспалар шлам ретінде анодтың астына түсіп қалады да, ал мыс катиондары катодқа барып тап-таза мыс металлы ретінде бөлініп шығады.
Бұл технология арқылы 99, 99% құрамды («төрт тоғыздық») атты таза түсті қымбат (аффинаждалынған алтын Au , күміс Ag ) металлдар алынады. Айта кететін жағдай, элетролизді қазіргі таңда тек қана ерітінділер арқылы өткізбей - балқымаларға да қолданады, мысалы алюминийді, боксит рудасын балқытып, электролизді жүргізіп алады.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz