Азот қышқылының өндіріс технологиясы және қасиеттері


Қазақстан Республикасының Білім және Ғылым министрлігі
Қожа Ахмет Ясауи атындағы Халықаралық қазақ-түрік университеті
Жаратылыстану ғылымдары факультеті
Экология және химия кафедрасы
Бейорганикалық химия Ⅱ пәні
ОҚУ ПРАКТИКАСЫ
Азот қышқылының өндірісі
Орындаған: Елемес Б. Н.
Қабылдаған: Жылысбаева Г. Н.
Түркістан 2022
Тақырыбы: « Азот қышқылының өндірісі »
Жоспары:
І. Кіріспе
Азот және азот қышқылының даму тарихы
ІІ. Негізгі бөлім
- Азот қышқылының алыну жолдары
- Азот қышқылын концентрлеудің өндіріс схемасы
- Мыс пен сұйылтылған азот қышқылының өзара әрекеттесуі(тәжірбиелік әдіс)
ІІІ. Қорытынды
IV. Пайдаланылған әдебиеттер тізімі
КІРІСПЕ
Азот деген сөз тіршіліксіз(тірі емес) деген мағына береді.
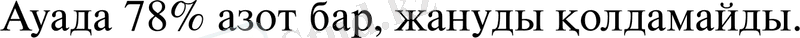 Бір мезгілде азот қышқылы жарылғыш заттардың барлық түрлерінің, нитраттар және басқа да бірқатар техникалық тұздар; өнеркәсіпті органикалық синтез; «ракета техникасы, тотықтырғыш әртүрлі процестерде және көптеген халық шаруашылығының басқа салаларында қолданылады.
Бір мезгілде азот қышқылы жарылғыш заттардың барлық түрлерінің, нитраттар және басқа да бірқатар техникалық тұздар; өнеркәсіпті органикалық синтез; «ракета техникасы, тотықтырғыш әртүрлі процестерде және көптеген халық шаруашылығының басқа салаларында қолданылады.
Жер қыртысындағы азоттың мөлшері 0. 03% болып табылады. Табиғатта азот дербес және қосылыстар күйінде кездеседі және негізгі қоры екі атомнан тұратын молекула түрінде ауа құрамында болады. Азоттың ауадағы салмақ үлесі 75. 6%, көлем үлесі 78. 1%. Жер қыртысының 1 т массасына 1 кг азоттан келеді, әрі ол бейорганикалық және органикалық қосылыстар күйінде кездеседі. Оның бейорганикалық қосылыстарының негізгілеріне натрий нитраты (чили селитрі), калий нитраты (үнді селитрі) жатады. Органикалық қосылыстар күйіндегі азоттың негізгі қоры барлық тірі ағзалардың ақуыздарында құрамына кіреді. Кезінде жанбайтын қасиетіне байланысты “тіршіліксіз” деп аталып кеткенімен азот тіршілікке өте керек элемент. Қалыпты температурада азот түссіз, иіссіз газ. Қайнау температурасы - 196 °C, қату температурасы - 210 °C. Азоттың суда ерігіштігі оттектің ерігігтігінен төмен. Ауадан аздап жеңіл болады.
Азот молекуласының атомдары өзара үш байланыспен тартылатындықтан, оларды бір-бірінен ажыратуға көп энергия керек. Сол себепті азот кәдімгі жағдайда тұрақты болып келеді де, литийден басқа ешқандай жай және күрделі затпен әрекеттеспейді. Химиялық белсенділігінің төмендігі жөнінен азот инертті газдардан кейінгі орынды иемденеді. Азотты қыздырса, көптеген металдармен әрекеттесіп, нитридтер түзеді. Бейметалдармен аса жоғары температурада ғана әрекеттеседі. Мысалы, оның оттекпен әрекеттесуі 3000-4000 °C-та басталады. Өнеркәсіпте азот ауаны сұйылту арқылы алынса, лабораториялық жағдайда аммоний нитритін немесе бихроматын қыздырып алады. Азот негізінен аммиак өндіруге, ал инертті болғандықтан, электр шамдарын толтыруға қолданылады. Химиялық элементтердің периодтық жүйесінде азот II периодта, V топтың негізгі топшасында орналасқан. Азоттан басқа ол топшаны, фосфор Р, мышьяк As, сурьма Sb және висмут Ві элементтері кұрайды. Азотты алғаш рет 1772 жылы ағылшын ғалымы Д. Резерфорд ашты. Азот грекше «өмірді қуаттамайды» деген мағына береді.
Периодтық жүйедегі орны. Азот екінші периодтың, бесінші топтың негізгі топшасының элементі, реттік нөмірі 7. Олай болса азоттың ядросында 7 протон мен 7 нейтрон бар. Электрондарының жалпы саны да 7. Осы 7 электрон екі электрондық қабатта былай бөлініп орналасқан: 1s 2 2s 2 2p 3 .
Сондықтан азот қосылыстарында үш валентті, негізгі жағдайдағы қосылыстарында азоттың тотығу дәрежелері -3, 0, +3 болады, мысалы:
NH 3 , N 2 , N 2 O 3
Қосылыс түзген кезде азот атомында бос d қабаты болмағандықтан 2s деңгейшесіндегі электрон жұбы ажырайды. Байланыс түзу үшін бір электрон электртерістілігі басымырақ элементке ауысып, азоттың тотығу дәрежесі +1, әрі қарай +2, +3, +4, +5-ке дейін жетеді.
Бұл тізбеде N 2 О мен NО тұз тұзбейтін оксидтер. Қалғандары қышқылдық оксидтер; оларға сәйкес қышқылдарының формулалары HNО 2 - азотты қышқыл, HNО 3 - азот кышқылы. Азот қышқылы маңыздылығы жоғары бейорганикалық қышқыл болып табылады және өндіріс көлемі бойынша күкірт қышқылынан кейінгі екінші орынды алады. Суда еритін тұздар түзеді (нитраттар), азоттың концентрлі түрінің органикалық қосылыстарға тотықтырғыш және нитрлеуші әсері бар, қара металдарды пассивтейді. Бұның барлығы азот қышқылының халық шаруашылығында, қарулы техникада кең қолданыс табуына жол ашқан. Азот қышқылының 70-80 % минералды тыңайтқыштарда пайдаланады.
НЕГІЗГІ БӨЛІМ
1904 жылы атмосфералық азотты аммиак өндірісімен байланыстырудың цианамидтік әдісі ұсынылды. 1905 жылы ауаны электр доғасы арқылы өткізуге негізделген «жану ауасының» доғалық әдісі жасалды, нәтижесінде атмосфералық оттегінің әсерінен ошақта еріген азот оксидіне (IV) тотығатын азот оксиді (II) пайда болды. және азот қышқылы алынады.
Кейіннен бұл әдістер үнемді және үлкен тонналық өндіріске қолайлы болғандықтан аммиакты синтездеу және өңдеу әдісіне жол берді. Азот қышқылының өнеркәсіптік өндірісі синтетикалық аммиактың каталитикалық тотығуына негізделген.
Бір цехта атмосфералық азоттан аммиак, табиғи газдардан сутегі синтезделеді. Басқа цехта аммиакты азот оксидіне (II) катализатордың қатысуымен атмосфералық оттегімен тотықтырады:
4NH 3 + 5O 2 = 4NO↑ + 6H 2 O
ауада азот оксидіне (IV) айналады. Соңғысы сумен (атмосфералық оттегінің қатысуымен) әрекеттеседі және азот қышқылы да алынады:
4NO 2 + O 2 + 2H 2 O = 4HNO 3
Аммиактың тотығуында катализатор ретінде платина мен родий қорытпасынан жасалған металл тор қолданылады.
Азот тыңайтқыштары зауыттарында азот қышқылы азот тыңайтқыштарына өңделеді. Дегенмен, шикізаттың (азот және сутегі) төмен құнына қарамастан, синтетикалық азот тыңайтқыштары өндірістің технологиялық күрделілігіне байланысты барлық минералды тыңайтқыштардың ең қымбаты болып қала береді. Жалпы, олар табиғи тұздарды өңдеу арқылы алынатын фосфор және әсіресе калий минералды тыңайтқыштарына қарағанда әлдеқайда қымбат.
Тығыздығы 1, 53 г/см³ түссіз сұйықтық +86°С қайнайды, -41°С кристалданады.
Оның булары ауа ылғалдылығымен тұман тамшыларын құрайды. Азот қышқылы сумен кез келген қатынаста араласады.
Өнеркәсіпте 68% азот қышқылы (тығыздығы 1, 4 г/см³) өндіріледі. Құрамында 96-98% HN0 3 бар, еріген азот диоксидімен қызыл-қоңыр түске боялған «түтінді» азот қышқылы сатылымға шыға бастады. Азот қышқылы басқа концентрацияларда да өндіріледі.
Азот қышқылы күшті қышқыл, сұйылтылған сулы ерітінділерде ол иондарға толығымен ыдырайды:
HNO ⇄ H⁺ + NOˉ 3
Азот қышқылы әлсіз, жылу мен жарық әсерінен азот оксидіне (IV), оттегіге және суға ыдырайды, сондықтан оны салқын және қараңғы жерде сақтайды.
Қышқыл - ең күшті тотықтырғыштардың бірі, оның молекуласында азот тотығу дәрежесі +5 көрсетеді және тек электрондарды қоса алады. Концентрлі азот қышқылы темірге, хромға және алюминийге (қыздырусыз) әсер етпейді. Оның үстіне ол бұл металдарды «пассивтендіреді».
Бірақ ең күшті тотықтырғыш әсер - «aqua regia» деп аталатын концентрлі азот қышқылының бір көлемі мен үш көлемдегі концентрлі тұз қышқылының қоспасы.
Азот қышқылы көптеген органикалық заттарды тотықтырады, бояғыштардың түсін кетіреді. Көбінесе көп жылу бөліп, затты жанғыздырады. Мысалы, азот қышқылына бір тамшы скипидар қоссаңыз, жарқын жарқыл пайда болады. Сол сияқты қыздырылған үгінділер, мақта немесе қағаз азот қышқылының түтінінен тұтанады.
Концентрлі азот қышқылымен зертханалық жұмыстар ерекше күтімді қажет етеді.
Азот қышқылын негізгі химия өнеркәсібі өндіреді. Бұл қышқыл азотты тыңайтқыштар, пластмассалар, жасанды талшықтар, органикалық бояулар мен лактар, дәрілік және жарылғыш заттар, азотты әдіспен күкірт қышқылын алу үшін қажет.
Сусыз азот қышқылы - кристалдану температурасы -41, 6°С, қайнау температурасы - 82, 6° және тығыздығы - 1, 513г/м3 болатын сұйықтық. Сумен кез келген қатынаста араласып, гидраттар деп аталатын жеке қосылыстар, HNO 3 *H 2 O және HNO 3 *3H2O түзді. Сонау VIII ғасырдың өзінде алғаш рет азот қышқылын селитра мен темір купоросының қоспасын қыздыру арқылы алу әдісі белгілі болған еді. Кейінірек азот қышқылы селитраға концентрлі күкірт қышқылын қосқанда алынатындығы анықталды.
NaNO 3 +H 2 SO 4 =HNO 3 +NaHSO 4
Бұл реакция XIXғасырда азот қышқылына деген сұраныстың өсуіне байланысты өндірістік маңызға (күкірт қышқылын нитроз әдісі бойынша өндіру, органикалық нитроқосылыстарды өндіру) ие болды.
Азот қышқылын кокс газынан бөлінетін аммиакты тотықтыру әдісі де қолданылды. Коксты аммиак қорының тапшылығына байланысты аммиакты кальций цианамидіне су буын жіберу әдісі арқылы алды.
СaCN 2 +3H 2 O=2NH 3 +CaCO 3
Амммиакпен қатар катализаторларға у болып табылатын газдар түзілетіндіктен, азот қышқылы өндірісін аса қиындатты.
Азот қышқылын аммиактан алудың негізін салушы инженер И. И. Андреев 1914 жылдан бастап, Донбаста көмір кокстегенде шығатын аммиакты тотықтырып азот қышқылын алуға болатындығын дәлелдеді және 1917ж. Юзовкада (қазіргі Донецк) бірінші зауыт салынды.
Азот қышқылының сұрыптары және оны өндірудегі процестер
Қазіргі кезде азот қышқылының екі сұрыбы шығарылады: 50-60% сулы ерітінді болатын сұйытылған азот қышқылы және 96-98% HNO3 болатын концентрлі азот қышқылы. Сұйытылған азот қышқылы азотты қышқыл тұздарын алу үшін, ал концентрлі бояу, қопарғыш заттар және басқа өнімдер өндірісінде нитрлеу үшін қолданылады.
Сұйытылған азот қышқылы өндірісі процесі екі сатыда өтеді.
Бірінші сатысында аммиак азот (ІІ) оксидіне дейін тотығады:
4NH 3 +5O 2 =4NO+6H 2 O
Екінші сатыда азот (ІІ) оксиді азот (ІV) оксидіне тотығады:
2NO+O 2 =2NO 2
және алынған азот қостотығын сумен абсорбциялап азот қышқылын алу:
3NO 2 +H 2 O = 2HNO 3 +NO
Бос қалпында бөлінген NO диоксидіне тотықтырып, қайтадан абсорбцияланады.
Аммиактың тотығуы
Аммиак пен оттек әрекеттескенде жағдайға байланысты әр түрлі тотығу өнімдері түзіледі:
4NH 3 +5O 2 =4NO+6H 2 O +216700 кал
4NH 3 +4O 2 =2N 2 O+6H 2 O +263900 кал
4NH 3 +3O 2 =2N 2 +6H 2 O + 303100 кал
Катализатор қатысынсыз аммиак әрқашан азотқа дейін тотығады. Әртүрлі катализаторлар қолданып, температура мен процестің басқа шарттарын өзгерте отырып, реакция өнімі ретінде N 2 O немесе NO алуға болады.
Азот қышқылын өндіру зауыттарында азот тотығы шығымы 96-98% болатын аммиакты тотықтыру процесі жүргізіледі.
Аммиак тотығуы реакциясын зерттегенде жеке өнімдердің шығымдары мен процестің өту шарттары арасындағы тәуелділікті анықтау негізгі мәселе болып табылады.
Аммиак тотығуы реакциясын азот тотығы түзілу жағына бағыттау үшін таңдамалы катализатор қолданылады. Катализатор ретінде 4% Pd және 3% Ru араластырылған платинаның жіңішке (0, 04-0, 09 мм) сымынан тоқылған жиі тор қолданылады.
Өндірісте естен шығармайтын жағдай - дағдылы жағдайда аммиак пен aya қоспасының құрамындағы аммиак 16-27% аралығында болса, мұндай қоспа - «қопарылғыш». Температура жоғарылаған сайын қопарылыс беретін интервал кеңейе береді. Мысалы, 250°С температурада 14-30, 5% аммиак, егер қоспа аммиак пен оттектен тұрса, атмосфера қысымында 18°С температурадағы қопарылғыш қоспа интервалы - 15, 3-79% NH 3 . Қысым көбейген сайын мұның төменгі шегi төмендейді.
Азот (II) оксидінің азот (IV) диоксидіне тотығуы
Аммиакты тотықтырғанда пайда болған нитроз газдарының құрамындағы азот (II) оксидінің мөлшері 20% шамасында, қалғандары - оттек, азот және су буы. Азот қышқылын өндіру үшін азот (II) оксидін диоксидке мына қайтымды реакциямен тотықтырады:
2NO+О 2 <-> 2NО 2 +112 кДж
Процесс солдан оңға қарай жүргенде жылу бөлінеді, көлем кішірейеді. Ле-Шателье принципі бойынша қысым жоғарылап температура төмендеген сайын реакция оңға қарай ығысады.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz