Алкиндер: құрылымы, химиялық қасиеттері, алыну әдістері және қолданылуы


Қазақстан Республикасы Білім және ғылым министрлігі
А. Байтұрсынов атындағы Қостанай өңірлік университеті
В. Двуреченский атындағы ауылшаруашылық институты
Химия және биология кафедрасы
«Алкиндер»
тақырыбы бойынша
КУРСТЫҚ ЖҰМЫС
«Органикалық химия» пәні
«6B01511» - Химия-Биология білім беру бағдарламасы
Орындаған: Шамитдинов О. М.,
күндізгі оқыту бөлімінің
2 курс студенті
Жетекшісі: Тәуекелов Ч. А.
химия мамандығы бойынша
педагогика ғылымдарының
магистрі
Курстық жұмысты қорғау
20__ ж. __ күні өтті
бағасы
Қостанай, 2021 ж
Мазмұны
КІРІСПЕ
І Алкиндердің химиялық элемент ретіндегі жалпы сипаттамалары
1
. 1 Ашылу тарихы
Алкиндер (басқаша ацетиленді көмірсутектер) - көміртек атомдары арасында үштік байланысы бар, CnH2n-2 жалпы формуласымен гомологиялық қатар түзетін көмірсутектер. Үштік байланыс кезінде көміртек атомдары sp будандастыру күйінде болады.
Алкиндерге қосылу реакциясы тән. Айырмашылығы алкенов, оларға тән реакциялар электрофильного присоединения, алкиндер кіре алады, сондай-ақ реакция нуклеофильного қосу. Бұл байланыстың айтарлықтай s-сипатына және нәтижесінде көміртек атомының электрөткізгіштігінің жоғарылауына байланысты. Сонымен қатар, үштік байланыс кезінде сутегі атомының үлкен қозғалғыштығы алмастыру реакцияларындағы алкиндердің қышқылдық қасиеттерін анықтайды.
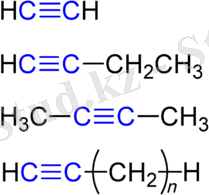
Алкиндер

Қарапайым алкин - ацетиленнің 3D моделі
1. 2 Алкиндердің номенклатурасы
Қарапайым алкин - бұл этин (ацетилен C 2 H 2 ) . IUPAC номенклатурасы бойынша алкиндердің атаулары тиісті алкандардың атауларынан «-ан» жұрнағын «-ин» - мен алмастыру арқылы түзіледі; үштік байланыстың жағдайы араб цифрларымен көрсетіледі.
Алкиндерден түзілген көмірсутекті радикалдарда «-инил» жұрнағы бар, сондықтан CH≡C - «этинил»деп аталады.
Төменде алкиндердің кейбір өкілдері және олардың атаулары берілген:
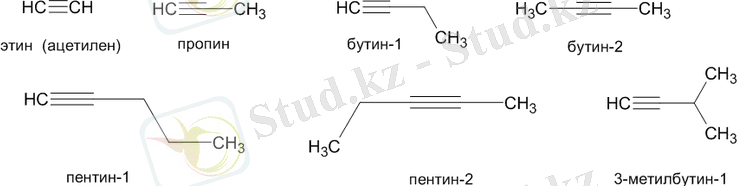
Ішкі үштік байланыс бар (мысалы: бут-2-ин) және соңы (мысалы: бут-1-ин) .
Алкиндердің гомологиялық қатары:
Этин: C 2 H 2
Пропин: C 3 H 4
Бутин: C 4 H 6
Пентин: C 5 H 8
Гексин: C 6 H 10
Гептин: C 7 H 12
Октин: C 8 H 14
Нонин: C 9 H 16
Децин: C 10 H 18
Әйтпесе, екі түрлі алкин молекуласындағы үштік байланыс позициясындағы айырмашылық (мысалы, бутин-1 және пентин-2) бұл заттардың байланыс позициясында құрылымдық изомерлер болатындығын білдіреді.
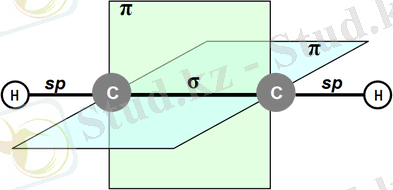
1. 3 Үштік байланыс құрылымы
Алкиндерде байланыс бар −С≡С− сызықты (бұрышы 180°) және бір жазықтықта орналасқан. Көміртек атомдары бір σ - және екі π-байланыстармен байланысады, олардың максималды электронды тығыздығы екі өзара перпендикуляр жазықтықта орналасқан. Үштік байланыс ұзындығы шамамен 0, 121 нм, байланыс энергиясы 836 кДж / моль.
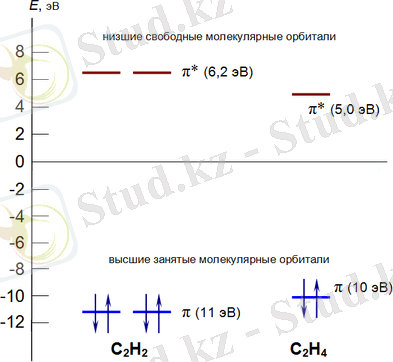
Жоғарыда келтірілген диаграммада этилен мен ацетиленнің молекулалық орбиталдары көрсетілген.
ІІ Алкиндердің қасиеттері және қолданысы
2. 1 Алкиндердің физикалық қасиеттері және оны алу әдістері
Алкиндер физикалық қасиеттері бойынша тиісті алкендерге ұқсайды. Төменгі (С 4 дейін) - алкендердегі аналогтарға қарағанда қайнау температурасы жоғары, түсі мен иісі жоқ газдар. Алкиндер суда нашар ериді, органикалық еріткіштерде жақсы.
Кейбір алкиндердің физикалық қасиеттері

* Мәндер қайнау температурасында өлшенеді.
Алкиндердің физикалық қасиеттері алкандар мен алкендерге ұқсас.
Ацетиленді көмірсутектердің қайнау және балқу температуралары молекулалық салмақтың өсуіне байланысты артады.
Қалыпты жағдайда алкиндер C 2 H 2 -C 4 H 6 - газдар, C 5 H 8 -C 15 H 28 - сұйықтар, C 16 H 30 - қатты заттар. Алкиннің ерекше иісі бар.
Тізбекте үштік байланыстың болуы олефиндер мен парафиндерге қарағанда қайнау температурасының, судағы тығыздық пен ерігіштіктің жоғарылауына әкеледі. Олар органикалық полярлы емес еріткіштерде жақсы ериді.
Ацетилен (C 2 H 2 ) - түссіз газ, таза түрінде дерлік иіссіз, техникалық ацетилен жағымсыз иіске ие, ауадан жеңіл, суда аз ериді. Ацетилен жарылғыш зат.
Алкиндердің табиғатта болуы және физиологиялық рөлі
Табиғатта алкиндер мүлдем кездеспейді. Саңырауқұлақтардың базидиомицеттердің кейбір түрлерінде полиацетилен құрылымдары бар қосылыстар өте аз мөлшерде табылды.
Ацетилен Уран, Юпитер және Сатурн атмосферасында табылған.
Алкиннің жансыздандырғыш әсері әлсіз. Сұйық алкиндер ұстаманы тудырады.
Алу әдістері
Ацетилен өндірудің негізгі өндірістік әдісі - метанды электрлік немесе термиялық крекинг, табиғи газды пиролиздеу және карбидті әдіс.
Карбидті әдіс (өндірістік әдіс)
Кальций карбиді кальций оксидінің қоспасын 1800-2000°C электр пештерінде кокспен күйдіру арқылы алынады:
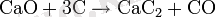
Алынған карбидке судың әсерінен кальций гидроксиді және ацетилен түзіледі:
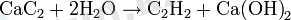
Көмірсутегі пиролизі (өндірістік әдіс)
Әдістің мәні табиғи газдың қоспасын ауамен арнайы отқа төзімді саптаманың үстінен өткізуден тұрады, ол күйдіру арқылы температураны 1500°C дейін көтереді. Содан кейін метан пиролизі қаптамада пайда болады:
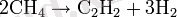
Табиғи газдан крекинг (өндірістік әдіс)
Электрлік крекинг
Әдіс метанды екі металл электродтары арасында өте үлкен жылдамдықпен өткізуден тұрады. Температура 1500-1600°C құрайды. Химиялық тұрғыдан алғанда әдіс пиролиз әдісіне ұқсас, тек технологиялық және аппараттық дизайнымен ерекшеленеді.
Термооксидативті крекинг
Бұл әдіс метанның жануы кезінде пайда болатын жылуды пайдалану есебінен оның ішінара тотығуын қолданады:
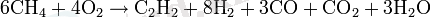
Тікелей синтез әдісі
Көміртек өте жоғары температурада сутегімен тікелей әрекеттеседі:
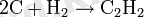
Бұл әдістің таза тарихи маңызы бар (ацетилен өндірісі 1863 ж. М. Бертелот) .
Қанықпаған карбон қышқылдарының тұздарының электролизі
1864 жылы Кекуле натрий фумараты мен натрий малеатын электролиздеу арқылы ацетилен алды:
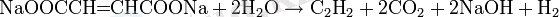
Ацетиленді натрий акрилатынан ұқсас алады.
Бұл әдістің таза тарихи маңызы бар.
Галоалкандар мен галоалкендердің (зертханалық әдіс)
Дигидрогалогендеу реакциясы дигалоалкандарға күшті негіз әсерінен жүреді:
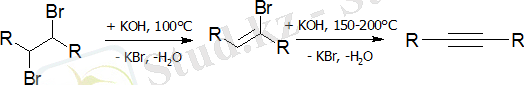
Сұйық аммиактағы натрий амидін дегидрохалогенттейтін агент ретінде қолдану ыңғайлы:
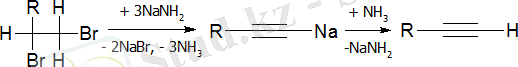
Алкиндерді алкилдеу (зертханалық әдіс)
Терминалды үштік байланысы бар алкиндерді алкилдеу келесі схема бойынша жүзеге асырылады:
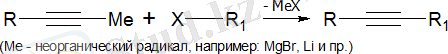
Алкиндер алудың басқа зертханалық әдістері
Кори-Фукстің реакциясы - альдегидтерден алкиндер синтезі:
Бірінші кезең - дибромоалкеннің түзілуі:
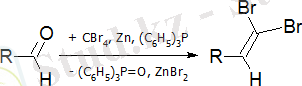
Екінші кезеңде бром бөлінеді:
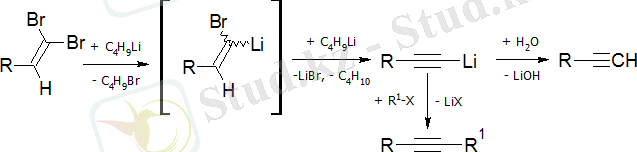
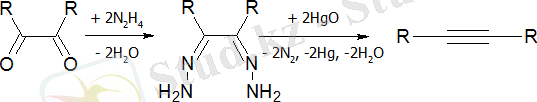
Дигидразондардың ыдырауы:
Фрищ-Буттенберг-Вичельді қайта құру - күшті негіздердің әсерінен 1, 1-диарил-2-дигалоэтилендерді ацетилен туындыларына айналдыру:
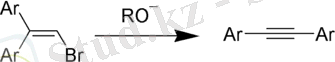
2. 2 Алкиндердің химиялық қасиеттері және оларды анықтау
Алкиндердің қышқылдық қасиеттері және нуклеофильді алмастыру реакциясы
Алкинидтердің пайда болуы
Соңғы үштік байланысы бар Алкиндер-Бұл с-h қышқылдары (аммиак пен алкендерге қарағанда күшті, бірақ спирттерге қарағанда әлсіз) олар өте күшті негіздермен алкинид тұздарын түзе алады:
 (натрий диацетилениді)
(натрий диацетилениді)
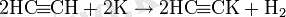 (калий ацетилениді)
(калий ацетилениді)
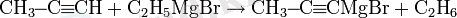 (пропенилмагнийбромиді)
(пропенилмагнийбромиді)
Алкиндердің күміс немесе моновалентті мыс аммиактарымен реакциясы үштік байланыс үшін жоғары сапалы:
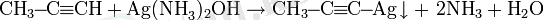
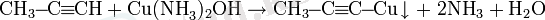
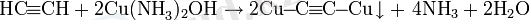
Күміс пропиниді - ақ түсті тұнба, мыс пропиниді - сары түсті тұнба, соңында мыс диацетилениді - қызыл түсті тұнба.
Күміс алкиниді натрий цианидін қосып, тиісті алкинді шығарумен оңай ериді:
![\mbox{CH}_3\!\!-\!\!\mbox{C}\!\!\equiv\!\!\mbox{C}\!\!-\!\!\mbox{Ag}+2\mbox{NaCN}+\mbox{H}_2\mbox{O}\rightarrow\mbox{CH}_3\!\!-\!\!\mbox{C}\!\!\equiv\!\!\mbox{CH}\!\uparrow+\mbox{Na}[\mbox{Ag(CN)}_2]+\mbox{NaOH}](https://kz-rkd-img.s3.studkz.pro/115981/image26.webp) Алкинидтердің нуклеофильді алмастыру реакциясы
Алкинидтердің нуклеофильді алмастыру реакциясы
Алкинидтер күшті нуклеофилдер болып табылады және нуклеофильді алмастыру реакцияларына оңай енеді:
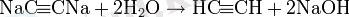
Бұл әсіресе ацетилен гомологтарын синтездеу үшін кеңінен қолданылады:
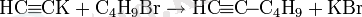
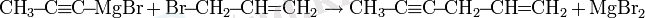
Препараттық синтезде ацетиленид-анионның ыңғайлы көзі ретінде этилендиаминмен литий ацетиленид кешені жиі пайдаланылады [8] .
Айта кету керек, қайталама немесе үшінші галогеналкандармен реакция болған жағдайда реакция көбінесе балама жолмен жүреді:
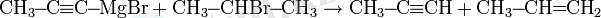
Нуклеофильді алмастырудың басқа реакциялары
Алкингалогенидтерді алу
Галогеннің сілтілік ортадағы моно алмастырылған ацетилендерге әсері арқылы галогеналкиндер алуға болады:
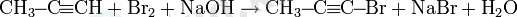
Ацетиленді мыс (II) хлоридімен хлорлау арқылы CuCl Сулы ерітінділерінде дихлорацетилен алуға болады:
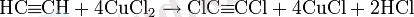
Ацетилен конденсациясы
Ацетилен конденсациясы немесе Ходкевич-Кадио реакциясы ацетилен көмірсутектерінің диацетилендер түзе отырып бром - немесе йодалкиндермен әрекеттесуінен тұрады:
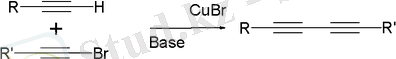
Сол сияқты Куртц реакциясы да жүреді (катализатор-мыс ацетилениді) :
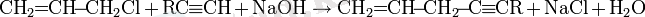
Ацетиленаминдер алу
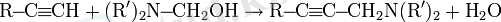
Реакция мыс (I) тұздарының қатысуымен жүреді.
Электрофильді қосылу реакциясы
Алкиндерге электрофильді қосылу оң зарядталған бөлшек - электрофилдің әсерінен басталады. Жалпы жағдайда мұндай реакциялардың катализаторы қышқылдар болып табылады.
Электрофильді қосу реакциясының бірінші сатысының жалпы схемасы:
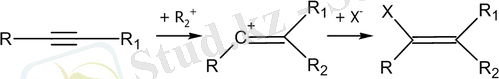
Галогендеу реакциясы
Алкиндер бір немесе екі галоген молекуласын тиісті галоген туындыларын түзе алады:
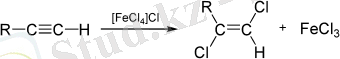

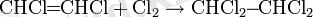
Алкиндердің галогенденуі транс-қосылыс ретінде жүреді (әдетте) және алкендердің галогенденуіне ұқсас жүреді.
Сонымен қатар, қос байланысқа қосылу қосарланған байланысқа қарағанда қиынырақ, сондықтан қос және үштік байланыс болған кезде селективті қосылуға болады:
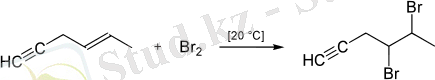
Гидрогалогендеу реакциясы
Сутегі хлориді мен сутегі бромидінің алкиндерге қосылуы алкендерге ұқсас. Реакция екі кезеңде жүреді: алдымен галогеналкен пайда болады, содан кейін дигалогеналканға өтеді:
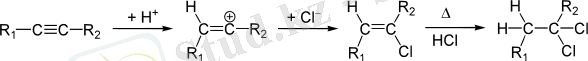
Реакцияның екі кезеңі де Марковников ережесі бойынша жүреді. Схемадан көрініп тұрғандай, қосылу реакциясы нәтижесінде транс изомерлер пайда болады.
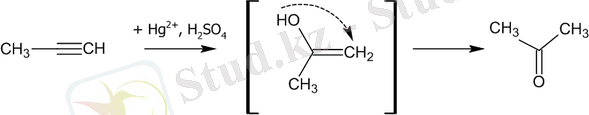
Гидратация
Сынап тұздарының қатысуымен Алкиндер ацетальдегид (ацетилен үшін) немесе кетон (басқа Алкиндер үшін) алу үшін суды қосады. Бұл реакция Кучеров реакциясы деп аталады.
Ылғалдандыру процесі енолдың қалыптасу кезеңінен өтеді деп саналады:
Карбонилдеу реакциясы
Карбонилдеу реакциясы Реппе зертханасында 1939 жылы ашылды [20] .
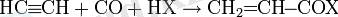
мұндағы X: ол, OR, OCOR, NH2 және т. б.

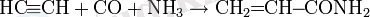
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz