Колледж студенттеріне арналған химиядан күрделі есептерді тиімді шығарудың әдістемелік нұсқаулығы


Химия пәні оқытушысы Н. М. Абдикаримованың
Химия пәнінен кездесетін күрделі есептерді шығарудың тиімді әдістері
колледж студенттеріне арналған
ӘДІСТЕМЕЛІК НҰСҚАУ
. . .

Түркістан - 2021 жыл
Еліміздің болашағы - бүгінгі жас ұрпақтың қолында,
Жас ұрпақтың болашағы - бүгінгі ұстаздың қолында”.
Н. Ә. Назарбаев.
«Химия пәнінен кездесетін күрделі есептерді шығарудың тиімді әдістері» колледж студенттеріне арналған әдістемелік құрал
Жинаққа химия сабақтарында студенттердің өзіндік жұмыстары кезінде пайдаланған жиі кездесетін есептер енгізілген. Студенттердің химия пәніне қызығуларын арттыруда, балалардың дарынын, қабілетін ашып дамытуда, қазіргі заман талабына сай білім беруде, емтихандарда жоғары жетістіктерге жетуде бұл жинақ өте тиімді деп есептеймін.
Студенттерге базалық курстан таныс сұрақтар қолданылып, оларды толықтырып, тереңдету мақсатында құрастырылды. Жинақ студенттермен, оқытушыларға көмекші құрал ретінде ұсынылады
Әдістемелік құралдың негізгі мақсаты - студенттерге химиядан емтихан тапсырмаларында кездесетін көптеген шығару жолы қиын саналатын тапсырмаларды орындаудың тиімді әдістерін ұсыну және студенттерге есептерді шешудің тиімді әдістемесін келтіру арқылы олардың ойлау қабілеті мен шығармашылық белсенділігінің дамуына ықпал ету, есептерді шығару дағдысын жетілдіре түсуге көмектесу болып табылады.
Әдістемелік құрал оқытушылар мен колледж студенттеріне, жоғары оқу орнына түсетін түлектерге арналған.
Мазмұны
Параллель жүретін реакция теңдеулері бойынша есептеу . . . 7
Ерітінділер . . . 8
Ерітінді және ерігіштік . . . 9
Химиялық тепе-тендік . . . 12
Сапалық есептерді шығару әдістемесі . . . 25
Сапалық есептерді шешудің бірнеше жолдары . . . 25
Қосымшалар. Қышқылдардың, негіздердің, тұздардың салыстырмалы молекулалық массалары . . . 29
Есептерді шешуде жиі қолданылатын формулалар, теңдеулер . . . 30
КІРІСПЕ
Қазіргі кезеңде білім беру саласында әлемдік білім кеңістігіне ұмтылуға, емтихан сұрақтарының жүйелі болуына байланысты жасалынып жатқан талпыныстар біздердің, яғни ұстаздар мен студенттерінің дербестігін, ізденімпаздығын, белсенділігі мен шығармашылық мүмкіндіктерін дамытуды талап етеді. Сондықтан колледж қабырғасынан бастап ойлау белсенділігімізді дамытып, білімімізбен біліктілігімізді шығармашылық тұрғыда жүйелеп, мақсатты, жоспарлы түрде ізденіспен жұмыс жүргізуіміз керек.
Жалпы оқу жұмысына шығармашылық мақсат қою, оны жоспарлау біздерден көптеген қасиеттерді талап етеді: зеректік, ізденімпаздық, еңбекқорлық, шабыт, мақсаткерлік, белсенділік, қызығушылық, өмірлік белсенді ұстаным.
Оқуға осындай көзқарас болғанда талдау, салыстыру, тұжырымдау, проблемаларды анықтай білу, жорамал (гипотеза) қалыптастыру, шешудің жолдарын іздестіру, алынған нәтижелерді талқылау, қажет болғанда қайта іздену сияқты қабілеттерімізді дамытып, белсенді ой-әрекеттерін талап ететін әдіс-тәсілдерді меңгере алады екенбіз.
Сонымен қоса есеп шығарумен үнемі шұғылдану - еңбек сүйгіштікке, жауапкершілікке, табандылыққа және жігерлікке үйретеді,
алға қойған мақсатқа жету үшін қайсарлықты қалыптастырады.
Теориялық түсініктеме алғаннан кейін есептер шығару мен жаттығулар орындау арқылы алған білімімізді пысықтап, толықтыра түссек тәжірибелер жасау арқылы оны тереңдетіп бекітеміз.
Химия пәнін меңгеруде бұл үшеуі - өзара байланысты, бір-бірімен сабақтас, құрамдас әдістер.
Олар бірін-бірі толықтырып, пәнге деген қызығушылығымызды, ынтамызды арттыруға қызмет етеді.
Есептер шығару барысында заттар мен құбылыстар туралы түсініктерді жете түсіну және бекіту, алған теориялық білімді сапалы да орынды пайдалана алу машығы қалыптасады.
Оқудың бұл әдісін пайдалану кезінде химия ғылымының негізгі түсініктер мен заңдылықтары көп дүркін қайталанып, оларды түсіну және есте сақтау әлдеқайда жеңілдейді.
Біріншіден есептерді шешу - теориялық материалдарды практикалық қолдану, практикада ғылыми білімді жүзеге асыру.
Екіншіден есептерді шешу - пәнаралық байланыстарды жүзеге асырудың, химия ғылымының өмірмен байланысын көрсетудің, сондай-ақ жаратылыстану ғылымының мамандықтарына баулудың тамаша әдісі деп есептеуге болады.
Психологтар мен әдіскерлер есеп шығаруды ой-әрекеттің жиынтығы деп қарастырады, яғни сандық және сапалық есептерді шығаруда білім мен әрекеттің тұтастығы ойлаудың әр түрлі әдістерін (пайымдау, жіктеу, жүйелеу, дәлелдеу, қорытындылау ) қалыптастырылады.
Методикалық әдебиеттерде студенттердің дамуы химиялық эксперимент жасағанда, сан және сапа есептерін шығарғанда жүзеге асатыны баяндалған.
Химия есептері сандық және сапалық есептер болып екіге жіктеледі. Сапа есептерін эксперимент есептері деп те атайды, өйткені оларда сандық мәліметтер болмайды, химиялық тәжірибелер жасау арқылы шығарылады. Эксперимент есептері химиялық қосылыстар мен құбылыстардың сапалық жағын қамтиды. Сан есептерінде химиялық материалдарға негізделген сандық мәліметтері болады, сондықтан оларды шығару үшін, математикалық амалдарды жүзеге асыру керек. Химия есептерінің таза математикалық есептерден айырмасы - сандық мәліметтер есептің шартында толық берілмеуі мүмкін, оларды түгендеу үшін химиялық білім керек. Мысалы, «Мыс сульфатының проценттік құрамы қандай болады?» есебінде ешбір сандық дерек жоқ, оны химиялық таңбалар мен формулалардың сандық сипаттамасына және стехиометриялық заңдарға сүйеніп табады. Шынында да мыс сульфатының құрам тұрақтылық заңына сәйкес молекулалық формуласын дұрыс жазбайынша, берілген есепті шығару мүмкін емес. Сан және сапалық есептерді шешу үшін студенттің берілген дәрежеде химиялық және математикалық даярлығы болуы керек.
Қандай болмасын химиялық есепті шығару оның мазмұнына жан-жақты талдау жасаудан, берілген шамалар арасындағы тәуелділікті ашудан басталады. Талдау нәтижесінде есептің түрі, соған лайық шығару әдісі белгіленеді. Бұл арада есептің мазмұнын физикадағы сияқты қысқа және дәл жазып үйренудің де маңызы зор. Ол үшін физика мен химияда жиі қолданатын қысқартуларды білу керек.
Қазіргі оқулықтарда әрбір тақырыптан соң үш деңгейлі тапсырмалар ұсынылған, бұлардың күрделілік деңгейлері әр түрлі ( А-жалпы деңгей, В-үздік студенттерге, С-шығармашылық деңгей) сандық есептеу мен жаттығулар берілген. Сондықтан жаңа сабақ үстінде, бекіту және күнделікті сұрау кезінде есептер шығарып машықтанған студент қорытынды бақылау жұмыстарын қиналмай орындайды, бұған сан мәрте іс-тәжірибеден көзіміз жетіп жүр.
Дамыта оқуда есеп шығару ізденімпаздық пен іскерлікті жетілдіреді, химия есептерін шығару біздердің мақсаткерлік, зеректік, қызығушылық, белсенділік, ізденімпаздық, шығармашылық қабілеттерімізді дамытып, техникалық бағыттағы мамандықтарға баулып, жарқын тәуелсіз еліміздің заман талабына сай қажетті мамандықтарын игеруге өз көмегін тигізері сөзсіз.
САНДЫҚ ЕСЕПТЕРДІ ШЕШУ ЖОЛДАРЫ
Сан есептерін ойдағыдай шешу үшін белгілі дәрежеде химиялық және математикалық даярлық болуы керек. Химия пәнінің сан есептері мазмұнына қарай бірнеше түрге бөлінеді. Олардың жиі кездесетіндері:
1. Тәжірибе мәліметтеріне және химиялық заңдарға негізделген есептеулер (құрам тұрақтылық заңы, масса сақталу заңы, эквивалент заңы және т. б. ) .
2. Газ заңдарымен байланысты есептер (молекулалық салмақты табу, қалыпты жағдайда газдың көлемін және массасын табу т. б. ) .
3. Химиялық формуланы табу және құру есептері.
4. Химиялық формулалар бойынша есептеулер.
5. Химиялық теңдеулер бойынша есептеулер.
6. Ерітінділермен байланысты есептеулер.
7. Аралас есептер.
Бұл саналғандардан басқа периодтық заң және периодтық система, атом құрылысы, химиялық реакциялардың жылдамдығы және тепе-теңдік, химия және электр тогы тақырыптарымен байланысты көптеген есептер бар. Химия есептерінің мазмұны көп түрлі болуымен бірге, шығару әдістері де сан алуан. Математикалық амалдарына қарай химия есептерін шығару әдістері бірнешеге бөлінеді: пропорция құру тәсілі, бірге келтіру тәсілі, алгебралық тәсіл, дайын формуланы пайдалану, алгоритмді қолдану және графикалық тәсіл.
Қандай да болмасын химиялық есепті шығару оның мазмұнына жан-жақты талдау жасаудан, берілген шамалар арасындағы тәуелділікті ашудан басталады. Талдау нәтижесінде есептің түрі, соған лайық шығару әдісі белгіленеді. Бұл арада есептің мазмұнын физикадағы сияқты қысқа және дәл жазып үйренудің де маңызы зор. Ол үшін физика мен химияда жиі қолданатын қысқартуларды білу керек.
Жалпы химияны меңгеруде есептер шығару маңызды рөл атқарады, себебі жоғарыда айтып өткендей бұл оқу материалын неғұрлым терең және толық меңгеруді қамтамасыз ететін және алған білімімізді өз бетімізбен қолданып, игеруге үйрететін әдістің бір түрі. Бұл туралы әйгілі ғалым - әдіскер Д. Пойа:
"Есеп шығара білу практика жүзінде алынатын өнер", - деп айтқан екен. Есепті шығара білу біліктілігін тек қана бір жолмен - жай есептен күрделі есепке жылжи отырып, тұрақты және жүйелі түрде дамыту қажет.
Сандық есептердің шығарылу жолдары колледж оқулықтарындағы және есептер жинақтарындағы тараулар бойынша берілген есептерден жүйелеп ұсынылды.
ПАРАЛЛЕЛЬ ЖҮРЕТІН РЕАКЦИЯ ТЕҢДЕУЛЕРІ БОЙЫНША ЕСЕПТЕУ
Массасы 4 г магний мен темір қоспасын тұз қышқылында еріткенде,
2, 24л ( қ. ж. ) сутек бөлінді. Қоспадағы әрбір металдың құрамын есептеңдер.
Берілгені: Шешуі:
m(Mg+Fe) =4г 2HCl+Mg=MgCl 2 +H 2 ↑
V(H 2 ) =2, 24л. ν , моль 1 1
М , г/моль 24 -
т/к ω(Mg, Fe) -? m, г 24 -
V, л - 22, 4 л
24 г Mg:22, 4 л H 2 =X г Mg :a H 2
а=
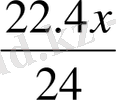 =0, 933x
=0, 933x
2HCl+Fe=FeCl 2 +H 2 ↑
ν, моль 1 1
М , г/моль 56 -
m, г 56 -
V, л -
56 г Fe : 22, 4 л H 2 =y г Fe : b л H 2
b=
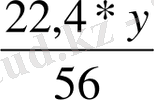 =0, 4y
=0, 4y
x+y=4г x=1, 2 г Mg
0, 933x+0, 4y=2, 24 л y=2, 8 г Fe
Жауабы: ω(Mg) =30 % ; ω(Fe) =70%
2. Көлемі 200 мл (p = 1, 46 г/мл) 80%-дық концентрлі азот қышқылы мыспен әрекеттескенде қандай газ, қанша көлемде ( қ. ж. ) бөлінеді?
Берілгені: Шешуі:
ω(HNO 3 ) =80% Cu+4HNO 3 (k) =Cu(NO 3 ) 2 +2NO 2 ↑+2H 2 O
ρ=1, 46 г/мл ν, моль 1 4 2
V ерітінді =200 мл М , г/моль 64 63 -
m, г 64 252 -
m(Cu) =200 г V, л 44, 8
т/к V(NO 2 ) =?
m(HNO 3 ) =200*1, 46*0, 8=233, 6
МФ(Cu) =
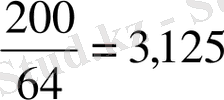
МФ(HNO
3
) =
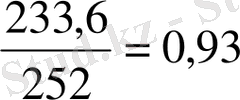
МФ(HNO 3 ) < МФ(Cu)
252 г HNO 3 :44, 8 л NO 2 =233, 6 г HNO 3 :x л NO 2
x=41, 53 л
Жауабы:41, 53 л NO 2
ЕРІТІНДІЛЕР
А-1 Берілгені: Шешуі:
m(қант) =300г ω=m ер. з *100/m еріт
m(H 2 O) =800г
m еріт =m зат +m ер-кіш
т/к ω(қант) -? m еріт =300+800=1100 г
ω=
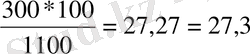
Жауабы:27, 3%
А-2 Берілгені: Шешуі:
m еріт =900г ω=m ер. з *100/m еріт
m ер. з =ω* m еріт /100%
ω зат =30%
т/к : m (зат, су) -? m
ер. з
=
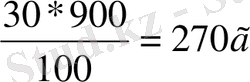
m еріт =900-270=630 г су
Жауабы: m(зат) =270 m(су) =630
В-1 Берілгені: Шешуі:
C(x) =m/M*V M(Na 2 SO 4 ) =142 г/моль
V еріт =500 мл m=C(x) *M*V=0, 5*142*0, 5=35, 5 г
С (Na 2 SO 4 ) =0, 5 моль/л
т/к m( Na 2 SO 4 *10H 2 O) -? M( Na 2 SO 4 *10H 2 O) =142+180=322 г/моль
322 г( Na 2 SO 4 *10H 2 O) :142 Na 2 SO 4 =
x г ( Na 2 SO 4 *10H 2 O) :35, 5 г Na 2 SO 4
x=80, 5 г Na 2 SO 4 *10H 2 O
Жауабы: 80, 5 гNa 2 SO 4 *10H 2 O
В-2 Берілгені: Шешуі:
ω(H 2 SO 4 ) =40% m ер. з =ω* m еріт /100%
m(H
2
SO
4
) =
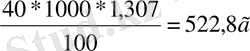
ρ=1, 307 г/мл С(H
2
SO
4
) =m/M*V C(x) =
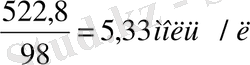
т/к С(H 2 SO 4 ) -? Жауабы:5, 33 моль/л
С-1 Берілгені: Шешуі:
m(CuSO 4 ) =10г CuSO 4 +2KOH=Cu(OH) 2 ↓+K 2 SO 4
ω(KOH) =16% ν, моль 1 2
ρ=1, 137г/мл
М , г/моль 160 5
т/к V(KOH) -? m, г 160 112
160 г CuSO 4 :112 г KOH=10 г CuSO 4 :x KOH
x=7 г KOH
ω=m ер. з *100%/m еріт
V=
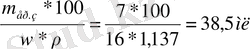
Жауабы:38, 5 мл
С-2 Берілгені: Шешуі:
V еріт =500 мл ω=m ер. з *100/m еріт
C (H 2 SO 4 ) =0, 5моль/л m ер. з =C*M*V=0, 5*0, 5*98=24, 5 г
ω (H
2
SO
4
) =20% V=
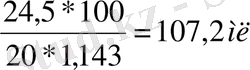
ρ=1, 143 г/мл
т/к V еріт (H 2 SO 4 ) -? Жауабы:107, 2 мл
ЕРІТІНДІ ЖӘНЕ ЕРІГІШТІК
А-1 Берілгені: Шешуі:
S KI =160/100г H 2 O 260 г ер-ді 160 г ер. зат
m ер. =500г
500 г ер-ді х г ер. зат х=307, 7г ер. зат
т/к m(KI), m(H 2 O) -? m H 2 O=500-307, 7=192, 3 г H 2 O
Жауабы: m(KI) =307, 7, m(H 2 O) =192, 3 г
А-2 Берілгені: Шешуі:
S Pb(NO3) 2 =90г/100г H 2 O
190 г ер-ді 90 г ер. зат
т/к ω-? 250 г ер-ді х г ер. зат х=47, 37%
Жауабы:47, 37%
В-3 Берілгені: Шешуі:
m ер-ді (1) =250г t 1 =60 º
S Pb(NO3) 2 =90/100г H 2 O 190 г ер-ді 90 г ер. зат
S Pb(NO3) 2 =70/100 гH 2 O
250 г ер-ді х 1 г ер. зат х 1 =118, 42г
т/к ∆х-? t 2 =40 º
170г ер-ді 70 г ер. зат
250 г ер-ді х 2 г ер. зат х 2 =102, 94 г
∆х=x 1 -x 2 =118, 42-102, 94=15, 48г
Жауабы:15, 48 г тұз тұнады
С . Берілгені: Шешуі:
V(C 4 H 10 ) =100л
2 C 4 H 10 +9O 2 =4CO 2 +10H 2 O
т/к V(ауа) -? 2 л 9 л
100 лх л х=450л
V(ауа) =450л*5=2500л=2, 5м 3
Электролиз
В-1 Берілгені: Шешуі:
M(CuSO 4 ) =160 г/моль
m ер. (CuSO 4 ) =300г 160 г CuSO 4 : 64 г Cu=x гCuSO 4 :12, 8г Cu
m(Cu) =12, 8г х=32г CuSO 4
т/к V(O
2
), ω(CuSO
4
) -? ω(CuSO
4
) =
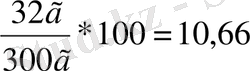
2CuSO 4 +2H 2 O→2Cu+O 2 ↑+2H 2 SO 4
ν, моль 2 1
М, г/моль 64 -
m, г 128 -
V, л - 22, 4
128г Cu: 22, 4л O 2 =12, 8г Cu : x л O 2
х=2, 24 л О 2
Жауабы: V(O 2 ) =2, 24 л, ω(CuSO 4 ) =10, 66%
В-2 Берілгені: Шешуі:
AgNO 3 5, 6 л1 экв
V(O 2 ) =11, 2 л
11, 2 л2 экв
т/к m(Ag) -? 1 экв Ag---108 г
2 экв Ag---х x=216г Ag
Жауабы: m(Ag) =216 г
В-3 Берілгені: Шешуі:
KI 127 г(I 2 ) ---1 экв
m(I 2 ) =25, 4г
25, 4 г(I 2 ) ---2 экв х=0, 2 экв
т/к V(H 2 ) -?
1 экв(H 2 ) ---11, 2 л
0, 2 экв(H 2 ) ---х л х= 2, 24 л H 2
C-1 Берілгені: Шешуі:
ZnCl 2 11, 2 л Cl 2 1 экв
V(Cl 2 ) =44, 8 л 44, 8 л Cl 2 х экв х = 4 экв
m(Zn) =100 г
1 экв Zn32, 5 г
т/к η (Zn) -? 4 экв Znх г х =130 г
130 г Zn100%
100 г Znх% х =76, 92%
Жауабы: η (Zn) =76, 92%
 C-2
Берілгені: Шешуі:
C-2
Берілгені: Шешуі:
I=2 A g=I*t=2*3600=7200
t=1сағ 9652020г Ca
CaCl 2 балқыды
7200x г Ca x=1, 49г Ca
т/к m(Ca), V(Cl 2 ) -? 9652011, 2 л Cl 2
7200 х л Cl 2 х=0, 835 л
Жауабы: m(Ca) =1, 49г
V(Cl 2 ) =0, 835л
С-3 Берілгені: Шешуі:
m(Ni) = 11, 8 г 11, 8 г(Ni) -75%
η(Ni) =η(O 2 ) =75% x г (Ni) -100% х=15, 73гNi
NiSO 4 29, 5 г Ni---1 экв
т/к V(O 2 ) -? 15, 73 г Ni---х х=0, 53 экв
1 экв O 2 ---5, 6 л
0, 53 экв O 2 ---х л х=2, 99 л O 2
2, 99 л 100%
х 75% х=2, 24 л O 2
Жауабы: V(O 2 ) =2, 24 л
В-4 Берілгені: Шешуі:
S KNO3 =63, 9/100г H 2 O t 1 =40 º
S KNO3 =169/100г H 2 O 163, 9 ер-ді 63, 9 г ер. зат
m ер-ді =500г 500 г ер-ді х г ер. зат
t 1 =40 º , t 2 =80 º х=194, 94 г ер. зат(m 1 )
t 2 =80 º
т/к ∆m, m(су) -? 100 г су 169 г ер. зат
305, 06 г су х г ер. зат х=515, 55ер. зат(m 2 )
∆m=m 2 -m 1 =515, 55-194, 94=320, 6г
m(су) =500-194, 94=305, 06г
Жауабы: ∆m =320, 61г, m(су) =305, 06 г
ХИМИЯЛЫҚ ТЕПЕ-ТЕНДІК
С-1
Берілгені: Шешуі:
[PCI 5 ] =[PCI 3 ] =[CI 2 ] PCI 5 → PCI 3 + CI 2
νмоль 1 1 1
т/к Co(PCI
5
) -?
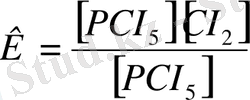 K=1
K=1
Co=2моль
Co(PCI 5 ) = [PCI 5 ] +ΔC
Реакция теңдеу бойынша ΔС=1моль/л
С-2
Берілгені: Шешуі:
Co(SO 4 ) =Co(O 2 ) =0, 05моль/л 2SO 2 + O 2 →2SO 3
[SO 4 ] =0, 01моль/л ν моль 2 1 2
1) ΔС(SO 2 ) =Co-[SO 2 ]
т/к [SO 3 ] , [O 2 ] -? ΔC(SO 2 ) =0, 05-0, 01=0, 04моль/л
2) Теңдеу бойынша 2моль SO 2 ─ 1моль O 2
0, 04моль SO 2 ─ х моль O 2
x=0, 02 моль O 2
ΔC(O 2 ) =0, 02моль/л
3) С[O 2 ] =C o - ΔC(O 2 ) =0, 05-0, 02 =0, 03 моль/л
4) 2моль SO 2 ─ 2моль SO 3 = 0, 04моль SO 2 : x моль SO 3
х=0, 04моль SO 3
Жауабы: [SO 3 ] =0, 04моль/л
O 2 ] =0, 02моль/л
С-3
Берілгені: Шешуі:
Co(NO 2 ) =0, 04моль/л 2NO 2 →2NO + O 2
56% NO 2 жұмсалды νмоль 2 2 1
t o =const
0, 04моль ÷ 100% = x моль -56%
т/к қысым өзгерісін x=0, 0224моль
Р 2 /Р 1 - ?
ΔС(NO 2 ) =0, 0224моль/л
[NO 2 ] =C o - ΔC= 0, 04 - 0, 0224=0, 0176моль
Теңдеу бойынша 2моль NO 2 ÷ 1моль О 2 =0, 0224 NO 2 : х моль О 2 х=0, 0112моль
2моль NO 2 : 2моль NO = 0, 0224моль NO 2 ÷ х моль NO
х=0, 0224моль
Тепе-теңдік орнаған кездегі газдардың зат мөлшері:
ν = ν (NO 2 ) + ν (NO) + ν (O 2 )
ν=0, 0176+0, 0224+0, 0112=0, 0512моль
 есе артады
есе артады
Жауабы: 1, 28 есе
ХИМИЯЛЫҚ РЕАКЦИЯЛАРДЫҢ ЖҮРУ ЗАҢДЫЛЫҚТАРЫ
1. Берілгені: Шешуі
V
ер-ді
(Н
2
SO
4
) = 500 мл
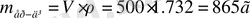
ω (Н
2
SO
4
) = 80 %
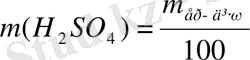
ρ = 1, 732 г/мл
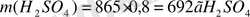
ω (NaOH) = 30%
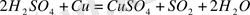
ρ = 1. 33 г/мл ν, моль 2 1
т/к: V ер-ді -? М, г/моль 98 -
m, г 196 -
V, л - 22, 4
196г (Н 2 SO 4 ) : 22, 4 л (SO 2 ) = 692 г (Н 2 SO 4 ) : Х л (SO 2 )
Х = 79. 09 л (SO 2 )
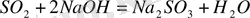
ν, моль 1 2
М, г/моль - 40
m, г - 80
V, л 22, 4 -
22, 4 л(SO 2 ) : 80 г NaOH = 79. 09 л (SO 2 ) : X г NaOH
Х = 282, 45 г
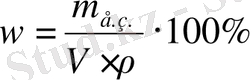

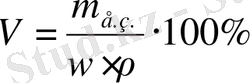

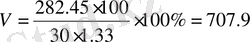
Жауабы: 707, 9 мл
2. Берілгені: Шешуі
m (көмір) = 1т C+O 2 =CO 2 +393, 5 кДж
ω (қоспа) = 20% ν, моль 1
М, г/моль 12
т/к: Q - ? m, г 12
1т көмір: 100% = Х т көмір: 80%
12г С: 393, 5 кДж = 800•10 6 г С: Х кДж
Х=26233, 3 кДж
Жауабы: Q = 26233, 3 кДж
3. Берілгені Шешуі
m (CaO) = 1 кг = 1000г СaO (қ) + H 2 O(c) = Ca(OH) 2 + Q
ν, моль 1
т/к: Q - ? m, г 56
Qp = Q түз (Ca(OH) 2 ) - [Q түз (CaO) + Q түз (H 2 O) ]
Qp = 988, 1 - [635. 2 + 286. 4] = 66. 5 кДж
56 г СаО : 66, 5 кДж = 1000 г СаО : Х кДж
Х = 1187, 5 кДж
Жауабы: 1187, 5 кДж
4. Берілгені Шешуі
Q түз (Al 2 O 3 ) = 1646 кДж 2Al + Fe 2 O 3 = Al 2 O 3 + 2Fe + 828. 8 кДж
ν, моль 2 1 1 2
т/к: Q (Fe 2 O 3 ) - ? Qp = Q түз (Al 2 O 3 ) - Q түз (Fe 2 O 3 )
Q түз (Al) = 0 Q түз (Fe) = 0
Q түз (Fe 2 O 3 ) = Q түз (Al 2 O 3 ) - Qp
Q түз (Fe 2 O 3 ) = 1646 кДж - 828, 8 кДж - 817, 2 кДж
Жауабы: 817, 2 кДж
5. Берілгені Шешуі
Vқ. ж. (NO) = 100л 2NO + O 2 = 2NO 2
ν, моль 2 2
т/к V(ауа), Q - ? V, л 44, 8 44, 8
Q түз (NO) = - 90. 24 кДж
Q түз (NO 2 ) = - 33. 33 кДж
Көлемдік қатынас заңы бойынша:
2л NO : 1л O 2 = 100 л NO : X л O 2
Х = 50 л О 2
100 л (ауа) : 20 л О 2 = Х л ауа : 50 л О 2
Х = 250 л О 2
Qp = 2Q түз (NO 2 ) - 2Q түз (NO) Qp = 2 . (-33. 33) - 2 . (-90. 24) = 48. 18 кДж
44, 8 л NO : 48. 18 кДж = 100 л NO : X кДж
Х = 107, 54 кДж
Жауабы: 250 л ауа; 107, 54 кДж
РЕАКЦИЯ ЖЫЛДАМДЫҒЫ
1. Берілгені Шешуі
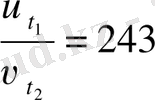
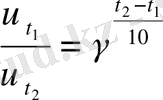 243 =
243 =
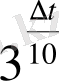
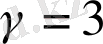 3
5
=
3
5
=
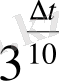 5 =
5 =
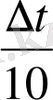 ∆t = 50
o
∆t = 50
o
Жауабы: ∆t = 50 o
2. Берілгені Шешуі
Со (NaOH) = 5 моль/л 2NaOH + H 2 SO 4 = Na 2 SO 4 + H 2 O
Со (H 2 SO 4 ) = 5 моль/л ν, моль 2 1
NaOH жұмсау дәрежесі = 20% C(NaOH) = 5 . 0. 2 = 1 моль
С τ (NaOH) = 5 - 1 = 4 моль
т/к:
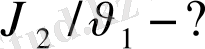
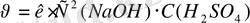
2 моль NaOH : 1 моль H 2 SO 4 =
1 моль NaOH : Х моль H 2 SO 4
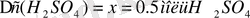
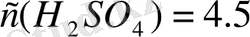
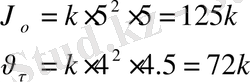
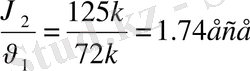
Жауабы: 1, 74 есе
3. Берілгені Шешуі
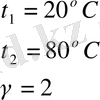


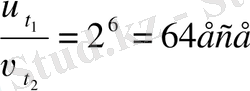
т/к
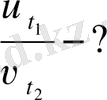 Жауабы 64 есе
Жауабы 64 есе
4. Берілгені Шешуі
P 2 = 2P 1 2CO + O 2 = 2CO 2
ν, моль 2 1 2
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz