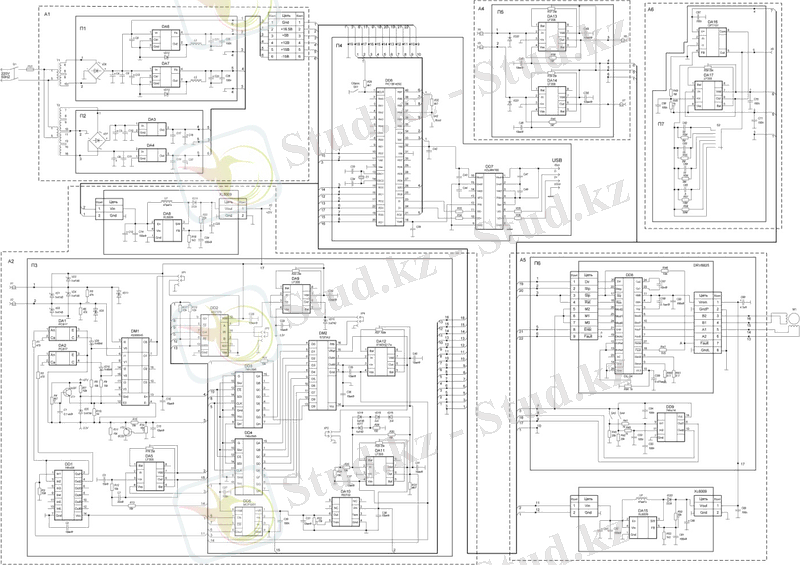
Сандық люминесценция дабылдарын тіркеу жүйесін әзірлеу және құру


Мазмұны
23
31
Кіріспе
Люминесценциялық өлшеудің екі түрі бар, импульсті және жұмыста көрсетілгендей фазамодуляциялық әдісі. Импульсті әдісінде үлгі жалғыз импульсті немесе жеткілікті қуатты жарық импульсінің артқы тізбекті сериясы сәулеленеді. Фазамодуляциялық әдісте стационарлық сәуле көзі пайдаланылады.
Импульстік әдістер кез келген өшу мәніндегі люминесценция сипатының кинетикасын зерттеуге мүмкіндік береді. Фазомодуляциялық әдістері люминесценцияның өшу мәнізаңыныңтүріналдын-ала болжауға және тек сандық параметрлерінің экспериментальды мәнінанықтайды, бұл жағдайда фаза және амплитуда мәні. Болжамды заңның дұрыстығын тексеру ерекше зерттеуді қажет етеді.
Молекулалық фосфоресценцияның кинетикалық сәулеленуі кезінде, әдетте сипатталатын өшу мәнінің уақыт диапазоны 10 -7 - 10 с, бұл мән әдетте импульстік әдістерде пайдаланылады. Флуоресценцияның 10 -12 - 10 -7 пикосекундты және наносекундты диапазонында зерттеу үшін импульсті фазамодуляциялық әдістері пайдаланады.
диагностика және жоғары технологиялық материалдар мен жаңа заттардың [1] жоғарғыфарматты тәсілдерініңбірі болып табылады. Люминесцентті әдістері тек жоғары сезімталдыққа ие және қозған молекула күйінің, фотохимиялық реакциялардың, жылдам молекулалық динамикасы процестерінің, құрылымы мен қасиеттерінің күрделі физикалық, химиялық және биологиялық сәулеленуіне мүмкіндік береді.
Люминесценция флуоресценция (бірдей мультиплетті күй арасындағы электронды көшу нәтижесінде жарық квантының сәулеленуі) және фосфоресценция (әртүрлі мультиплеттілік арасындағы сәулелену) сондай-ақ, ұзақ люминесценция (ҰЛ) деп аталады. Ұзақ люминесценцияға сондай-ақ жеке жағдайы флуоресценция - баяу флуоресценция жатады. Баяу флуоресценция тез флуоресценциядан спектральды айырмашылығы жоқ, алайда оның өшу мәндері, орта уақытты өмірі синглетті жай-күйі мен салыстыруға уақыт өте келе фосфоресценциядан айтарлықтай көп.
Люминесценттік өлшеу өшу мәнінің уақытын өлшеуге тура келеді (қозған күйінде молекуласы қалады, өзінің негізгі жағдайына оралу уақыты) . Бұл түсіндіріледі, осы ішкі және молекуларалық өтетін процестерді шамасын ауыстырғаннан кейін молекулалардың қозған күйі деректерді табуға болады. Өшу мәнінің білу өзара іс-қимыл туралы флуоресценциялаушы молекулалар, оның қоршаған ортамен және болып жатқан процестерге ішіндегі молекулалардың [2] егжей-тегжейлі ақпаратынбере алады.
Осыған байланысты, бұл ҰЛ шағын кванттық шығысты және шағын ұзақтығы объектілерді, қажет тіркеу құрылғылары жоғары сезімталдығы және уақытша рұқсат беретін қасиеттердісипаттайды. Осы таралған фотондар саны әдісі болып табылады. мұнда қолданылатын және бұдан әрі тарихи қалыптасқан "фотондар саны" термині фотокатод бірлі-жарым кванта өріске негізделген сәулелену деп болжайды. Алайда, бұл интерпретация физикалық үдерісінің мәнін фотодетекциялау өте оңайлатылған болып табылады. Бұл термин "фотондар саны" жалпыға тән болып табылады, сондықтан ол аталған жұмыс үшін белгілер әдісі тіркеу негізделген түрлендіру, жарықтың дәйектілігі электр серпінібірэлектронды фотоқабылдағыш [3] үшін пайдаланылады.
Дамытудың негізгі бағыты өлшеу техникасын зерттеуде заттардың люминесценттік қасиеттерін автоматтандыру пайдалана отырып, дербес компьютерлер (ДК) үшін пайдаланылады басқару, ақпаратты жинау және өңдеу болып табылады. Жұптастыру өлшеу құрылғыларын ДК арттырады, өлшеу дәлдігі жеңілдетеді, эксперимент жүргізуге, сондай-ақ бастапқы деректерді өңдеу [3] жүргізуге мүмкіндік береді.
Тағы бір маңызды мәселе автоматтандыру процесібөліктерін сапалы, функционалдық қамтамасыз ету бағдарламалыққұру болып табылады. Бұл ретте соңғы орында қойылатын талаптар ыңғайлылығы пайдаланушы интерфейсі және жоғары жылдамдығы жазу және редакциялау бағдарламалық код тұр. Талдау кезінде алға қойылған міндеттерді шешім қабылданды, Microsoft фирмасының Visual Studio 2008 бағдарламалық әзірлеу қамтамасыз етеді.
Орнату кезінде операциялық жүйесі көптеген компоненттері орнатылған қолданбалар компоненттері белгіленетін бағдарлама ауыстырылады, бұл ретте ауыстырылатын компоненттер функционалдығын жоғалтады. Осыған жұмысы тоқтап қалғаны операциялық жүйесінің бұзылуы үйлесімділігін қосымшалар байланысты. Бұл проблема кітапхана динамикалық құрастыру әзірленген Microsoft іске асыру үшін компоненттік бағдарламалау, "Dll hell". Dll - dynamic link library деген атаумен белгілі болды.
Net ортасы құралы ұсынылған Microsoft корпорациясы, проблемаларды шешу үшін, байланысты кітапханалар динамикалық құрастыру кезінде олар ауыстырылады жинамалары . Net болған күннің өзінде өзекті болып табылады. Өрістету пакеттерін қосымшалар жеңілдігі, платформалар үйлесімділік көптеген, мүмкіндігі қондырма қосымшалар . Net арқылы құрастырулар, осы ортаға күшті құралы үшін қосымшаларды әзірлеужасайды.
Жеделдету үшін деректерді бейнелеу үшін, жұмыс терезе және түсіру орталық процессорлық құрылғы мен басқа пайдалы процестер үдеу графиктері, мысалы, кітапхана Managed DirectX үшін арнайы әзірленген қоршаған орындау уақыты . Net CLR(Common language run-time) бағдарламасы қамтамасыз пайдаланады.
Бұл жұмыстың өлшеу жүйесіңәзірлеу және құру болып табылады.
Жұмыста қойылған келесі міндеттер шешіледі:
- арна дабылдарды тіркеу люминесценциясын әзірлеу және құру;
- тіркеу құрылғылары импульс ҚЭБ әзірлеу және құру;
- (БҚ) жұмысын басқару үшін қондырғы бағдарламалық қамтамасыз ету;
-ПО пакетін құру, орнату үшін.
Зерттеу объектісі люминесценция дабылдарын өлшеу әдістері болып табылады.
Жүйе ретінде тіркеу әдісі ретінде зерттеу пәні болып табылатын дабылдарды тіркеу әдістері қолданылды.
Жобалау әдістері. Ұсынылған әдістемені жобалау, бағдарламалық қамтамасыз ету сипатталған әдебиет [4] пайдаланылды.
Ғылыми жаңалығы:
1. Сандық құрылғыны люминесценция дабылдарды тіркеу үшін әзірленді және құрылды.
2. Құрылған бағдарламалық бағдарламалар платформаға Win32өнімділігі ауыстыруды қамтамасыз ету. Net мақсатында қосымшаларды жобалау эксперименттер жүргізу үшін әзірленген модульдер үшін алдын-ала нәтижелерін өңдеу эксперименті.
Практикалық маңыздылығы. фотопроцесті молекулалық жүйелерде -құрылған сандық құрылғыны эксперименттік орнату бойынша зерделеу, Е. А. Бөкетов атындағы ҚарМУда молекулалық фотоника .
1 Органикалық молекулалардың фотоникасы
Люминесценция - сыртқы энергия көзі әсерінен денелердің жарық шығару үдерісі. Люминесценция үдерісі кезінде шыққан жарықтың жиілігі оны қоздыру жарық жиілігінен өзгеше болады. Люминесценция құбылысын жарықтың шашырауы, шағылуы және денелердің термодинамикалық тепе-теңдік күйіндегі жылулық сәуле шығаруы тәрізді құбылыстардан ажырату қажет. Денені қыздырғандағы жарық шығарудан бұл бөлек үдеріс, мұнда жылуды шығаратын жүйе энергиясы пайдаланылмайды. Сондықтан да оны "салқын жарық" деп те атайды [5] . Люминесценция электрон қоздырылған күйінен негізгі күйге ауысқанда пайда болады. Люминесценция жарығын шығарған зат кез-келген агрегатты күйде болуы мүмкін. Люминесценция бірнеше классификация бойынша бөлінеді (қоздыру әдісі, ұзақтығы және т. б. бойынша) . Мысалы, ұзақтығы бойынша фосфоросценция мен флуоресценция, қоздыру түрі бойынша фото-, радио-, катодолюминесценция және т. б.
Табиғаттағы сәуле шығару құбылыстарының кең тараған түрінің бірі - люминесцения болып табылады. Люминесценция, зат қоздыру энергиясын жұту нәтижесінде, яғни зат бөлшектерінің негізігі күйден қоздырылған электрондық күйге өтіп, негізгі күйге қайтып оралып жарық квантын шығару нәтижесінде пайда болады.
Молекуланың электрондық күйі өзгергенде, әдетте, оның тербелмелі-айналмалы күйлері де өзгереді. Нәтижесінде, люминесценция кванттары - молекуланың электрондық өтулерінің кванттары мен тербелмелі және айналмалы күйінің өзгеруінің кванттары комбинациясын құрайды.
Органикалық бояғыштардың молекулалары қанықпаған көмірсутегінің бір немесе екі байланысы (түйісу тізбегі) түрінде болады. Жұту жолағының орналасуы және электрондық көшу қимасы хромоформен анықталады. Бояғыш молекулалардың қос байланысын қалыптастыруда π және σ - электрондары қатысады. σ - электрондардың толқындық функциялар байланысы байланыс бағытына қатысты айналмалы симметриялық болып, ал π - электрондардың толқындық функциялары байланыс перпендикуляр байланыс бағытына және ядро түйініне қатысты айналмалы симметриялық болып табылады. π - байланыстағы атомдардың энергиясының көпшілігі симметрия орбиталарда π - электрондар осінің параллель орналасуына сәйкес келеді. π -байланысының ең жоғары беріктігі және молекуланың ең төменгі еркін энергиясы түйісу тізбегінің тегіс құрылымында орындалады. π- электрондардың анағұрлым жоғары тығыздығы тізбектер жазықтығына симметриялы жоғары және төмен орналасқан. Тізбекті түйіндес байланыстары бар органикалық молекулалар, олардың кристалдары мен ерітінділерінің қарқынды боялуына әкелетін оптикалық өтулер қимасының (σ ~ 10 -16 см 2 ) үлкен шамасына ие.
Молекула жарық жұту кезінде оның энергиясы жұтылған фотон энергиясы hv сәйкес артады. Кванттық теорияға сәйкес жүйенің энергиясы оның ішкі қасиеттерімен анықталады. Бояғыш молекулаларының күрделі құрылымы энергетикалық күйлердің әр түрлілігіне әкеледі. Квант энергиясының жұтылуы кезінде әрбір молекула төмен энергетикалық деңгейден жоғары деңгейге өте алады. Молекуланың толық энергиясы Е электрондық энергия Е эл , тербелістік Етер және айналмалы энергиялардың қосындысымен анықталады Е айн :
Е=Е эл + Е тер + Е айн (1)
Молекулалардың энергетикалық күйлерін қатаң түрде қарастырған кезде электронды-тербелмелі, электронды-айналмалы және тербелмелі-айналмалы энергияларын ескеру қажет.
1. 1 Люминесценцияның түрлері
Люминесценция - тепе-теңдіксіз үдеріс, себебі молекула жарық шығарғаннан кейін ұзақ уақыт бойы өзінің қозбаған күйін сақтау мүмкін (немесе молекула қайтадан қозуы мүмкін), яғни молекула жарқырауы мен сыртқы сәулелену өрісі арасындағы тепе-тендікті жалпы жағдайда болжауға болмайды [6] .
Нақты жағдайда когерентсіз сәулелену арқылы бір-бірінен тәуелсіз жарық шығаратын молекулалардың үлкен санының бір мезгілде сәулеленуі байқалады. Сонымен қатар, люминесценцияның жарықтың шашырау құбылысынан айырмашылығы - энергияның жұтылуы - сол энергияның жарық шығаруынан пайда болады.
Органикалық және бейорганикалық заттардың көп саны люминесцентік қабілетіне ие және қасиеттері бірдей болмауы мүмкін [7] . Осы айырмашылықтар люминесценция құбылысының классификациясының қажеттілігін тудырады.
Бірінші классификацияға сәулелену үдерісінің ұзақтығы жатады. Мұндай классификацияның нәтижесінде люминесценция үлкен екі класқа бөлінеді: флуоресценция және фосфоресценция. Флуоресценция қоздырылған жарық импульсімен қатар сөнетін сәулелену (~10 ˉ9 с) ; фосфоресценция қоздырылған жарық өшкеннен кейін байқалатын үдеріс (10 ˉ6 с) [7] .
Екінші классификация бойынша, люминесценция қоздыру әдісінің түрлеріне бөлінген. Жарық фотондарымен қоздыру - фотолюминесценция деп аталды. Электрондық сәулелермен қоздырылған сәулелену - катодолюминесценция деп аталды. Радиолюминесценция радиоактивті ыдырау нәтижесінде пайда болады. Электр өрісімен қоздырылатын сәулелену - электролюминесценция деп аталады. Люминесценцияның басқа түрлері де болады. Ол хемилюминесценция, химиялық реакция нәтижесіндегі сәулелену. Қазіргі уақытта электролюминесценция жақсы дамуда.
Үшінші классификация, С. И. Вавилов ұсынуымен, люминесценцияның кинетикасы бойынша резонанстық, өздігінен, мәжбүрленген және рекомбинациялық болып бөлінеді [8] .
Резонанстық флуоресценция деп, сәулелену фотондарының энергиясы жұтылған фотондар энергиясына тең кездегі жағдай аталады. Резонанстық флуоресценция булар мен газдардың атомдарында және қарапайым моле-кулаларда байқалады. Резонанстық флуоресценция негізінде атомдық флуоресценция құбылысы жатыр.
Өздігінен люминесценция құбылысында қоздырылғаннан кейін молекула Е 0 қозбаған деңгейден Е 1 жоғары қозған электрондық деңгейге өтеді, содан молекула сәулеленбей төмен Е 2 қозған деңгейге өтеді (1. 1-сурет) . Негізгі Е 0 деңгейге жарық кванттын шығарып өтеді. Өздігінен люминесценцияда шығарылған квант энергиясы жұтылған квант энергиясынан кіші болады. Өздігінен болатын люминесценция газда және күрделі молекула ерітінділерінде, молекулалық кристалдарда, сонымен қатар, қоспалық қатты заттарда байқалады.
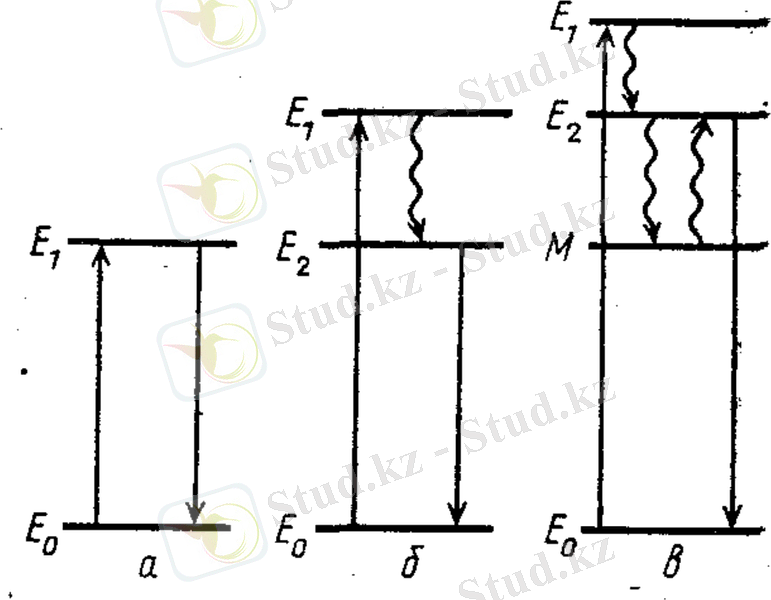
1. 1-сурет. Люминесценция түрлері: а) атомдық; б) өздігінен; в) мәжбүрленген [8]
Резонансты және өздігінен люминесценция кезінде молекулалардың қозған күйден негізгі күйге өту ықтималдылығы температураға тәуелсіз және оның ішкі қасиеттерімен анықталады.
Мәжбүрленген люминесценция күрделі жолмен өтеді. Мәжбүрленген люминесценцияның негізі атомдық жүйелердегі (атомдарда, иондарда, молекулаларда) кванттық өтулер кезінде пайда болатын еріксіз сәуле шығару құбылысына негізделген. Оның сұлбасында Е 0 , Е 1 , Е 2 деңгейлерінен басқа М метатұрақты деңгейі қосылған және осы денгейден Е 0 деңгейіне тікелей өтуге тиым салынған. Молекула Е 0 деңгейден Е 1 деңгейге өтеді де, сәулеленусіз Е 2 деңгейге өтуі мүмкін, содан М деңгейге өтеді. М денгейде молекуланың люминесценциясы температураға тәуелді болады. Люминесценцияның осы түрі төмен температураларда және сұйық ортадағы күрделі органикалық молекулаларда тіркеледі.
Өздігінен және мәжбүрленген люминесценция, көбінесе, молекулалық жүйені сипаттайды. Сондықтан сәулеленудің мұндай түрлері молекулалық люминесценция түсінігі бойынша біріктіріледі. Рекомбинациялық люминесценцияның сипаттамалары күрделі. Екі кері таңбалы зарядталған молекула бөліктерінің қосылуы кезінде байқалады. Рекомбинациялық люминесценция газдарда радикалдар мен иондардың рекомбинация үдерісі нәтижесінде қозған күйде молекула пайда болуымен іске асырылады. Рекомбинациялық люминесценция кристаллофосфорларда жиі кездеседі.
1. 2 Энергия деңгейлерінің диаграммасы
Молекулалар жарық квантын жұтқаннан кейін, кванттық энергияны күрделі түрлендіру үдерісі жүзеге асады. Яблонскийдің деңгейлер диаграммасын күрделі молекулалардың энергетикалық күйлер диаграммасы деп қарастыруға болады [9] . 4-суретте фотонды жұту нәтижесінде пайда болатын, әр түрлі молекулаішілік өтулердің сұлбасы көрсетілген. Берілген электрондық өтулерге қатысатын молекулалық орбитальдардың (МО) электрондық конфигурациясы энергетикалық деңгейлердің жанындағы тіктөрт-бұрыштарда көрсетілген.
Күрделі органикалық молекулалар диамагнитті және олардың негізгі электрондық күйі - синглетті S 0 (спиндері жұп) . Суретте бірэлектронды қоздыру көрсетілген, онда электроның біреуі төменгі МО қалады да, екінші электрон жоғарғы бос МО-ға өтеді. Молекула қозған күйде триплетті деңгейлер жүйесіне ие, ол Т j деп белгіленеді [10] . Мұндай күйде екі электрон параллель бағытталған спиндерге ие болады. Триплетті деңгейлер, синглетті деңгейлермен салыстырғанда төмен орналасады [11] . Бірдей спиндік мультиплеттігі бар күйлер арасындағы сәулелену - флуоресценция деп, ал спиндік мультиплеттігі әр түрлі күйлер арасындағы өтулер - фосфоресценция деп аталады.
Егер молекула жарық квантын жұтып S j қозған деңгейлердің біреуіне өтсе, онда ол негізгі күйге екі жолмен қайтып оралады: сәулеленусіз өту және жарықтың квантын шығару жолымен. Сәулеленусіз өтулердің мысалы ретінде, ішкі жаңғырту, тербелмелі релаксация, интеркомбинациялық жаңғырту құбылыстарын айтуға болады.
Ішкі жаңғырту - мультиплеттігі бірдей екі әр түрлі электрондық күйлердің арасындағы сәулеленусіз өту үдерісін айтады. Молекула жарық квантын жұтып S
2
қозған электрондық күйге өткен жағдайын қарастырайық. S
2
 S
1
сәулеленусіз өтудің механизмі, S
1
күйдің жоғарғы тербелмелі деңгейлерімен S
2
күйдің төменгі тербелмелі деңгейлерінің қабаттасуымен (энергиясы бойынша) түсіндіріледі. Жоғарғы S
2
және төменгі S
1
электрондық күйлердің потенциалдық беттері қиылысқанда, τ<10
-12
с уақыт ішінде ішкі жаңғырту құбылысы іске асырылады.
S
1
сәулеленусіз өтудің механизмі, S
1
күйдің жоғарғы тербелмелі деңгейлерімен S
2
күйдің төменгі тербелмелі деңгейлерінің қабаттасуымен (энергиясы бойынша) түсіндіріледі. Жоғарғы S
2
және төменгі S
1
электрондық күйлердің потенциалдық беттері қиылысқанда, τ<10
-12
с уақыт ішінде ішкі жаңғырту құбылысы іске асырылады.
Ішкі жаңғыртудың жылдамдығы, тербелмелі толқындық функциялардың қабаттасуына тәуелді болатынын және оның электрондық күйлердің арасындағы энергетикалық аралығы өскен сайын азаятынын айта кеткен жөн. Ішкі жаңғырту үдерісі өткен соң, молекуланың артық тербелмелі энергиясының алмасуы іске асырылады. Себебі, көпатомды молекулаларда тербелістердің жеке модалары арасында өзара әсерлесулері өте үлкен. Бұдан көпатомды молекулалардың жұтылу және сәуле шығару спектрлерінің тұтас сипатқа ие екендігінен көруге болады (1. 2-сурет) . Тербелмелі релаксацияның уақыты t рел <10 -12 с құрайды.

1. 2-сурет. Қозбаған, жұп электронды органикалық молекулалардың төменгі энергетикалық деңгейлерінің жалпы сұлбасы [11]
Сонымен, басында S 2 деңгейге дейін қоздырылған молекула, сәулеленусіз өтулер арқылы бірінші қозған электрондық деңгейге S 1 оралады. Бұл деңгейден молекула S 0 негізгі күйге сәулеленусіз өтуі мүмкін немесе интеркомбинациялық жаңғырту құбылысы арқылы триплетті күйге өтуі мүмкін немесе флуоресценция квантын шығарады. Осы үш құбылыстың өзара бәсекесін қарастырайық.
Флуоресценцияны шығаратын қосындыларда S 1 →S 0 өтулерінің жылдамдығы S 2 →S 1 жылдамдығымен салыстырғанда баяу жүреді. Бұл, электрондық деңгейлердің номері азайған сайын, екі жақын орналасқан электрондық күйлердің арасындағы энергетикалық арақашықтықтың артуымен түсіндіріледі [12] . Сонымен бірге, екі күйдің тербелмелі деңгейлерінің қабаттасуы да азаяды. Сондықтан сәулеленусіз өтудің жылдамдығы баяулайды және флуоресценцияның өмір сүру уақытымен бірдей реттілікке келеді.
Интеркомбинациялық жаңғырту - бұл синглеттік (триплеттік) электрондық күйден триплетті (синглетті) электрондық күйге сәулеленусіз өту үдерісі. Сәулеленудің қарапайым шарттарында, органикалық молекулалардың триплетті күйлерінің қоныстануына осы үдеріс жауапты. Қоздыратын жарықтың қарқындылығы үлкен болғанда (лазерлік толтыру) S 0 →Т 1 өтулері байқалуы мүмкін, бірақ S 0 →Т 1 өтудің экстинкция коэффициенті өте аз. Коши ережесі бойынша қалыпты жағдайда электрон спинінің жаңғыртылуы (спиннің бұрылуы) 10 -6 с уақыт аралығында жүзеге асады. Бұл дегеніміз, 1000 қоздырылған молекуланың ішінен, біреуі ғана триплетті күйге өту арқылы, интеркомбинациялық жаңғырту құбылысына ұшырайды. Сонымен бірге, молекуланың магнитті спин-орбиталдық өзара әрекеттесулердің күшеюі, интеркомбинациялық өтулер және флуоресценцияның сәуле шығару үдерістері араларындағы бәсекелестікке немесе флуоресценцияның толық өшуіне әкеледі.
1. 3 Флуоресценцияның негізгі заңдары
Флуоресценция спектрі - зат шығарған жарықтың толқын ұзындығына (толқындық санына немесе жиіліктеріне) тәуелділігін айтамыз.
Люминесценцияның қоздыру спектрі деп, заттың шығарған энергиясының қоздыру толқын ұзындығына (толқындық санына немесе жиілігіне) тәуелділігін айтамыз.
Люминесценция спектрінің қозған жарықтың толқын ұзындығына тәуелсіздігі. Вавилов заңы . Молекулалардың сұйықтың конденсацияланған орталарында фотолюминесценция спектрлері қоздыру жарығының толқын ұзындығына тәуелсіз. Яғни, флуоресценцияның сәуле шығаруы, әрқашанда, төменгі электрондық-тербелмелі деңгейлерден байқалауы арқылы түсіндіріледі [13] .
Көпатомды молекулалардың электронды жұтылу спектрлері кең сызықтардың топтамасы болып табылады. Сондықтан зерттелетін заттың флуоресценциясын жұтылу спектрінің кез-келген бөлігімен қоздыруға болады.
Молекулаларды жұтылу жолағындағы жарықпен қоздыру кезінде, молекулалар жоғары электронды деңгейдің әр түрлі тербелмелі денгейлерін қоныстайды. Әр түрлі жұтылу жолақтарында қоздыру кезінде молекула әр түрлі электронды денгейлерге өтеді (1. 3-сурет) .

1. 3-сурет. Вавилов заңы
Екі жағдайда да люминесценция спектрінің қозған жарықтың толқын ұзындығына тәуелділігі байқалуы керек [14] . Бірақ, тәжірибе бұл болжамды растамайды. Тәжірибедегі байқалған шығару спектрінің орналасуы және пішінінің қоздыру толқын ұзындығына тәуелсіздігі - күрделі молекулалар флуоресценциясының механизмін түсінуге жол береді.
Жарықтың үлкен кванттарымен қоздырғанда молекулалар S 0 күйден S 2 , S 3 және басқа күйлерге өтеді. Осы барлық күйлерден өткенде флуоресценцияның спектрі өзгеріссіз болуына байланысты, сәулеленіп өтулер бір ғана деңгейден байқалады деп есептеуге болады. Мұндай деңгей ретінде сұлбада S 1 деңгейі көрсетілген.
Бұл үдерісте қоздыру энергиясының артық мөлшері тербелмелі энергияға айналады. Суретте S 2 → S 1 және S 3 → S 1 өтулер сәулеленусіз (толқындық белгілерімен) жүзеге асады. Себебі, S 2 және S 3 күйлерін қоздыру кезінде жаңа сәулелену сызығы байқалмайды. Осындай өту уақыты өте аз ~10 ˉ12 - 10 ˉ13 с.
Флуоресценцияның сәуле шығару жолақтарының пайда болуы - жұтылу жолақтарының пайда болуына ұқсас. Қозған күйдегі лезде болатын тербелмелі релаксация, барлық молекулаларды S 1 күйдің төменгі тербелмелі деңгейлеріне шоғырландырады. S 1 →S 0 өтулерде осы деңгейлер бастапқы деңгейлер болып табылады.
Өтулер ықтималдылығы тербелмелі толқындық функциялардың, күй тығыздықтарының және т. б. қабаттасуларының күрделі функциясы болып табылады. Сәулеленіп өтулер үшін Эйнштейннің интегралдық коэффициенті мына қатынас арқылы анықталады:
 (2)
(2)
мұндағы
 - жеке электрондық-тербелмелі өтулердің ықтималдылығы (өлшем бірлігі с
-1
),
- жеке электрондық-тербелмелі өтулердің ықтималдылығы (өлшем бірлігі с
-1
),
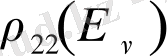 және
және
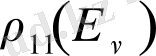 - күйлердің тығыздығы,
- күйлердің тығыздығы,
 - электрондардың қозған күйінің тербелмелі деңгейлері бойынша таралуы. Флуоресценциялық деңгейдің сәуле шығаруының өмір сүру уақыты мынаған тең
- электрондардың қозған күйінің тербелмелі деңгейлері бойынша таралуы. Флуоресценциялық деңгейдің сәуле шығаруының өмір сүру уақыты мынаған тең
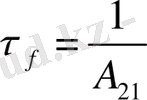 (өлшем бірлігі секунда) . Мұнда сәулеленусіз өтулер ескерілмейді. Қоздырылғаннан кейін, синглеттік күйдің сәулелену дезактивациясының негізгі кинетикалық теңдеуі, формальды кинетика теңдеулері негізінде былай жазылады:
(өлшем бірлігі секунда) . Мұнда сәулеленусіз өтулер ескерілмейді. Қоздырылғаннан кейін, синглеттік күйдің сәулелену дезактивациясының негізгі кинетикалық теңдеуі, формальды кинетика теңдеулері негізінде былай жазылады:
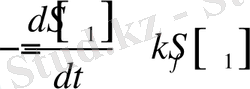 (3)
(3)
мұндағы:
 - синглетті күйге қозған молекулалардың концентрациясы,
- синглетті күйге қозған молекулалардың концентрациясы,
 - флуоресценцияны шығарудың мономолекулалық үдерісінің жылдамдық тұрақтысы.
- флуоресценцияны шығарудың мономолекулалық үдерісінің жылдамдық тұрақтысы.
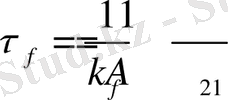 - флуоресценцияның шығу уақыты;
- флуоресценцияның шығу уақыты;
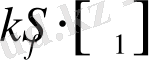 - өту жылдамдығы.
- өту жылдамдығы.
Стокс-Ломмель заңы . Молекулалық люминесценцияның маңызды заңдылығы - жұтылу спектрі мен люминесценцияның өзара бірдей орналасуы. Қоздырушы жарық жиілігі әрқашан люминесценция жиілігіне тең немесе үлкен.
Көп уақыт бойы бұл тәуелділік Стокс ережесімен сипатталады деп есептеліп келді.
Жарықтың молекуламен жұтылуы және шығарылуы кезінде электронды және тербелмелі энергияларының өзгеруі байқалады. Сондықтан люминесценция және қоздыру жиіліктері молекуланың энергиясымен анықталады.
Стокс: заттың фотолюминесценция спектрі жұтылған жарықтың спектріне қарағанда ұзын толқындар аумағына ығысқан, яғни hν ж >hν f.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz