Көміртек элементі: аллотроптары, химиялық-құрылымдық қасиеттері және өнеркәсіптік қолданылуы


Мазмұны.
Кіріспе . . . 1
- бөлімБүкіл тірі организмнің негізі - көміртек . . . 2Әлемдегі әсемдік бұйым ретінде танымал, табиғаттағы ең қатты зат- алмас . . . 9
1. 3 графиттің түрлері мен өнеркәсіпте қолдануы . . . 11
1. 4 графиттің алынуы . . . 12
1. 5 графит пен алмастың ұқсастығы мен айырмашылығы . . . 13
1. 6 көміртектің химиялық- физикалық қасиеті . . . 14
1. 7 табиғи қосылыстарда көміртектің ерекшелігі . . . 15
қорытынды . . . 24
1, 8 пайдаланылған әдебиеттер . . . 25
Кіріспе
көміртек өте көп тараған элементтер қатарына жатпайды,
дегенімен оның маңызы ерекше, себебі: көміртектің қосылыстары бүкіл тірі органимніің негізі болып табылады.
сонымен қатар, көміртек ыдырауының нәтижесінде өнеркә-сіпте кеңінен таралған тас көмір, мұнай және минералдардың
құрамында көптеп кездеседі.
көміртегінің екі аллотропиялық түрі бар: алмас пен графит
алмас-дүние жүзіндегі нарықтық сұранысқа байланысты
зергерлік бұйым ретінде қолдануда, дегенімен өнеркәсіптерде
кеңінен қолданыс тауып келеді.
1бөлім
1, 1
көміртек системасының -(carboneum), с, -менделеевтің периодты
4 тобындағы химиялық элемент, реттік нөмірі 6, атом массасы
12, 01115
көміртек өте көп тараған элементтер қатарына жатпайды.
бірақ оның маңызы ерекше, өйткені оның қосылыстары бүкіл
тірі организмнің негізі болып табылады.
көміртек жаратылыста дербес күйде, әрі толып жатқан әр түрлі
қосылыстардың құрамында болады.
сонымен қатар, көміртек ыдырауының нәтижесінде жаралған тас көмір, мұнай және т. б органикалық заттардың, сонымен қатар аноргатикалық заттар да, көпшілік минералдардың құрамында болады. ондай минералдар- жер бетінің әр жерінде тау-тау болып, жиналып кездесетін кальцит-caco3 (әктас, мрамор, бор түрлерінде) және ма гнезит mgcо3 пен доломит сасо3, mgco3 көміртек көміртек диоксиді түрінде жер шарын айнала қоршаған атмосферада және табиғи сулардың барлығында еріген күйде болад. көмітектің табиғатта тұрақты екі изотопы бар:с(98. 892%) және c(1. 108%) космос сәулелерінің әсерінен в радиоктивті изо топтары бар. с14 түзіледі мұнан басқа массасы 10-нан 16-ға
дейінгі радиоктивтігі изотоптары бар.
көміртектің екі аллотропиялық түрі бар: алмас және
графит, сондай-ақ амофты көміртек (күйу көмір) түрінде
болады. аморфты көміртек реакцияға оңай түседі.
қыздырғанда оттекпен әрекеттесіп көміртек қос тотығын со2, оттек жеткіліксіз болса, көміртек тотығын
со түзеді.
Көміртектің қос тотығы
Көміртек қос тотығы, көмір ангидріді, көмірқышқыл газ,
со2-көміртектің оттекпен қосылысы. көміртек тотығымен жанғанда түзіледі, түссіз, қышқылтым дәмі және иісі бар, ауыр газ. тығыздығы 1, 9768гр литр( 0с және 1атом) қалыпты температурада 58, 46 атом қысымда сұйылады, оның тығыздығы 0, 771 кг/ л. газ күйінде суда және кейбір органикалық еріткіштерде ериді. сұйық көміртек қос тотығы қатты суығанда қар сияқты массаға айналады,
оны құрғақ мұз дейді. сумен әрекеттескенде көмірқышқыл түзіледі к. қ. т. қызуға төзімді. тек 2000с -тан астам температурада ғана көміртек тотығымен оттек түзе ыдырайды химиялық активтігі төмен күшті негіздермен көмірқышқылының ангидриді ретінде әрекеттесіп, карбонанттар түзеді. к. қ. т. фотосинтез процесінде маңызы зор, ол организмде зат алмасу нәтижесінде түзілетін басты өнімдердің түрі. лаборатория
к. қ. т-н кибб аппаратында мәрмәрді тұз қышқылымен ыдыратып алады. өнеркәсіптн оны әктасты не борды өртеу арқылы алады. сасо3 сао+со2-42520 кал
бұдан шыққан к. қ. т-н арнайы әдістерімен тазартады. к. қ. т-н негізінде тамақ (қант, сыра т. б) өнеркәсібінде құрғақ тұз, тағамдарды консервілеу үшін, өрт сөндіруде, химия өнеркәсібінде сода өндіруде қолданады.
көміртек галогендерімен cf4, ccl4, cbr4 cj4 қосылыстарын түзеді маңыздысы-төрт хлорлы қөміртек.
(тетрахлорметан) ссl4 ол ауа, жарық, концентрациялы
күкірт қышқылы т. б әсеріне төзімді. қалыпты тем-да темір, аллюминийқатысында сумен әрекеттеседі. ccl4+2h2o co2+4hcl-төрт хлорлы көміртекті
қосып қыздырғанда тиісті көміртегі алынады.
денсаулыққа зиянды, оның ауадағы конц 0, 02 мг/л-ден аспауы керек. - түссіз, иіссіз газ, суда нашар ериді. cbr және cs4 кристалл заттар.
көміртек тотығы- иіс газы, со, - көміртектің оттекпен қосылысы. иіссіз, түссіз, улы газ. қайнау тем. -191, 5 с, бауқу тем-205с, суда нашар(0 с гр-тан 100 көлем, суда 3, 3
көлем) спиртте жақсы ериді. оның 12, 5-74%-тік ауамен қоспасы
өздігінен тұтынады. жоғары тем-да катализатор қатысында ауада көкшіл жалын шығара жанып, көміртек қос тотығы түзеді
ккал/моль жылу бөлінеді.
хлормен. де реакцияға түсіп, фосген сасl2 газы түзіледі.
көміртек тотығы көптеген заттарды алуда тотықсыздандырғыш ретінде қолданылып, тотықтарынан бос күйіндегі металдар (co cu fe pb mn ar ni sn) алынады. өндірісте к. т -да жоғары тем-да қатты қызған тас көмір үстінен қышқыл газын өткізу арқылы алынады. со+с= 2со лаб-да ол 100-тем дейін қыздырылған концентрациялы күкірт қышқылына құрмысқа қышқылы мен әсер ету арқылы алынады. нсоон=со+н2о. бұдан бөлінген суды күкірт қышқылы өзіне сіңіреді. к. т-органикалық синтез өнеркәсібінің негізі шикі затының
бірі мыс. одан ароматты альдегидтер, фщрмамид, жасанды метил спирті, жасанды жанар май, т. б өте қажетті заттар алынады. к. т-тыныс алғанда қандағы оттекті ығыстырып, карбокси - гемоглабин түзіліп, организмді уландырады. организмнің уланып қалмауы
үшін өндірістегі және бөлмедегі к. т-ның мөлшері 0, 03 мг/л*ден аспауы керек. ауаға хлорлы палладий ерітіндісімен
әсер ету арқылы к. т мөлшерін анықтайды. иіс тигенде дәрігер келгенше адамды таза ауаға шығару, оттекпен тыныс алдыру,
жүрек қызметін күшейтетін дәрі беру, тәтті шәй ішкізу керек.
көміртектің көміртек балқыған металдарда мыс. теимр, никель, платинада ериді, ол металды сақындатқанда графит түрінде бөлініп шығады
химиялық жағынан көміртек кәдімгі жағдайда инертті зат
бірақ жоғары тем-да химиялық активтеніп, металдардың да,
бейметалдардың да, көпшілігімен реакцияласады. көміртек әсіресе оттекпен жақсы қосылады сондықтан оны
тотықсыздандырғыш ретінде қолданады.
қатты заттардың сыртқы бетімен газ, бу және еріген заттарды сіңіре алу қабілетін --адсорбция дейміз.
1785 ж россия академигі т. е. ловиц көмірдің еріген заттарды адсорбциялайтындығын алғаш ашып, оны этил спиртін тазалауға пайдаланған.
адсорбциялық өрістің күші адсорбциялаушы
заттың табиғатына, оның бетіндегі бөлшектердің арала
суына тәуелді. сондай-ақ адсорбциялағыштық қабілет,
адсорбциялаушы беттің аумағына да тәуелді.
адсорбцияланып қонған бөлшек қозғалмайтындай болып бекімейді., үнемі тербелісте болады. кейбіреулері
үзіліп кетеді, оның орнына басқасы адсорбцияланады.
ақтығында адсорбциялық тепе-теңдік туады, демек келісімді мерзім ішінде адсорбциялағыштық беті қанша
бөлшек үзіліп шығады 131-сурет байқауға болады.
бұл тепе-теңдікте концентрация және температура
ле шателье приципі бойынша әсер етеді.
ле шателье -браун принципі
тепе-теңдіктің ығысу приципі-жүйені термодинамикалық тепе-теңдік күйден ауытқытатын
сыртқы әсердің салдарынан сол жүйеде осы әсерді
әлсірететін процестер пайда болады деп тұжырымдайтын принцип. мыс. тепе-теңдік күйде тұрған
жүйені қыздыру кезінде жүйеде жылудың жұтылуымен,
ал суыту кезінде жүйеде жылудың бөлінуімен қабаттаса
өтетін өзгерістер мыс. химиялық реакция болады.
қысымның артуы кезінде тепе-теңдіктің ығысуы жүйнің жалпы көлемінің кемуімен, ал қысымның кемуі
көлемнің өсуімен қабаттаса жүреді.
тепе-теңдіктің ығысу принципінің температураға тәуелді болатындығын голлардия химигі я. вант. гофф
айтқан 1884 ж ал, оның жалпы түрдегі тұжырымын
француз ғалымы а. ле . шателье айтқан 1884 ж термоди-
намикалық түрдегі дәлелін неміс ғалымы к. браун 1887 ж
келтірген. ле. шателье - браун принципі термодинамикалық тепе-теңдіктің жалпы шартынан энтропиялық мах мәнінің болуы қорытылып шығарылады. бұл прицип термодинамикалық жүйе
тепе-теңдігінің ығысу бағытын тепе-теңдік шартын жан-жақты талдамай-ақ анықтауға мүмкіндік береді.
адсорбциялық процестердің сырын ашуға н. а. щилов
в. г. хлопин еңбектері көп жәрдем етті.
хлопин. виталий григорьевич-совет химигі ссср ға-ның
академигі соц. еңбек ері рсфср-дің еңбек сіңірген ғалым және тех
қайраткері. хлопин платина тобына жататын металдардың аноргатик, аналитик, химиясын зерттеді. ссср-де алғаш радий
завщдын салуды ұйымдастырып сол заводта алғаш алған және
радиэлементтер химиясы, геохимиясы жөнінде көптеген жұмыстар ұйымдастырылды. қатты және сұйық фазалар арасында микрокрмпоненттің таралу заңдылығын анықтады.
оны хлопин заңы деп атайды.
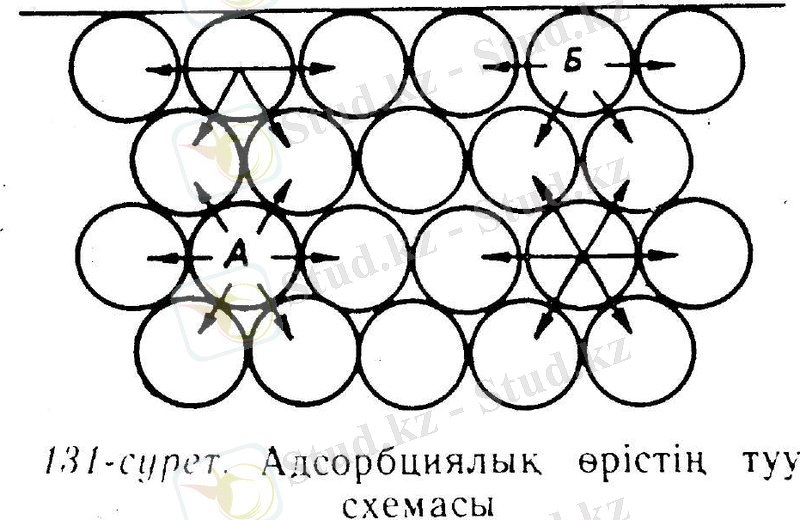
әрбір қатты заттың бөлшектері ( молекула, атом, ион) белгілі тәртіппен рналасатындығын білеміз. заттың сыртқы беткісіндегі бөлшектері ішкі қабатындағы бөлшектерден басқа жағдайда болады. ішкі бөлшектегі (а) басқа бөлшектер жан-жағынан бірдей қоршап тұр. ол бөлшектің басқа бөлшектерді өзіне тарту күші көрші сондай күшімен кездесіп бірін-бірі теңестіреді. ал сыртқы қабаттағы бөлшектің(б) сыртқы бет жағында көрші бөлшектер жоқ болғандықтан, оның тарту күшінің бірсыпырысы бос тұр. әрбір заттың сыртқы бетінде бос тұрған тарту күші тұрады, міне сол күш адсорбциялық өріс туғызады, сондықтан сыртқы бетке жанасқан газ, бу және еріген заттың бөлшектері оған тартылып адсорбцияланады. адсорбциялық өрістің күші ад-шы
заттың табиғатына, оның бетіндегі бөлшектеріне тәуелді.
1, 2 алмас
алмас( грек adamas -бұзылмас, жеңілмес )
минерал көміртектің с кристал түрі, табиғаттағы ең қатты зат- алмас кубтың сингонияда кристалданады.
куб, октааэдр, рембододекаэдр,, тетраэдр, сондай-ақ
олардың араласқан түрінде кездеседі. сапасына және
нарықтық сұранысқа байланысты алмас кристалдары\ зергерлік алмас және техникалық алмас болып ажыратылады.
зергерлік алмас-мөлдір, ақаусыз( қуыссыз, жарықшасыз қоспасыз ) аса берік болуы шарт. өйткені
ол әсемдік бұйымы болуымен бірге капитал сақтаудың сенімді тәсілі
техникалық алмас -ұнтақ немесе тиісті пішінге
келтірілген кристалдар түрінде қолданылады.
1990 ж және 1995 ж дүние жүзінде1 100 млн карат алмас
өндірілді. оның ішіндегі жоғары сапалық зергерлік
алмастық үлесі 15 % жартылай асыл түрі 40% абразивтер ретінде қолданылатын техникалық алмастың 45 %-і болды. жылдық тұтынудың үнемі 10% -ке өсіп отыруына
байланысты. 20-шы ғасырдың 50-ші жылынан бастап жасанды (синтетикалық) алмас өндірісі жылына 250 млн
карат жолға қойылған. алмастың ірі кендері
оңтүстік африкада, австралияда, индияда, бразилияда,
ресейде саха-якутия орналасқан.
қазақстанда ірі құмдыкөл алмас кент зерттеліп, өндіріске қосуға дайындалған 1997 ж ондағы техникалық алмастың 1 т кентастағы орташа мөлшері
23 карат . алмастың судағы ерітіндісімен киімдерді, заттарды және емхана бөлмелерін залалсыздандырады.
халық мед-да тері ауруын мерезді емдейтін дәрі ретінде
қолданылады.
табиғаииа кездесетін алмас түйіршіктерінің салмағы әдетте
0, 1-1, 0 караттан аспайды. салмағы 100 караттан / 20 г астам ірі
кристалды өте сирек кездеседі. және оларға жеке ат беріледі.
мыс. . оңтүстік африкада 1905 ж табылған дүние жүзіндегі ең
ірі **куллинан** алмасының кристалының массасы3106 карат
/621, 2 г/ болған. кейін одан әр түрлі пішімді 105 бриллиант алынды.
алмастың меншікті салмағы 3, 5-4, 0 г/см3 алмас морт сынады,
сынған жері бұдыр келеді, электр тоғын нашар өткізеді.
түссіз, ақ, сары қызыл, жасыл болып келеді. алмас түсінің
әр түрлі болып келуінің себебі. . құрамындағы қоспалар 15 процент
дейін (si al ca mg co cr fe ) т. б байланысты. бұлардан басқа құрамында( оливин, пироксен гранаттар хромшпенелидтер, графит, кварц, feo) сұйық су, газ, азот т. б күйіндегі қоспалар да болады. алмас қышқылдар мен сілтілердің ерітіндісінің әсеріне
берік, селитра мен соданың қоспасында 500 с гр-та ериді. ауада 850-1000с-та 15-20 мин-тай түгелдей графитке айналады. графит немесе
көмір сияқты жұмсақ тектестермен салыстырғандағы алмасты
орасан қаттылығына оны құрайтын көміртек атомдары арасындағы өте берік ковалентті байланыс себепші. алмас үлкен
тереңдікте, жоғарғы мантия, аумағындағы зор температура мен
қысым әсерінен пайда болады. ол қопарылыс түтіктерін толтыратын кемберлит құрамында кездеседі.
басқаша айтқанда қопарылыс, түтіктері алмас кендерін іздестірудің негізгі сілтемесі болып табылады.
1, 3 графит
графит-( гр: grapho-жазамын ) минерал, көміртектің жер қыртысында
ең жиі кездесетін, әрі тұрақты гексодондық полиморфтық түрі
гексогональдік сингонияда кристалданады
табиғатта кристалы жетілген графит жиі ұшырай, көбінесе қабыршақ түйіршік кейде домалақ агрегаттар күйінде кездеседі
түсі қара, сұр сұр қара, ұстағанда май сияқты қолға жұғады. металдфй жылтыр қат т1, ал қабат ішінде 5, 5 жәнеодан артық
меншікті салмағы2, 2г/см3 балқу т 3850+50с гр электр тоғын, суды
жақсы өткізеді. қышқылға төзімді, жоғарғы тем-да ғана тотығады
отқа берік, балқыған металға салса еріп, амфотерлік қасиеті бар
щксидтер түзеді, балқыған селитрада жанады.
жеңіл өңделеді жұмсақ майысқыш
нейтрон сәулесінен әсер еткенде графиттің электр тоғын өткізгіштігі майысқыштығы қаттылығы артады, ал жылу өткізгіштігі күрт төмендейді.
құрылымы жағынан графит айқын кристалды жасырын
кристалды және графитиодтар болып бөлінеді.
графиттің негізінен құрамында битумды зат бар.
саздардың қатты метаморфтануға салынуынан түзілген кристалды тақта тастан алынады. олардағы графит мөлшері
20 процентке жетеді. кейін одан да асады.
кентастағы графит қабыршағы флотация әдісімен ажыратылады.
графиттің алынуы
графитті жасанды жолмен алуға да болады.
элекр пешінде 2200 с гр-тан астам қыздырғанда тас көмір
антроцит графитке айналады. домна пештерінде балқыған шойынды баяу салқындатқанда, оны домналық графит
дейді. карбидтерді термиялық жолмен ажыратқанда карбиттік
графит бөлінеді. графиттің химиялық-физикалық қасиетінің
ерекшелігі оны өнеркәсіптің алуан саласында қолдануға
мүмкіндік береді. графиттен отқа төзімді металдар мен бөлшектер және тқұйма қалыптары балқу тигельдері ракета
қозғалғыштарының кейбір бөлшектері жасалынады
электр техникада ( гальваникалық элементтер, сілті аккумуляторлары ) электродтар хим өнеркәсібі машиналарын жасауда қолданады.
өте таза жасанды графит блоктары ядро техникада
нейтрондарды баяулатқыш ретінде пайдаланылады.
графиттен карандаш пен бояу алынады
графитті қазіргі кезде қолдан алатын болды. ол үшін кокстың ұсақ түйірлерін шайяр және кремни оксидімен араластырып,
күшті тоқ жібереді, соның салдарынан кокс қоспасы қатты қызып, 24-26 сағат ішінде көмір графитке айналып болады.
жасанды графиттің табиғи графиттен сапасы артық көміртектің аллотропиясын- кристалданғанда атомдарырың әр түрлі орналасуы-
арқылы түсіндіріледі.
алмас пен графиттің ішкі құрылысында айырмашылық рентген сәулесі арқылы анықталады. алмаста көміртектің әрбір атомы, көміртектен басқа 4 атоммен байланысқан байланысқан, барлық атомдардың арақашықтығы бірдей, 0, 154
көміртек атомдары алмаста sp3 гибриттік күйде болады
алмаста көміртектің әрбір атомы дұрыс тэтраэдр төбесінде
орналасқан. сонымен алмастың кристалын үлкен молекула деп
қарауымызға болады. мұндағы атомдар арасындағы байланыс ковалентті, қатты заттардағы байланыс ковалентті болса, ондай заттар әдетте, балқуы қиын, әрі өте қатты болады.
графитте көміртектің атомдары дұрыс алты бұрыштың
бұрыштарында орналасқан, ол бұрыштардың өздері параллель
жазықтарда жатады. әрбір көрші жазықтың арасы 0, 134 нм, алты бұрышты түзуші көрші атомдардың арасы 0, 145 нм, жазықтар арасының байланысының нашарлығығынан графит /карандаш/
жұққыш болады. көміртек атомдары графитте sp2 гибриттік
күйде болады.
алмас пен графиттен басқа көміртектің карбин деген жақында синтезделген түрі бар
карбин шымқай қара түсті зат. карбин көміртек атомдары sp-гибриттеуге ұшыраған тізбекті полимер. карбин шала өткізгіш, көміртектің бұл аллотроптық түрлерінің ішінде
тұрақтысы графит көміртектің табиғи қосылыстарынан құрамында көміртек көп
заттардың бірі -түрлі отындар.
отын қатты, сұйық, және газ түрінде болады.
қатты отын-- қазба көмірлер, шымтезек, ағаш және жанғыш
слонецтер.
сұйық отын-мұнай және олардың туындылары
газ түріндегі отын-табиғи, генератор, су, кокс жәнежер асты
газдары.
отынның маңызы ерекше, ол өнеркәсіптің қай саласы болмасын,
ауыл шаруашылығында, үй шаруашылығында шешуші орын алады. отын құрамында негізінде көміртек пен сутек көп болса, сол отының жылу бергіштік қабілеті жоғары болады
қатты отынға жататын --- шемтезек
шымтезек көмір түзілу процесінің бірінші сатысында түзілетін
өнім. шымтезек талшықты жердің өсімдігінен/ мүк / түзеді.
шымтезекте көміртек 65%-тен артпайды.
шымтезектің кемістігі -күл көп қалады. шымтезек те жергілікті отын. шымтезекпен істейтін бірнеше ірі электр станциялары бар шымтезекті құрғақ айдаса, бірнеше химиялық өнімдер бөліп шығып шымтезек коксы қалады. . мұнда күкірт газы болғандықтан, оны жоғары сапалы шойын қорытуға қолданылады.
ағаш отында 50 проценгттей көміртек болады. үй шаруашылығында болмаса, өнеркәсіпте қолдануы азайып кетті.
жанғыш слонецтер-негізінде жануарлар қалдықтарынан,
не өсімдік текті органикалық затпен минералды қосылыстарданмыс/әктас/ тұратын болады. мұндай жылуды көп беретін жақсы отын бірақ оны отын етіп жақаннанда, химиялық өңдеп, мотор отынын
машина майларын және түрлі химиялық, әсіресе газ түріндегі
өнімдер алған әлде қайда пайдалы.
газ түріндегі отын- отындар ішіндегі ең бір қолай-
лысы . өндірістердің көпшілігінде отынның жылу бергіштігінен басқа, оның беретін жылуының қызуы,
яғни оның туғыза алатын ең жоғарғы температурасы қажет. ол эффекті дейді. қатты отынның пирометриялық эффектісі онша болмайды.
сұйық отын мұнайды---форсунка деп аталатынаспаппен оттықтың ішіне бүрккенде, оның ұсақ тамшылары ауамен өте жақсы араласып, қызу
жаныпқатты отыннан гөріжоғарылақ тем-ға береді.
газ түріндегі отын ауамен өте жақсы араласады.
сондықтан оның пирометриялық эффекті бәрінен жоғары. оның үстіне жанғыш газды да, ауаны да пешке жіберіп, жақпас бұрын, алдын ала қыздыруға болады.
осының арқасындагаз отыны 1800гр-қа дейін қызу бере алады. мұндай қызуды басқа еш отын бере алмайды.
табиғи газ жер қойнауынан бөлініп шығаратын жанғыш зат, негізінде метан және басқа қанық көмір
сутектерден тұрады. табиғи газды өте қуатты, әрі арзан отын ретінде пайдалунумен қатар, ол органикалық
синтезге, әсіресе, қазіргі кезде өте өркендеп жатқан полимер.
қатты отын
қазба көмірлер-отынның көп тараған түрі
бұл ерте замандағы ағаштардың ауаның қатынасынсыз
айрылғаннан түзілетін заттар. мұндай айырылу кезінде
оттек пен сутек бөлініп шығады, демек қалдығында көміртек көбейеді. көмір неғұрлым ерте түзілсе, сщғұрлым көміртек ішінде көбірек болады. қазба көмірлерді тікелей жазуға да, әрі отынның бағалырақ түрлерін-кокс, сұйық отын, газ түріндегі отын да пайдалануға болады. дүние жүзінде қазбакөмірдің әзіргі белгілі қоры 8000 млрд тонна. қазба көмірдің қоры жағынан совет одағы жер жүзінде бірінші орын алады.
қазақстанда қарағандыдан басқа екібастұз сияқты жердің көмірі өте көп екендігі ашылып, олда іске қосылды.
қазба көмірдің басты 3 түрі бар.
- антрацит-қазба көмірлердің ескісі, тығыз, жылтыр болады.
... жалғасықұрамында 96%-тей көміртек болады.
тас көмір -қазба көмірлердің ең көбі, тығыз, қара түсті,
құрамында 85-91%көміртек болады.
қоңыр көмір- көмірлердің жасы, күлі көп/ 7-38%/ құрамында көміртек/65-70/ процент ғана, сондықтан өндірілетін жерде
қолданылады. соңғы кезде қоңыр көмірді катализатор
қатынасында сутекпен араластырып қысып, қыздырып гидрогендеп/ сутектендіріп / бензинге, керосинге айналдырады.
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz