Химиялық термодинамиканың негіздері мен бірінші заңы


ХИМИЯЛЫҚ ТЕРМОДИНАМИКАНЫҢ НЕГІЗІ
§ 1. ТЕРМОДИНАМИКАНЫҢ БІРІНШІ ЗАҢЫ
Термодинамикалық түсініктер мен анықтамалар. Термодинамика денелер энергиясының бір-біріне жылу мен жұмыс түрінде өзгеруін, айналуын зерттейді. Қоршаған ортадағы энергияның осылай алмасуы термодинамикада сандық сипаттама ретінде қарастырылады. Жылу, электрон, атом, молекула сияқты бөлшектердің ретсіз қозғалысын, яғни олардың кинетикалық энергиясының жылу түріндегі энергиямен алмасуын, ал жұмыс - сол бөлшектердің реттелген козғалысын кинетикалық энергия түрінде сипаттайды.
Термодинамика негізінен термодинамиканың бірінші және екінші заңдары деп аталатын екі заңдылыққа сүйенеді. Олардың, екеуі де өмірдегі, өндірістегі тәжірибелерді жинақтап, қорытып, тұжырымдаудан пайда болған. Термодинамика мынадай тараулардан тұрады: энергияның бір түрден екіншіге түрленуіндегі жалпы заңдылықты зерттейтін жалпы немесе физикалық термодинамика, жылу машиналарындағы жылу мен механикалық жұмыстың өзара айналуын, яғни жылудың жұмысқа, жұмыстың жылуға ауысуын қарастыратын техникалық термодинамика, химиялық реакция, еру, кристалдану, адсорбция сияқты процестердегі энергия түрлерінің өзара алмасуын, айналуын анықтап, есептейтін химия-лық термодинамика. Сол сияқты, химиялық термодинамика тек химиялық және басқа да энергиялардағы ара қатынасты зерттеп қана қоймай, белгілі жағдайдағы химиялық процестердің мүмкіндігі мен өздігінен жүру шегін айқындайды. Ендеше, химиялық термодинамика химиялық өндіріс пен технологиялық процестер негізі болып саналатын физикалық-химиялық құбылыстарды нақты түсініп, сауатты есептеп, ұтымды басқаруға көмектеседі.
Термодинамикалық әдістегі есептеулерді қолдану өндірістің барлық салаларына өз ықпалын тигізіп, оларды жаңа сатыға көтерді. Ал, қазіргі кезде термодинамикалық әдіс металлургиялық процестерде, пластикалық масса (пластмасса), тыңайтқыш, химиялық талшық өндірісінде, отынды химиялық әдіспен өңдеуде кеңінен қолданылуда. Әсіресе, соңғы жылдары биологиялық термодинамиканың шапшаң дамуына байланысты, өсімдік пен жануар организмдеріндегі биохимиялық процестерге де термодинамикалық есептеу әдістері қолданылуда.
Термодинамиканың, алғашқы бағыты табиғатта кездесетін құбылыстарды жай ғана баяндаудан басталып, жылу мен энергия түрлері арасындағы қатынасты сипаттап қаиа қоймай, оны есептеуді игерді. Термодинамика математика, физика, химия сияқты түбегейлі ғылым салаларымен тығыз байланыста бірін-бірі толықтыра келіп, ішкі энергияның айналуын анықтап, бағытын, мүмкіндігін көрсетеді. Ал, соңғы жетістіктерге сүйеніп, термодинамика :көптеген процестерді есептеп, анықтап, ондағы энергияның қалайша түрленетінін нұсқап қоймастан, жалпы процестің жүру, жүрмеуін алдын ала болжайды.
Термодинамика сондай-ақ, классикалық және статистикалық болып та бөлінеді. Қлассикалық (дәстүрлі) термодинамика жекеленген атом, молекула сияқты бөлшектерді емес, бу машиналарының, іштен жанатын двигательдердің жұмыс істеу ерекшеліктерін, сүйықты қайнатып айдау, кристалдану, электролиз сияқты микроскопиялык жүйелерді зерттейді. Ал статистикалық термодинамика кейін пайда болса да, термодинамика ілімін едәуір дамытып, жаңа сатыға көтерді. Статистикалық термодинамика жекеленген атом, молекула секілді бөлшектерді қарастырады, олардың біріккен сипаты мен қасиеттерін айқындайды. Термодинамиканың бұл екі саласын білу болашақ химик, биолог, технологтардың кәсіби ма-мандықтарының деңгейін жаңа сапаға көтереді.
Термодинамиканы кейде энергетика деп те атайды. Ол зерттеуші қолындағы аеа қуатты қару, таптырмас әдіс болса да, бәрін шеше бермейді. Оның көмегімен белгілі процесс кезінде алынатын барынша тиімді, мейлінше пайдалы жұмысты болжап айтуға, тепе-теңдік күйді анықтауға, жоғары шығымды, жүріп жатқан реакция үшін тиімді температураны, қысымды, еріткіш ортаны, т. с. с. білу-ге болады. Сондай-ақ, термодинамика берілген реакцияның жүру, жүрмеуін, бағытын анықтайды. Бірақ осы реакция жүру үшін қанша уақыт қажет, ол қандай жолмен жүреді деген сауалдарға жауап бере алмайды.
Термодинамикалық система (көбіне тек система) деп қоршаған ортадан бөлініп алынған денені немесе денелер тобын айтады. Ал системадан тыс қалғандарды қоршаған орта дейді. Системаның фазааралық не ойша бөлінген шекарасы болады. Осылайша бөлініп алынған системадағы молекулалар саны көп болу қажет. Егер системадағы молекула саны аз болса, оны термодинамика қарастырмайды.
Системаның өзін қоршаған ортамен қатынасы энергияның механикалық, жылулық немесе басқа да түрлерімен және затпен алмасқан мезеттерде жүзеге асады. Егер осы айтылғандардың бірде-бірі жүзеге аспаса, онда мұндай системаны оқшауланған система дейді. Ал система мен оны қоршаған орта арасындағы қатынас энергия түрлері арқылы жүзеге асып, онда зат қатынаспаса (алмаспаса), системаны жабық, кейде түйықталған деп атайды. Зат салынған жабық ыдыс, газы бар баллон және баскалар жабық системаларға мысал болады. Системадан шығатын зат та, энергия түрлері де оны қоршаған ортаға жетіп алмасса және бұл құбылыс кері бағытта да жүретін болса, оларды ашық система дейді. Өсімдіктер мен жануарлар дүниесі ашық системаға айқын мысал. Мұндағы система - өсімдік, жануар (тірі организм), оны қоршаған орта - атмосфера (ауа), қатынастырушы зат - қоректік заттар, энергия - химиялық реакциялар кезінде бөлінетін жылу, заттардың тотығуы.
Системаның күйі көлем, қысым, температура, масса, химиялық құрам сияқты параметрлермен және химиялық қасиеттердің жи-
ынтығымен сипатталады. Мұнымен қатар система күйін көрсететін бірнеше теңдеулер де бар. Система күйін анықтау үшін көрсетілген өлшемдердің бәрін білу шарт емес, өйткені олар теңдеу құрамына енгендіктен, бірін-бірі толықтырады және өзара байланысты болады. Система күйін анықтау үшін таңдалып алынған бірнеше тәуелсіз ауыспалы шамадағы қасиет көрсеткішін күй параметрлері (өлшемі) дейді. Оларды белгілі бір жағдайда өтетін процеске орай таңдайды. Мәселен, газ күйін сипаттау үшін оның қысымы, көлемі және температурасы сияқты үш өлшемнің екеуін алсақ жеткілікті, себебі қалғаны осыларға әр уақытта да тәуелді болады.
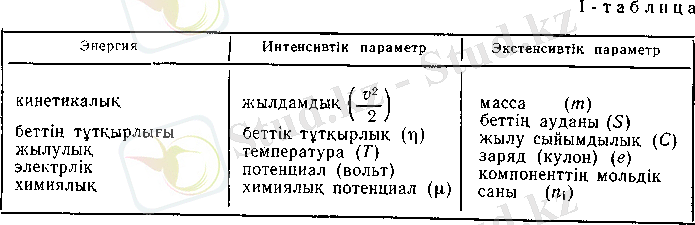
Күй параметрлерін экстенсивтік және интенсивтік деп бөледі. Экстенсивтік параметрлер мысалы, көлем, масса системадағы заттың санына пропорционалды. Ал интенсивтік параметрлер мәселен, температура, қысым, тұтқырлық, концентрация заттың санына (мөлшеріне) тәуелді емес. 1-таблицада энергияның интенсивтік параметрлермен байланысы көрсетілген. Бұған зер салып қарасақ, энергияның параметрлермен табиғи байланысын көріп, көптеген коэффициенттерді пайдаланып, энергияның бір түрі басқа түрге қалай ауысатынын және олардың өлшем бірліктерінің де қалай өзгеретінін, ішкі байланысын байқаймыз. Интенсивтік не экстенсивтік параметрлерді интенсивтік фактор және экстенсивтік (сы-йымдылық) фактор деп те атайды. Энергияның әр түрлі мәнінде тұрған интенсивтік немесе экстенсивтік параметрлердің орнын ауыстыруға болатыны сияқты, жекеленген параметрлерді (интен-сивтік не экстенсивтік (сыйымдылық) фактор болсын) осындағы басқа параметрлермен ауыстыруға болмайды.
Система күйіндегі параметрлердің кез келген өзгерісі процесс деп аталады. Оқулықта жиі кездесетін процестердің кейбір түрлері мыналар:
1. Изотермалық процесс (Т = const)
2. Изобаралық процесс (ρ = const)
3. Изохоралык процесс (V = const)
4. Адиабаталық процесс (Q = 0)
5. Изобара-изотермалық процесс (р = const; Т = const)
6. Изохора-изотермалық процесс (V = const; Т = const) .
Система күйінің біраз параметрлері процесс нәтижесінде өзгеріп, соңында өздерінің бастапқы мәніне қайта оралса, онда мұндай процестерді тұйық процестер деп атайды.
Егер системада энергия немесе зат алмасу болмаса және оның касиеті уақыт өткен сайын өзгермесе, онда мұндай системаның, күйін күй теңдігі дейді. Әйтсе де, ортадан тепкіш күштің, электрлік және басқа сыртқы әсер ету күштерінің өрісіндегі системаның тепе-теңдік кезіндегі интенсивті қасиеттері бір нүктеден екінші нүктеге ауыса алады, яғни өзгереді, бұл өзгерістерді ескермеуге де болады. Системаның тепе-теңдік күйін уақыт өткен сайын қасиеті өзгеріссіз қалатын тұрақты күйден ажырата білу қажет.
Бір процестегі система тепе-теңдіктегі күйдің біразынан үздіксіз өтсе, оларды тепе-теңдіктегі немесе квази теңдіктегі деп айтады. Бұл жағдайда қарастырып отырған система ішіндегі тепе-теңдікті және оның жекелеген бөліктері арасындағы, сол сияқты системаның өзін қоршаған ортамен шектелген шекарасындағы тепе-теңдікті де қосады. Мүндағы, жекеленген бөліктер мен системаны қоршаған орта арасындағы әрекет процесс сипатына ешбір нұқсан келтірмейді. Егер қоршаған ортадағы процесс те тепе-теқдікте болса, онда қарастырылатын системаның кез келген аралықтан немесе соңғы күйден бастапқы қалыпқа (күйге) оралу мүмкіндігі болады және осы кездерде сыртқы ортада ешқандай өзгеріс қалмайды. Мұндай процестерді қайтымды дейді. Тепе-теңдіктегі және қайтымды процестер ете баяу жүреді. Тіршіліктегі іске асатын әр процестің соңғы жылдамдығы болады және ондай процестер қайтымсыз келеді. Тепе-теңдіктегі қайтымды процестерді сипаттайтын қатынастарды термодинамиканың негізгі заңдылықтарына сүйеніп есептеуге болады.
Енді осы процестерді шағын тәжірибе арқылы талдап көрейік: ол үшін тұрақты температурадағы газы бар цилиндрді ешбір кедергісіз еркін қозғалатын поршеньмен жабайық. Поршеньге жоғарыдан күш әсер етпесе, ол белгілі бір биіктікте қозғалыссыз тұрады. Бұл процесті түсіндіру үшін 2-суретте көрсетілгендей үш түрлі гирь тастарын алайық. Олардың бірінші түрі бір килограмдық үш гирь тасы, екіншісі - жарты килограмдық алты гирь тасы, ал үшіншісі - ол да үш килограмдық, бірақ ол әрбір түйіршігі бір грамдық құм қиыршығынан тұрады. Енді цилиндр поршенінің үстіне бір килограмдық бір гирь тасын қойсақ, поршень цилиндрдегі ауаны қысып, көлемін кішірейтіп, төмендейді, екінші және үшінщі гирь тасын қойғанда да осы процесс қайталанады. Процесс соңында поршень үш саты арқылы өзінің ең төменгі деңгейіне жетіп тоқтайды. Осы кезде цилиндрдегі газ көлемі V І -ден (бастапқы көлем) V 2 -ге өзгереді. Мұны кері жүргізуге де болады. Ол үшін кезекпен әрбір килограмдық гирь тасын бір-бірден алса, поршень үш сатылы процесс арқылы жоғары көтеріліп, өзінің, қалпына келеді, мұнда газ қысымы азайып, көлемі көбейеді. Осы бір-біріне Қарама-қарсы екі процестің өзгеруі 2, а-суретте көрсетілген. Ондағы төменгі сынық сызық гирь тастарын поршеньге салғандағы, ал жоғарғысы оларды біртіндеп алғандағы процестерді аңғартады.
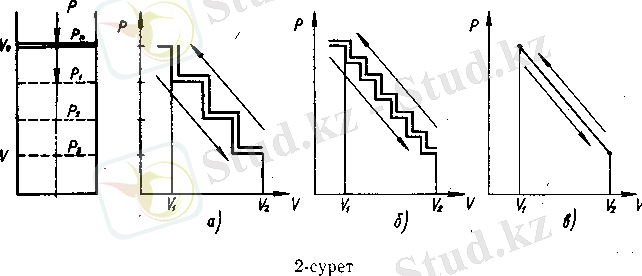
Әрбір саты немесе секіру бір килограмдық гирь тасын қосқанға (төменгі), не алғанға (жоғарғы) тең. Демек, төменгі сынық сызықтың әрбір секіруі қысымның (жүктің) көбеюін және соған сәйкес цилиндр ішіндегі газ көлемінің азаюын көрсетсе, жоғарғы сынық сызықтың әрбір секіруі поршеньге түсірілген қысымның (жүктің) кемуі мен соған орай газ көлемінің көбеюін сипаттайды. Осы кездердегі цилиндр поршенінің жоғары-төмен қозғалуынан пайда болатын жұмыс - төменгі сызықтың астындағы ауданға, ал газ кө-лемінің ұлғайғандағы жұмыс - үстіңгі сызықтың астындағы ауданға тең. Бұдан поршеньнің газды қысқандағы жұмысынан гөрі, газдың көлемін көбейту кезіндегі жұмыстың артық екені көрінеді. Енді осы процесті қайталайық (2, б-сурет), тек мұнда жарты килограмдық алты гирь тасы бар. Мұнда да поршеньге түскен күш (кысым) көбейген сайын, газ көлемі азайып, төменгі қисықпен өрнектелсе, енді оған керісінше әрбір гирь тасын алып, поршень қысымын секірмелі азайтқанда, оған сәйкес цилиндр ішіндегі газ көлемі секірмелі түрде артып отырады және ол жоғарғы сызықпен сипатталады. Мұнда екінші процестегі газдың жұмысы біріншісінікінен артық.
Бұл процесті басқаша да қайталауға болады. Егер поршень арқылы цилиндр ішіндегі газға түсетін қысымды шексіз кіші шамаға көбейтсе, мұндағы процесс бірқалыпты өзгереді және оны дәл осы тәртіппен, қысымды шексіз кіші шамаға кеміткенде де бірқалыпты жүреді. Поршеньге әрқайсысы бір грамдық құм түйіршігін бір-бірлеп салса, газға түсетін қысым бірқалыпты көбейеді де, газдың көлемі баяу азаяды. Мұндайда, бірінші тәжірибедегі үш саты екіншіде алтыға бөлінсе, үшіншіде үш мың сатыға бөлінеді екен (2, в-сурет) . Демек, әсер етуші қысымды шексіз кіші бөлшекке жіктеу әлгі сынық сызықты да соншаға бөлумен бірдей. Олай болса, газды қысуды көрсететін төменгі қисық газ қысымының азаюы мен көлемінің көбеюін бейнелейтін жоғарғы сызыққа жақындайды да тепе-теңдікке ұмтылады. Мұндайда сызық астындағы көлем де теңеледі. Осы шартқа орай газ көлемі азайғандағы жұмыс ең аз, ал газ көлемі көбейгендегі жұмыс ең көп болады.
Ішкі энергия. Ішкі энергия (U) системаның жалпы энергия қорын сипаттайды. Оның құрамына системаны кұрайтын электрондардың, ядролардың, атомдардың, молекулалардың, бөлшектердің, өзара әрекеті мен қозғалыстарындағы энергияның барлық түрлері енеді. Әйтсе де ішкі энергияра сыртқы күш өрісіндегі потенциалдық энергия мен системадағы кинетикалық энергия енбейді. Оның абсолюттік мәнін ең, қарапайым система үшін де анықтау мүмкін емес және термодинамика мақсаты үшін ол керек емес. Система бір күйден екіншіге ауысқан кездегі оның, ішкі энергия өзгерісінің мәнін табу маңызды ΔU= U 2 - U 1 . Қарастырылып отырған процестегі системанық ішкі энергиясы көбейсе (артса), онда ΔU оң, азайса теріс болады.
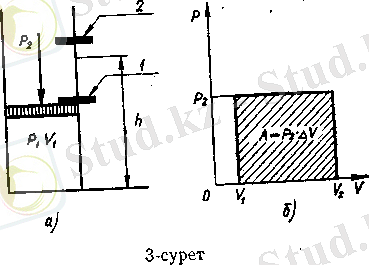
Система өзін қоршаған ортамен әрекеттескенде пайда болатын құбылысты жұмыс дейді. Осындай жұмыс нәтижесінде системаның тепе-теңдігін бұзған сыртқы күш жойылады. Сонымен жұмыс дегеніміз энергияны берудің макроскопиялық түрі екен. Олай болса, жұмыс жүргізілуі үшін сыртқы күштің болуы шарт. Енді осы ойды түсіндіру мақсатымен, газ көлемінің, үлғаюы кезіндегі жұмысты қарастырайық (З-сурет) . р І бастапқы қысым - және V 2 көлемі басым. Цилиндрдің 1 және 2 нүктесінде поршеньді ұстап тұратын шектеуіштер орнатылған делік (3, а-сурет) . Поршеньге сырттан қысым түсірілсін, ол поршень астындағы, яғни цилиндр ішіндегі әуелгі қысымнан р 1 аз болсын: р 2 <р 1 . Егер 1-шектеуішті босатсақ, онда газдың көлемі ұлғайып, кысымның көлем өзгерісіне көбейтіндісіне тең шамадағы жұмыс атқарылады:
А = р 2 · (V 2 -V 1 ) =р 2 ΔV (3, б-сурет) . Поршеньнің сыртқы қысымы р 2 азайған сайын, газ көлемінің, ұлғаюы кезінде атқарылатын жұмыс шамасы да азаяды және р 2 = 0 болса, А = 0. Ал, сыртқы қысым ішкі қысымнан шексіз аз мөлшердегі қысымға ғана артық болса, онда ең көп жұмыс атқарылады, оны максималды жұмыс дейді.
Жылу дегеніміз бір-біріне түйіскен денелердегі молекулалардың өзара соқтығысу (қақтығысу) арқылы, яғни система ішінде жылу алмасу жолымен энергияны беру, жеткізу түрі. Ал жылу алмасу - макроскопиялық не ретсіз қозғалыстағы бөлшектердің энергияны беру түрі. Жылудың бағытын және өзара берілуін, қозғалысьн температура көрсетеді.
Жұмыс (А) пен жылу (Q) ішкі энергия (U) сияқты системалардың қасиетін көрсетпейді, олар тек энер-гияны бір системадан екіншіге жеткізеді. Жылуды беру немесе жұмысты атқару үшін система өзін қоршаған ортамен не басқа системалармен әрекеттесуі қажет. Көбіне, система өзін қоршаған ортамен не басқа систе-малармен әрекеттесуі қажет. Әдетте, система өзін
қоршаған ортадан не басқа системадан жылу алса, жылуды және осы кездегі система атқарған жұмысты оң, ал кері жағдайда теріс дейді.
Энтальпия. Қөптеген процестерді термодинамикалық тұрғыдан қарастырғанда ішкі энергиямен қатар

функциясы да жиі кездеседі. Мұндағы р - система қысымы; V - система көлемі. Осы теңдеудің оң жағындағы көбейтіндіні (рV) системадағы потенциалды энергиямен теңестіруге болады. Энтальпияны «системадағы кеңейтілген энергия» немесе «жылу ұстағыштық» деп те айтады. Энталышя да ішкі энергия сияқты система күйінің функциясы және оның процестер кезіндегі өзгеруі. Ол процестердің қалай, қандай жолмен өткеніне тәуелді емес, тек системаның бастапқы және соңғы күйіне байланысты. Энталышяның абсолюттік мәнін анықтау мүмкін емес. Өйткені оны өрнектейтін термодинамикалық теңдеу белгісіз және табуға мүмкіндік жоқ. Сондықтан да көптеген процестерде энтальпия мәнінің өзгеруі ғана ескеріледі:
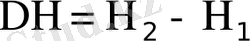 (10)
(10)
Энтальпия терминін 1909 жылы Оннес енгізген, ол гректің «эн»- ішкі және «тальпэ»- жылу деген сөздерінен алынған.
Термодинамиканың бірінші заңы. Термодинамиканың бірінші заңы (кейде оны термодинамиканың бірінші бастамасы дейді) негізінен энергияның сақталу және оның жылу процестеріне түрлену (айналу) зады болып есептеледі. Демек, ол жылу мен жұмыстың өзгеруіне байланысты. Ал, энергияның сақталу заңы ғылымға көптен белгілі. Өйткені табиғаттың осы заңдылығы макросистемалардағы процестерге де, молекула саны аз қатынасатын өте кішкене системаларға да қолданылады. Ол, әуелі механикадағы жылу мен жұмыс арасындағы қатынастарды зерттеп, анықтау кезінде қалыптасып, бертін магниттік және электрлік энергиялардың байланысын түсіндіру үшін электрлік теорияда колданылды. Осы айтылған екі жағдайда да жылу алмасу қарастырылмай, тек энергияның бір формадан екінші формаға ауысуы ғана алынған.
Макроскопиялык. системалардағы энергияның өзгеруі тәжірибе көрсетіп отырғандай жылу алмасу формасында байқалады және сан түрлі жүмыс түрінде кездеседі. Көптеген әдістер арқылы бір күйден екінші күйге ауысқан жылу мен жұмыстың алгебралық қосындысы өздерінің тұрақты мәнін сактайды, ал процестерде ол нөлге тең. Жүргізілетін тәжірибелер нәтижесінен, термодинамиканың бірінші заңы сипаттауды, дәлелдеуді керек етпейтін жорамал (постулат) екенін көреміз. Осыған сүйеніп системадағы ішкі энергияның қосындысы тек система күйіне ғана тәуелді функция екенін аламыз. Мысалы, жабық системаға белгілі мелшердегі жылу (Q) жібеірілді делік. Бұл жылу жалпы жағдайдағы системаның ішкі энергиясын (U) көбейтуге және сол системаның істеген жұмысына (А) кетеді. Демек, термодинамиканың бірінші заңын былай тұжырымдауға болады: кез келген процестердегі системаныц ішкі энер-гия өсімшесі, осы системага берілген жылу мөлшерінен система атқйрған жұмысты азайтқанға тең:

Бұдан ішкі энергияның өзгеруі процестерді қалай, қандай жолмен жүргізгенге байланысты емес, системаның бастапқы және соңғы күйіне тәуелді екенін көреміз. Бұл, ішкі энергияның система күйінің функциясы екенін дәлелдейді. Егер функцияның мәні күй параметріне ғана байланысты болып, процестің бұрынғы күйімен анықталмаса, онда ол функцияны күй параметріне функциялы деп те айтады. Жылу мен жұмыс мұндай қасиет көрсетпейді, олар система күйінің функциясы емес және процестердің қалай, қандай жолмен жүргізілгеніне тәуелді. Осы айтылғандарды нақтылай түсу үшін, термодинамиканың бірінші заңының дифференциалдық түрін математикалық өрнекпен көрсетейік:

(10) және (11) теңдеулер - термодинамиканың бірінші заңының аналитикалық мәні. Оларды өткен ғасырдың ортасында, бір-бірінен тәуелсіз әуелі Р. Майер, сосын Д. Джоуль ашқан. Алғашында бұл теңдеулер тек механикалық жұмыстарды сипаттауға ғана қолданылған. Бертін келе Г. Гельмгольц оларды жалпы түрге ауыстырды. Бұл теңдеулердегі А кез келген жұмыс түрін көрсетеді. Ал, жалпы жұмыс мөлшері системаға әсер еткен күштердің қосындысының жүргізілген жұмыс жолына көбейтіндісіне тең. Газ өз көлемінің улғаюы кезіндегі жұмыстар жиірек қарастырылады.

мұндағы А'- система көлемі өзгергендегі жұмыс және оны пайдалы жұмыс деп атайды.
Химиялық термодинамикада химиялық өзгеріс кезінде пайдалы жұмыс алудың мәні зор. Мысалы, оқшауланған системаларда жылудың да, жұмыстың да өзгерісі болмайтындықтан, термодинамиканың бірінші заңы былай өрнектеледі: :
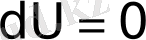
 (14)
(14)
яғни оқшауланған системалардағы ішкі знергия тұрақты шама.
Ашық системалар үшін, ішкі энергияның экстенсивтік шама және оның система массасына байланысты екенін ескерген жөн. Олай болса, термодинамиканың бірінші заңы ашық системалар үшін:
U=QA+E M және dU=δQδA+dE M (15)
мұндағы Е м системадағы масса өзгерісіне байланысты энергия.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz