Дисперстік жүйелердің физика-химиясы: зертханалық жұмыстарға әдістемелік нұсқау (6B01507 Химия-биология мұғалімдерін даярлау)


«м. х. дулати атындағы тараз өңірлік университеті» КЕ АҚ
«БЕКІТЕМІН»
«Химия және биология» кафедрасының меңгерушісі, х. ғ. к., доц.
Мажибаев А. К.
«» 20 ж.
.
6B01507-«Химия - биология мұғалімдерін даярлау»
білім беру бағдарламасы бойынша
Дисперстік жүйелердің физика-химиясы
пәнінен
зертханалық жұмысты
орындауға
ӘДІСТЕМЕЛІК НҰСҚАУ
Тараз 2022
6B01507-«Химия - биология мұғалімдерін даярлау» білім беру бағдарламасы бойынша
/білім беру бағдарламасының коды және
Дисперстік жүйелердің физика-химиясы пәнінен
/пәннің атауы/
зертханалық жұмысты орындауға
/жұмыстың атауы/
әдістемелік нұсқау пәннің оқу бағдарламасына сәйкес жасалған.
Әдістемелік нұсқауды құрастырушылар:
«Химия және биология» кафедрасының РhD доценті Таубаева Р. С
/аты-жөні, қызметі, ғылыми дәрежесі, ғылыми атағы/
«Химия және биология» кафедрасының химия магистрі Муталипова Ж. А
/аты-жөні, қызметі, ғылыми дәрежесі, ғылыми атағы/
Әдістемелік нұсқау __ «Химия және биология» кафедрасының мәжілісінде талқыланды
/кафедраның атауы/
Хаттама № «»20ж.
МАЗМҰНЫ
Зертханалық жұмыс №1.
Зертханада химиялық заттармен жұмыс істеу кезіндегі қауіпсіздік техникасы.
Жұмыстың мақсаты: Лабораториялық жұмыстардың техникасымен, қауіпсіздік ережелерімен танысу.
Сабақтың жүргізілу барысы:
1. Химия лабораториясындағы жұмыс ережелері. Жұмыс жасаудың жалпы ережелері.
1. Лабораторияда жұмыс жасау барысында тазалық, тыныштық және тәртіп сақтау қажет. Тәртіпсіздік, асығыстық және салақтық келеңсіз жағдайларға әкеп соғады.
2. Лабораторияда су, тамақ ішуге болмайды.
3. Газды, токты және реактивтерді үнемдеу керек; реактивтерді белгіленген мөлшерден артық алмау керек. Қажет болмаса жанып тұрған спирт шамын өшіріп, қосылған электр аспаптарын токтан ажырату керек.
4. Раковиналарға қышқыл, сілті, отқа қауіпті және иіс шығаратын сұйықтықтарды құймаңдар, оларды арнайы ыдыстарға құю керек.
5. Раковиналарға қағаз, құм және басқа да қатты заттарды тастамаңдар.
6. Жұмысты оқытушының рұқсатымен бастаңдар. Жұмыс жоспары жұмыс журналында жазылып, оқытушы қолымен бекітілген болуы керек.
7. Жұмыс барысындағы кездесуі мүмкін барлық операцияларды жіті талдап, содан соң ғана тәжірибені бастау керек.
9. Сұйық немесе қатты заттарды пробиркаларда (колбаларда) қыздырғанда, ыдыстың аузын өзіңізге немесе көрші студентке бағыттауға болмайды, пробиркаға (колбаға) жоғары жағынан үңіліп қараманыз, себебі қызған зат сыртқа қарап шашырап, Сізді бақытсыздыққа душар етуі мүмкін.
10. Жұмыс орнын таза, ұқыпты ұстау керек, оны ыдыстар, қағаз және материалдармен бөгеуге болмайды.
11. Органикалық препараттарды синтездеу барысындағы сәл ғана абайсыздық, ауыр зардаптарға әкеліп соғуы мүмкін. Сақтық шараларын сақтау тек қана жеке басыңыздың қауіпсіздігін қамтамасыз ету емес, сонымен қатар қызметтес достарыңыздың алдындағы Сіздің парызыңыз.
12. Көгерткіш қышқыл, калий немесе натрий цианиді, фосген, жай қышқылдардың хлорангидридтері, хлор, бром, көмір тотығы, азот оксидтері, фосфордың галоген туындылары сияқты заттармен жұмыс жасағанда ерекше абай болған дұрыс. Оларды көп мөлшерде қолданған жағдайда, арнайы бөлмелерде жұмыс жасаған абзал. Ал жалпы лаборатория жағдайында жақсы соратын шкафтар астында олардың аз ғана мөлшерімен тәжірибені жүргізуге болады.
13. Май қатарының галогентуындылары - бромды этил, хлорофром және басқалары ерітіндіде болмаса, натрий немесе калиймен жанастырмау керек, нәтижесінде өте қатты қопарылыс болуы мүмкін.
1. 1 Қопарылысқа қауіпті заттармен жұмыс жасау.
Натрий және калий, концентрлі аммиак ерітіндісі, күйдіргіш сілті, қышқылдар, қопарылғыш заттармен төмен қысымда (ваккумды айдауда, эвакуирленген эксикаторда), жоғары қысымда (мысалы, дәнекерленіп жабылған шыны түтіктерде, жабылған бөтелкелерде, автоклавта) жұмыс жасағанда, күйдіргіш натрий, күйдіргіш калийді езіп ұнтақтағанда, сонымен қатар көзге қауіп туғызатын жұмыс түрлерін орындағанда көзге триплекс шынысынан жасалған көзілдірік кию қажет.
Натрий және калиймен тәжірибе жасағанда ерекше абай болған дұрыс. Олардың сумен үйкелісін болдырмау керек, себебі нәтижесінде қатты қопарылыс, өрт және бақытсыз жағдай болуы мүмкін. Оларды сусыз керосин немесе ксилол құйылған ағаш сүрегінен жасалған (корковый) тығынмен тығындалған шыны банкіде сақтау керек. Оларды қолмен алмай, арнайы пинцет немесе қысқыш көмегімен алады.
1. 2 Жанғыш заттармен жұмыс.
Этил эфирі, спирт, ацетон, бензол, этилацетат, күкіртті көміртек, петролейн эфирі, сол сияқты басқа да жанғыш немесе оңай тұтанатын сұйықтықтармен жұмыс жасағанда ашық отта, торда, ашық жалын маңында, ашық ыдыстарда қыздырмаған дұрыс.
1. 3 Күйгенде және уланғанда көрсетілетін алғашқы жәрдем.
Калий перманганаты немесе этанолмен ұзақ уақыт бойы сүртіп, күйікке арнайы жақпа майын, мысалы сульфидинді эмульсияны жағады.
Егер, денеге теріні жейтін зат түссе, сумен шаю көп жағдайда көмегін тигізбейді. Сәйкес еріткішпен (спирт немесе бензол) жылдам және көп мөлшерде жиі шайып отыру қажет.
Егер, теріні бром күйдірсе, оны спирттің көп мөлшерімен жуып, зақымданған жерге күйікке қарсы жақпа майын жағу керек.
Егер, хлор немесе бром буымен тыныс алған болса, ұзақ уақыт бойы спирт буымен тыныс алып, содан соң таза ауаға шығу керек.
Қатты жараланғанда, күйгенде және уланғанда алғашқы жәрдемнен соң, жарақаттанушыны емханаға апару керек.
1. 4 Туындаған өртті және киімдегі жалынды өшіру.
Егер өрт туындаса, лабораториядағы газды тезірек өшіріп, жанғыш заттарды ашық оттан алыстатып, өрт аймағын құммен немесе асбет жамылғысымен жабу керек. Егер өрт ауқымы жоғары болса, көмірқышқылды өрт сөндіргіштер көмегімен өшіру қажет.
Бақылау сұрақтары
1. Тәжірибені жасау үшін қолданылатын химиялық заттардың қасиеттерін және құрамын қалай анықтауға болады?
2. Химиялық құрал-жабдықтардың нақты не үшін пайдаланылатындығын қалайша анықтауға болады?
3. Химиялық лабораторияда жұмыс кезіндегі қауіпсіздікті қамтамасыз ететін қандай заттарды білесіз?
Зертханалық жұмыс №2.
Демонстрациялық тәжірибелер: коллоидты бақшаны өсіру, «сынаптың жүрегі».
Жұмыстың мақсаты: Коллоидтық химия объектілерінің ерекшеліктерін бейнелеу.
Теориялық бөлімі: Коллоидтық химия объектілерінің ерекшеліктері. Дисперстік жүйелердің оптикалық қасиеттері (Фарадей-Тиндаль эффектісі), Рэлей теңдеуі, Ламберт-Бугер-Бэр заңы. Коллоидтық жүйелердегі диффузия мен осмос құбылыстары. Электрбеттік құбылыстар (электродтық процесстер, Липман теңдеуі) .
Практикалық бөлім: Тәжірибелерді жүргізу, көрсету және түсіндіру.
1-тәжірибе. Фарадей-Тиндаль құбылыстарын көрсету.
Құрал-жабдықтар мен реактивтер : жарық көзі, светофильтрлер, коллоидтық ерітінділер (Ғе(ОН) 3 , берлин көгі, канифоль, MnO 2 зольдері.
Молекулалық ерітінділер: CuSO 4 , FeCl 3 , KMnO 4 және флуоресцеин.
2-тәжірибе. Коллоидтық бақша.
Құрал жабдықтар мен реактивтер: сұйытылған силикатты желімшесі бар стақан, түрлі-түсті қатты тұздар: FeCl 3 , MnCl 2 , CоSO 4 , Со(NO 3 ) 2 , CuSO 4 , K 2 Cr 2 O 7 , NiSO 4 , NiCi 2 , флуоресцеин.
Жұмыс барысы:
1. Бастау үшін стаканды үштен біріне Силикат желімімен толтырыңыз, содан кейін үстіне қасық су құйыңыз;
2. Әр түрлі металдардың тұздарының аз мөлшерін әйнекке қосыңыз;
3. Біраз уақыттан кейін Нақты химиялық балдырлар өсе бастайды!Кристалдар мен желім арасындағы химиялық реакция нәтижесінде балдырларға ұқсайтын таңғажайып силикаттар пайда болады. Әр түрлі металдардың силикаттары әртүрлі түске ие.
3-тәжірибе. Сынап жүрегі.
Құрал жабдықтар мен реактивтер: штатив, сағат шынысы, тазаланып үшкірленген темір шеге, сүзгіш қағаздар, сынап, 10%-тік күкірт қышқылы, K 2 Cr 2 O 7 ерітіндісі.
Жұмыстың барысы: сағаттардың әйнегіне кішкене сынап тамшысын абайлап салыңыз. Сынап тамшысы сұйықтықпен толығымен жабылатындай етіп 6м күкірт қышқылының ерітіндісімен құйыңыз. Аздап калий бихроматын қосыңыз. Сынап тамшысының бетіне темір тырнақпен, инемен немесе сыммен абайлап түртіңіз. Темір затты күкірт қышқылына батырып, сынап тамшысының бетіне әрең тигізу керек. Сынаптың бір тамшысы импульсті бастайды.
Процестің сипаттамасы: пульсация тамшының беттік керілуінің өзгеруімен байланысты. Электролит ретінде әрекет ететін қышқылда, сондай - ақ тотықтырғыш - калий бихроматы болған кезде сынап тамшы бетінде тотығады. Нәтижесінде қышқылданбаған металмен салыстырғанда беттік керілу азаяды.
Сынап темір затпен байланысқан кезде, темір бетіндегі сынапты қалпына келтіреді, өйткені бұл металдар арасында теріс электрохимиялық потенциал жеткілікті. Қалпына келтіру кезінде сынап тамшысының беткі кернеуі артып, тамшы кішірейеді. Осыған байланысты сынап пен Темір арасындағы байланыс бұзылады, сынап қайтадан тотығады, беткі кернеу азаяды және тамшы қайтадан таралады. Нәтижесінде тамшы қайтадан темірге тиіп, цикл қайталанады.
Сақтық шаралары: сынап - өте улы зат, оның буы улы! Үйде тәжірибе жасамаңыз! Қышқылдың теріге тиюінен аулақ болыңыз, экспериментте көрсетілген заттардың көзге және ауызға түсуіне жол бермеңіз. Қауіпсіздік көзілдірігі мен қолғап киіңіз. Жалпы қауіпсіздік нұсқауларын орындаңыз. Химиялық эксперименттер жүргізу сіздің еліңіздің заңдарына толық сәйкес келуі керек.
Бақылау сұрақтары
1. Коллоидтық химия объектілерінің ерекшеліктері қандай?
2. Дисперстік жүйелердің оптикалық қасиеттері дегеніміз не?
3. Беттік керілу дегеніміз не?
Зертханалық жұмыс №3.
Лиофильді коллоидтарды алу
Жұмыстың мақсаты: конденсация әдісі арқылы коллоидты ерітінділер алу.
1-тәжірибе : Күкірт және канифоль гидрозольдерін алу.
Құрал-жабдықтар: сиымдылығы 100 мл өлшеуіш цилиндр, сиымдылығы 10мл тығыны бар 2 колба этил спиртіндегі канифольді 2% ертіндісі этил спиртіндегі күкірттің қаныққан ертіндісі, дистилденген су.
Күкірт немесе конифоль этил спиртінде шын ерітінді түзе ериді. Суда күкірт пен канифоль ерімейді. Сондықтан олардың спирт ерітіндісінің агрегаттарына конденсацияланады. Жартылай дистильденген сумен толтырып пробиркаға тамшылата отырып 0, 5 мл күкірттің абсолютті спирттегі қаныққан ерітіндісін шайқай отырып құямыз. Нәтижесінде сүт түстес золь түзіледі. 25 мл дистилденген суға тамшылата отырып 1-2 мл канифольдің 2% спирттегі ерітіндісін шайқай отырып құямыз. Нәтижесінде тұрақты сүт түстес золь түзіледі.
2-тәжірибе: Fe(OH) 3 золін гидролиз арқылы алу.
Құрал-жабдықтар: Электр пеші, асбест торы, 150мл-лік колба, тамшуыр FeCI 3 2%-ертіндісі дистилденген су.
Темір(ІІІ) гидрооксидін алу реакциясы төмендегі сызба арқылы жүреді.
FeCL 3 +3H 2 O = Fe(OH) 3 +3HCL
Fe(OH) 3 -тің беттік молекулалары НСІ мен әрекеттеседі .
Fe(OH) 3 +HCL FeОСL+2H2O
FeOCL молекулалары диссоциялана отырып FeO + жәнеCL - иондарын түзеді. Фаянс, Панет ережесі бойынша: коллоидты бөлшектің бетінде ерітіндінің табиғаты жағынан ядро кұрамы жақын иондар немесе молекулалар адсорбцияланады. Сондықтан темір (ІІІ) гидтооксиді золінің мицелласының құрылысын төмендегідей етіп келтіруге болады .
[Fe(OH) 3 ] n+mFeO + mCL - ={ [Fe(OH) 3 ] n•mFeO†(n-m ) CI - } х- •ХCI -
50 мл дистилденген суды қайнағанша қыздырамыз. Содан соң қайнап тұрған суға FeCI 3 -тің 2%-тік ерітіндісінен 5 мл тамшылата қосамыз. Нәтижесінде қызыл қоңыр түсті темір (ІІІ) гидрооксидінің коллоидты ерітіндісі алынады.
Бақылау сұрақтары
1. Зольдерді қандай әдістермен алуға болады?
2. Берлин лазуры оң және теріс зарядты коллоидты бөлшек зольдерінің мицеллаларының формуласын жазыңдар.
3. 30 мл КВr ерітіндісімен араластырғанда күміс бромидінің золі алынады. Зольдердің мицеллаларының формуласын жазыңдар.
Зертханалық жұмыс №4.
Коллоидты ерітінділерді тазарту әдістері.
Жұмыстың мақсаты: Зольдерді тазалау әдістерімен және олардың диффузиялану жылдамдығымен танысу.
Қажетті реактивтер мен құрал-жабдықтар: Нефелометр НФМ приборы, натрий хлоридінің стандарт ерітіндісі, 14% Н 2 SО 4 , 0, 1 М AgNО 3 , берлин лазурының золі, 2% таннин золі, 2% темір (ІІІ) хлориді ерітіндісі, 0, 5% крахмал золі, йодтың судағы ерітіндісі, крахмал, 0, 1 М ВаСl 2 ерітіндісі.
Теориялық бөлім: Коллоидты ерітінділерді (зольдерді) дайындағанда қоспада көптеген артық заттар болады. Мысалы, күміс йодидінің золінде едәуір мөлшерде дисперсиондық орта - су, К + және NО 3 иондары, ал темір (ІІІ) гидроксиді золінде дисперсиондық орта молекулаларымен қатар Н + және Сl - иондары болады. Коллоидты ерітінділерді еріткіштің және бос жүрген иондардың артық мөлшерінен тазарту үшін диализ әдісі кең қолданылады. Коллоидты ерітінділерді диализдегенде молекулалар мен иондар жартылай өткізгіш мембрана арқылы оңай өтіп, еріткішке көшеді. Бірер уақыттан соң мембрананың екі жағында молекулалардың және иондардың концентрацияларының арасында тепе-теңдік орнайды. Ал, коллоидты бөлшектер молекулалар мен иондарға қарағанда, мөлшері үлкен болғандықтан, жартылай өткізгіш мембрана арқылы өтпейді. Еріткішті үнемі жаңалатып ауыстыру арқылы коллоидты ерітіндіні бөгде қоспалардан тазартуға болады. Егер диализ процесі электр тогі әсерімен іске асырылатын болса, онда ол электродиализ д. а., ал ультрафильтр пайдаланып, қысымды реттеу арқылы диализдейтін болса, ультрадиализ немесе ультрафильтрлеу д. а. 1 суретте коллоидтарды тазалауға арналған қарапайым диализатор көрсетілген. Ол төменгі жағы жартылай өткізгішпен (2) қапталған воронкадан (1) , дистилденген су құйылған ыдыстан (3) құралған. Ыдыстағы су ағынды. Оның деңгейін реттеп отыру үшін сифон (4) пайдаланылған.
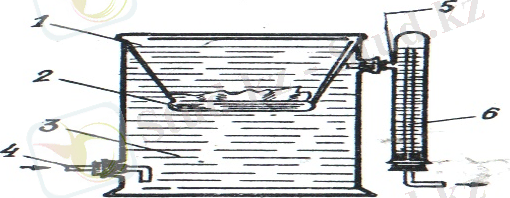
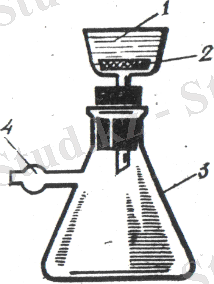
1 сурет: Диализатор. 2 сурет: Электродиализатор. 3 сурет: Ультрадиализатор.
1 - воронка, 2 - жартылай 1 - мембрана, 2 - электродтар, 1 - воронка, 2 - мембрана,
өткізгіш, 3 - шыны ыдыс, 3 - шыны ыдыс, 4, 5 - түтіктер. 3 - Бунзен колбасы,
4, 5 - түтіктер, 6 - сифон. 4 - түтік.
Электродиализаторда (2 сурет) жартылай өткізгіш орнына коллодийден жасалған ультрафильтрлер (1) қолданылады. Ультрафильтрлерге жақын екі электродтар (2) орналасқан, ыдыстағы (3) су ағынды. Электродтарға сырттан ток беріп, электр өрісін туғызатын болсақ, диализдеу процесі едәуір жылдам жүреді. Ток көзі ретінде 120 - 220 В тұрақты ток пайдаланылады. Ток тығыздығы 8 - 10 мА/см 2 .
Ультрадиализдеуде немесе ультрафильтрлеуде қысым айырымын туғызып, коллоидты ерітінділерді бөгде заттардан тазалайды (3 сурет) . Ол үшін жартылай өткізгішті (2) Бюхнер воронкасының (1) түбіне салып, оны Бунзен колбасына кигізеді. Онан соң колбаның бүйір түтігін (4) насосқа қосып, жартылай өткізгіштің воронка түбіне бір тегіс жатуын тексерген соң оған коллоидты ерітіндіні құяды. Сүзу барысында воронкаға дистилденген су құйып тұру керек. Ерітіндінің тазаланғандығын және тазалау жылдамдығын анықтау үшін фильтраттан үнемі үлгі анализін жасайды.
Коллодий мембранасын даярлау: Диализдеуде жартылай өткізгіш мембрана ретінде коллодийден немесе целофаннан жасалған мембраналарды пайдаланады. Коллодийден (нитроклетчатканың спирт пен эфирдегі ерітіндісі) мембрананы төмендегі жолмен даярлайды. Таза жуылған, құрғақ конус тәрізді колбаға толғанша коллодий ерітіндісін құйып қайтадан басқа ыдысқа кері ауыстырады да, колба түбінде қалған коллодийді колбаны айналдыра отырып, ыдыс қабырғасына біркелкі етіп жағады. Коллодий ерітіндісі колба қабырғасына бірыңғай жағылып қатайған соң, сумен бірнеше рет шайып тастайды. Эфир ұшып, ал спирт сумен жуылып кетеді. Колба қабырғасындағы коллодий пленкасын алу үшін пленканың бір шетін колба қабырғасынан ажыратып су құяды. Суды құя түсіп, пленканы жыртпай колба қабырғасынан босатып алады. Пленка қалың болу үшін колбаның ішкі қабатынан коллодий ерітіндісін екі рет жағады. Даяр болған коллодий пленкасын диаметрі 2-3 см, ал ұзындығы 5-10 см шыны түтіктің бір ұшына кигізіп штативке бекітеді.
Диализатор жұмысқа даяр. Ультрадиализдеуге және электродиализдеуге коллодий пленкасын фильтр қағазы бетіне қондырады. Ол үшін фильтр қағазын түбі тегіс және тесікті болып келетін фарфор воронкасына төсеп, ыстық сумен ылғалдайды. Онан соң су моншасында қыздырылған коллодий ерітіндісінен құйып фильтрдің бетіне біркелкі жаяды. Коллодийдің артық мөлшерін құйып алады. Тығыз пленка алу үшін 5-10 минуттан соң екінші рет коллодий ерітіндісін воронкаға құйып, тағы да біркелкі етіп жағады. Коллодийдің артық мөлшерін құйып алады. 15-20 минуттан соң кепкен коллодий пленкасын жағылған фильтр қағазын воронкадан алып сумен жуады. Даяр болған пленканы жұмысқа пайдалануға болады.
1-тәжірбие: Зольдерді диализдеу.
Жұмыстың барысы: Темір (ІІІ) гидросксиді золін диализдеу.
Коллодийден жасалған «қапшыққа» («дорбашық») ыстық темір (ІІІ) гидроксиді золін құяды. Золі бар коллодийден жасалған «қапшық» дистилденген суға батып тұруы керек. Біраз уақыттан соң судан бірнеше мл алып, оған AgNО 3 ерітіндісін қосып сапалық реакция жүргізеді. Сапалық анализді Сl - иондарының суда жоқ екенін көрсеткенше бірнеше рет қайталайды.
2 тәжірибе: Берлин лазуры золін диализдеу.
Коллодийден жасалған «қапшыққа» («дорбашық») берлин лазуры золін құяды да, стакандағы суға батырып бекітеді. Бірер уақыттан соң стакандағы судан бірнеше мл алып, оған ВаСl 2 ерітіндісін қосады. Не байқалады? Суға қандай иондар өтті? Стакандағы судың түсі өзгерді ме?
3 тәжірибе: Коллодийден жасалған «қапшыққа» («дорбашық») 2% таннин золін құйып, стакандағы 2% ҒеСl 3 ерітіндісіне батырады. 20-30 мин уақыт өткен соң қандай өзгерістер байқалады? Оны қалай түсіндіруге болады?
4 тәжірибе: Коллодийден жасалған «қапшыққа» («дорбашық») 0, 5% крахмал ерітіндісін құйып, стакандағы йод ерітіндісіне батырады. 20-30 мин уақыт өткен соң ерітінділерде қандай өзгерістер байқалады? Оларды қалай түсіндіруге болады?
5 тәжірибе: Ультрадиализаторда әуелі темір (ІІІ) гидроксиді золін диализдейді. Ерітіндіде (фильтрат) хлор-иондарының болатындығын сапалық реакция жүргізіп дәлелдейді. Онан соң фарфор воронкадағы коллодий пленкамен қапталған фильтр қағазын жай таза фильтр қағазымен алмастырып, Ғе(ОН) 3 золін құяды. Бірінші жағдай мен екінші жағдайдағы диализдеу жылдамдығы қандай? Оны қалай түсіндіруге болады? Коллоидты бөлшектер неліктен таза фильтр қағазынан оңай өтеді?
Бақылау сұрақтары
1. Коллоидты ерітінділерді қалай тазалайды?
2. Диализ, электродиализ және ультрадиализ дегеніміз не?
3. Коллоидтар мен электролиттердің жартылай өткізгіш арқылы диффузиялану жылдамдығы бірдей ме?
4. Коллоидтарды диализдеу арқылы электролиттерден толық тазартуға болады ма?
5. Коллоидты ерітінділерді диализдегенде қандай өзгерістер байқалады?
6. Диализдеу кезінде коллоидты ерітіндінің тазаланғанын диализдің аяқталғанын қалай біледі?
Зертханалық жұмыс №5.
Тұтқырлықты капиллярлық вискозиметр арқылы анықтау.
Жұмыстың мақсаты: тұтқырлықты анықтаудың капиллярлық әдісімен танысу; зольдердің салыстырмалы тұтқырлық коэффициентін анықтау; тұтқырлықты анықтаудың ақпа шарик әдісімен танысу; берілген зольдің салыстырмалы тұтқырлығын анықтау.
Қажетті реактивтер мен құрал-жабдықтар: вискозиметр, секундомер, диаметрі 3-5 см, ұзындығы 30-40 см шыны түтік, шарик: глицерин, 1, 0; 0, 5; 1, 5; 2, 0; 3, 5 және 3, 0% желатина золі, темір (ІІІ) гидроксиді золі, 1 М КІ және К 2 SО 4 .
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz