Нильс Бордың атомдық теориясы: постулаттар, сутегі атомының моделі және теорияның табыстары мен қайшылықтары


Мазмұны
Кіріспе
Атом туралы ілім ерте заманнан-ақ болатын. Гректің атақты философтары Левкипп (б. д. д. 500 жыл бұрын), Анаксагер (б. д. д. 500-428жж. ), Эмпедокл (б. д. д. 492-432 жж. ), Демокрит (б. д. д. 460-370 жж. ), Эпикур (б. д. д. 341-270 жж. ) дененің атомдық құрылысын дамытты.
Ерте ғасырда материя туралы екі түрлі ойлар пайда болды: біріншісі материяның бөлінбейтіндігі, ал екіншісі материяның бөлінетіндігі. Ғалымдар арасындағы бұл қарама-қайшы ойлар көптеген ғасырға созылды. Сонымен, көптеген жылдар өткеннен кейін ғылымдағы теріс ойлардан кейін, физиканың ғылымы қайта дами бастады. Физиканың көптеген қиындықтарды өткеріп, диалектиканың табиғи түсінігінің негізіне сүйене отырып, осы қиындықтарды жеңді. Сонда, материя үздіксіз «тұтас» және бөлінетін «атомдар» болып келеді.
Нильс Бор Копенгагенде физиология профессорларының жоғары білімді отбасында дүниеге келген. Копенгаген университетінде металдардың электронды теориясы бойынша докторлық диссертациясын қорғағаннан кейін Нильс Бор 1911 жылдың күзінде Кембриджге тағылымда өтуге кетіп, әйгілі Кавендиш зертханасында жұмыс істеуге кетті, онда Томсон мың сегіз жүз тоқсан жеті жылы электронды ашты. 1906 жылы Дж . Дж. Томсон «газдардың электр өткізгіштігін теориялық және эксперименттік зерттеулері үшін» Нобель сыйлығын алды. Бор зертханаға келген кезде Томсон атомның моделін және оны қолдануды жетілдірумен айналысты және Нильс Бордың жұмысына мүлдем қызығушылық танытпады. Бор көп ұзамай Эрнест Резерфордты көрді, ол Дж . Дж. Томсон және одан тағылымдамадан өтуін өтінді. 1912 жылдың көктемінде Бор Манчестерге көшті, онда Резерфорд Виктория университетінде кафедра мен зертхананы жүргізді. Осылайша тағдыр оларды біріктірді, ол Бор үшін Резерфорттың атом моделінің «құтқарушысының» тағдырын дайындады. Бордың атомдар құрылымының кванттық теориясының дамуындағы орталық тұлға және 1925-1927 жылдары құрылған кванттық механиканың «Копенгаген» түсіндірмесінің идеологы болды. Оның ядролық физика саласындағы еңбектері де белгілі.
1. 1 Нильс Бордың постулаттары
Атомның құрылысы жайындағы Резерфорд теориясының да елеулі кемшілігі болды. Егер атом құрылысын классикалық электродинамика тұрғысынан қарастырсақ, онда атомның ядролық моделі орнықты емес. Өйткені электрон ядроны айнала үдей қозғалғанда, электромагниттік теория бойынша жарық толқындарын шығарып, оның энергиясы кемуге тиісті. Онда ядромен электрон арасы жақындай түседі де айналу периоды үздіксіз кеміп, айналым (дөңгелектік) жиілігі арта түседі және шығарған жарықтың жиілігі де біртіндеп өзгеріп отыруға тиіс. Сонымен аз уақыт ішінде 10 -8 c электрон, ядро үстіне құлап түскен болар еді. Шынына келсе бұл қорытынды дұрыс емес болып танылады. Егер бұл модель дұрыс болса, онда сутегінің спектрі үздіксіз тұтас болар еді. Тәжірибеге қарағанда атом орнықты жүйе, сиретілген газ атомының спектрі дара сызықтардан тұрады. Классикалық механика тұрғысынан атомда мүмкін болатын шексіз көп электрон орбиталары ішінен белгілі кванттық шартттарды
- ді қанағаттандыратын тек кейбір дискретті орбиталар болады. Электрон осы стационарлық орбиталардың біреуінің бойымен үдей қозғалғанмен электромагниттік толқын жарық шығармайды. Олай болса атомның ішкі процесіне классикалық электродинамика заңдарын қолдануға болмайтындығы көрінеді.
Pезерфорд теориясынның осындай қиындықтан шығарған Даниялық атақты ғалым Нильс Бор болды. Ол Планктың кванттық теориясына сүйене отырып, өзінің атом құрылысы жөнінде жаңа теория ойлап шығарып мынадай екі постулат ұсынды:
- электрон ядроны айнала қозғалғанда, ол кез-келген орбитабойымен қозғалмай ақ, тек белгілі бір стационар орбита бойымен ғана қозғалады. Стационар орбита бойымен қозғалған электрон ешқандай жарық жұтпайды және шығармайды. Осындай орбиталарға сәйкес атомның стационар күйдегі энергиясының дискрет мәндері (Е1, Е2. . . ) болады. Стационар орбитадағы электронның импульс моменті мынадай формуламен өрнектеледі:
мұндағы, - жылдамдық, h - Планк тұрақтысы, - орбита радуссы, m - электрон массасы.
- Электрон бір стационар күйден екінші стационар күйге көшкендe ғана жарық шығарады әйтпесе жарық жұтады, сонда осы күйлердегі атом энергиясының айырмасы монохромат жарық кванты түрінде шығарылады немесе жұтылады.
Егер жоғарғы стационар күйдегі электрон энергиясы - Еn, төменгі күйдегі энергиясы -Еm, болса, онда электрон жоғарғы күйден төменгі күйге көшкенде бір квант жарық шығарады
ал төменгі күйден жоғарғы күйге көшу үшін жарық квантын жұтады.
1. 2 Бор постулаттарының тәжірибелік дәлелі
Атомдағы дискретті күйлердің болуын 1914 жылы Джеймс Фрэнк ( Дж. Франк, 1882-1964) және Густав Герц ( Г. Герц, 1887-1975) . Бастапқыда Франк пен Герц Бор теориясын әлі білмей, белгілі бір атомдардың, атап айтқанда, сынап атомдарының иондану потенциалдарын өлшеу міндетін қойды. Көптеген жылдар өткен соң, Фрэнк мойындады: «Сол кезде физиктер атомның моделін сол кездегі білім деңгейінде құру әрекеттеріне ашық сенімсіздік болғандықтан, атомға арналған жұмысты мұқият оқып шығуға аз адамдар қиналады. Әсіресе, Густав Герц екеуміз Бор жұмысының орасан зор маңызын түсіне алмағанымызды айта кеткен жөн». Франк және Герц тәжірибелерінің нәтижелерін талқылау (1-сур) олар іс жүзінде иондану потенциалын емес, сынап атомдарының қозу потенциалын өлшейтінін түсінуге әкелді.
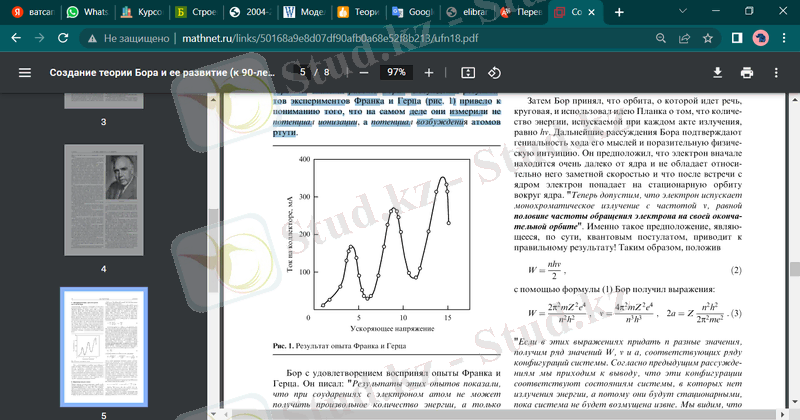
сурет. 1. Франк пен Герц тәжірибесінің нәтижесі
Бор Франк пен Герцтің тәжірибелерін қанағаттанушылықпен қабылдады. Ол былай деп жазды: «Бұл тәжірибелердің нәтижелері электронмен соқтығысқан кезде атомның еркін энергия мөлшерін ала алмайтынын, тек атомды қалыпты күйден келесі күйге көшіруге қажетті энергияға дәл сәйкес келетін энергия мөлшерін ғана ала алатынын көрсетті. басқа стационарлық күйлер; соңғысының бар екендігі туралы біз спектрлер туралы мәліметтерден білеміз, өйткені бұл күйлердің энергиясы спектрлік мүшелердің шамасымен тығыз байланысты.
1. 3 Нильс Бордың теориясы бойынша сутегі атомының құрылысы
Сутегі атомы жайындағы Нильс. Бор теориясы атомның ядролық моделіне негізделген. Нильс Бор теориясы бойынша сутегі атомы бір элементар оң зарядтан және оны айнала қозғалған бір электроннан тұрады. Сутегі атомының ядросының массасы электрон массасынан 1836 есе артық, яғни ядроны шексіз ауыр деп санауға болады.
Сонымен электрон ядроны айнала қозғалады, ал ядро айналмайды деп жорып, электрон қозғалысын қарастырайық.
Егер ядроның заряды
мұнда
Электрон ядроны айнала қозғалса, онда оған центрге тепкіш күш әсер етеді.
мұндағы
Динамиканың тепе -теңдік шарты бойынша, атом орнықты болуы үшін, осы екі күш бір-біріне тең болууы керек ;
немесе Бор постулатындағы (1) теңдік бойынша тұрақты мәнге теңестірсек
бұдан
(6)
Бұл формула n-орбитадағы электрондардың жылдамдығын көрсетеді.
Электронның импульс моментіне жылдамдықтың мәнін қойса, онда n-ші орбитаның радиусын табуға болады.
Соңғы (6) және (7) формулалардан электрон жылдамдығы орбитаның реттік нөміріне кері пропорционал, ал радиусы орбитаның реттік нөмірінің квадратына тура пропорционал екендігін байқаймыз.
Сутегі атомы үшін Z=1, n=1, онда
ал
мұндағы, -Бор орбитасының радиусы деп аталады. Соңғы (8) және (9) екі теңдікке сан мәндерін қойсақ, онда
Е=Е к +Е р (10)
(12)
(13)
Бұл энергияны r - радиусы арқылы жазсақ:
ал
онда,
(16) формула атом ядросы қозғалмайды деп қарастырғанға сәйкес келеді.
(13) формуланы сутегі үшін қолданып, (n=1; Z=1) сан мәндерін қойсақ, онда толық энергия
2-сурет
Олай болса, стационар орбитада электронның толық энергиясы, атомның энергетикалық деңгейі деп аталды (1-сур) .
Біз жоғарыда есепті жеңілдету үшін ядро қозғалмайды, оны айнала шеңбер бойымен электрон қозғалады деп есептедік. Шын мәнінде ядрода, электронда ортақ масса центрін айнала қозғалады. Нақтырақ айтсақ ядроның қозғалысы да есепке алынуы керек. Бұл орайда жоғарыда келтірілген формулалардағы электрон массасының орнына келтірілген масса деп аталатын
мұндағы М - ядроның массасы, ал m - электрон массасы. (13) теңдік бойынша стационар күйдегі электронн энергиясы сонда былай өрнектеледі:
Бұл (18) формула (13) мен (16) формулаларға қарағанда энергияны нақтырақ анықтайды.
Стационар күйдегі электрон энергиясы теріс шама, сондықтан да диаграммамен кескіндегенде электрон энергиясы төменнен жоғары қарай артады. Егер негізгі күйдегі сутегі атомына сырттан 13, 53 эв немесе бұдан артық энергия берілсе, онда электрон атомнан бөлініп кетеді, сутегі атомы иондалады. Онда, сутегі атомының иондалу энергиясы 13, 53 эв-қа тең, ал иондалу потенциалы 13, 53 эв болады. Егер негізгі күйдегі сутегі атомына 13, 53 эв тан кем энергия берілсе, онда электрон жоғарғы энергия деңгейлерінің біріне көшеді. Мысалы 10, 2 эв берілсе, ол бас кванттық саны n=2 деңгейіне көшеді, ал 10, 2 эв энергия, осы деңгейді қоздыру энергиясы болып табылады.
Егер сутегі атомының жоғарғы стационар күйдегі энергиясы Е 2 , төменгі стационар күйдегі энергиясы Е 1 болса, онда атом бастапқы күйден соңғы күйге көшкенде монохраматты жарық квантын шығарады, оның тербеліс жиілігі:
(18) формуладағы энергия мәндерін (19) формулаға салсақ, онда
ал толқындық сан
немесе
бұл формуладағы
; ;
онда
2. 1 Бор теориясының триумфы
Бор теориясын сол кездегі көрнекті физиктер - Эйнштейн, Лоренц, Планк, Резерфорд, Джинс, Зоммерфельдтер бірден жоғары бағалады, теорияны дамытуға белсене араласты. Өзінің бірінші үлкен (60 беттен астам) жоғарыда аталған мақаласында Бор атомдар мен молекулалардың құрылымына қатысты сол кездегі барлық эксперименттік фактілерді талдады, ал ол сипаттаудың математикалық дұрыстығына емес, бағалаулар мен бағалауларға аса мән бермеді. құбылыстарды сапалы түсіну. Бұл туралы көп жылдардан кейін Гейзенберг ( В. Гейзенберг, 1901-1976) өзінің «Кванттық теория және оның интерпретациясы» атты мақаласында былай деп жазды: «Математикалық айқындық өз алдына Бор үшін ешқандай ерекше құндылықты білдірмеді. Ол формальды математикалық құрылым жасырады деп қорықты. мәселенің физикалық мәнін түсінді және толық физикалық сипаттама сөзсіз математикалық тұжырымнан бұрын болуы керек екеніне сенімді болды.
Бор теориясының негізділігінің сенімді дәлелі оның 1896 жылы астроном Пикеринг (Э. Пикеринг, 1846-1919) Пуппис жұлдызының спектрінде ашқан спектрлік қатарды түсіндіруі болды . Бұл серия - Пикеринг сериясы - Балмер сериясын өте еске түсірді . Бұл жұлдыздарда ерекше күйде болатын сутегімен байланысты деп есептелді. Осындай қатарларды Фаулер бақылаған ( А. Фоулер ) 1912 жылы вакуумдық түтіктердегі сутегі мен гелий қоспасының спектрлерін зертханалық зерттеулерде. Сөйтіп, қарама-қайшы фактілер жиынтығы пайда болды. Бор бұл қайшылықтардың түйінін тарқатты. Бор теориясынан сутегі тектес атом үшін Ридберг тұрақтысы оның ядросының зарядына тәуелді екендігі шықты: , мұндағы сутегі атомы үшін Ридберг тұрақтысы . Бор Пикеринг қатары сутегіге мүлдем жатпайды, иондалған гелийге He+ жатады деп болжаған . Көп ұзамай Бордың болжамдарын Пасшен ( Ф. Пасен, 1865-1947) және Эванс ( Э. Дж. Эванс ) тәжірибе жүзінде растады .
Атом ядросының қозғалысын ескере отырып, сутегі тәрізді атом үшін Ридберг тұрақтысы ядроның массасына тәуелді болып шығады: мұндағы Z саны бар ядроның массасы . Бұл спектрлік сызықтардың изотоптық ығысуын түсіндіруге мүмкіндік берді. 1932 жылы осындай ауысым бойынша Үрей ( Х. Урей, 1893-1981) сутегінің ауыр изотопы дейтерийді ашты.
Өзінің теориясы негізінде Бор одан әрі орто- және парагелийдің спектрлері сол кездегідей екі түрлі элементке емес, бір элементтің, гелийдің сәл өзгеше күйлеріне жататынын көрсетті. 1915 жылы Бор алғаш рет салыстырмалылық теориясын ядроның айналасында айналатын электрондарға қолданды. Ол электронның релятивистік массасын ескере отырып, тек дөңгелек орбиталар қозғалмайтын болуы мүмкін, ал эллиптикалық орбиталар прецесс болуы керек деген қорытындыға келді .
Бор теориясының салтанатты маршы рентгендік спектрлерді зерттеумен де байланысты. 1914 жылы Коссель ( В. Коссей, 1888-1956) Бордың идеяларын пайдалана отырып, рентгендік спектрлер теориясын құрды. Бірінші дүниежүзілік соғыстың басында қайтыс болған Рутерфорд Мозелидің ( H. G. J. Moseley, 1887-1915 ) дарынды шәкірті эксперименталды түрде өлшенген жиілікті (немесе толқын ұзындығын) мүмкіндік беретін заңды ( Мозли заңы ) тапты. берілген элементтің атомдық нөмірін, демек оның ядросының зарядын дәл анықтау үшін тән рентген сәулесі. Мозли заңы элементтердің периодтық жүйесінде орналасқан кезде атомның негізгі сипаттамасы атом салмағы емес, ядро зарядын анықтайтын атом саны екенін бірінші болып көрсетті. Сонымен Мозли Ван Деннің гипотезасын сенімді түрде растады Брук ( А. _ Ван үйінді Брук, 1870-1926) элементтердің периодтық жүйеде орналасуында шешуші рөлді атомдық масса емес, атом санына тең ядро заряды атқаратынын айтты. Мозли былай деп жазды: «Бұл деректер атомның ішкі құрылымы туралы мәселеде маңызды критерий болып табылады және Резерфорд пен Бордың көзқарасын қатты қолдайды».
Бор теориясының көптеген фактілерді түсіндірудегі тамаша табысынан кейін ол өз заманының химиялық және спектроскопиялық мәліметтерін пайдалана отырып, элементтердің периодтық жүйесін осы теория тілінде түсіндіруге тырысты. Бор бұл туралы 1921 жылы Копенгагендегі физикалық қоғамда баяндама жасады. Ол Z электрондарын Ze заряды бар ядроға дәйекті түрде қосып, оларды әртүрлі орбиталарға орналастырды, «бұл жағдайда келесідей сұрақ қою керек: күш өрісінде жеке электрондарды дәйекті қосу және байланыстыру арқылы атомды қалай құруға болады? ядродан!» Паули принципін есепке алмай электронды қабықшаларды толтыру тәртібі, әрине, дұрыс емес. Соған қарамастан, кейінірек ашылған маңызды кванттық заңдылықтарды әлі білмей, Бор сенімді түрде « . . . элементтер жүйесіндегі қарапайым периодтылықтан тән ауытқуларға түсініктеме берді» және «сирек жер элементтерінің отбасының қалыптасуын қадағалады. « Ол 72-ші элемент өзінің қасиеттері бойынша сирек жер элементтерінің қатарына жатпайды деген қорытындыға келді, өйткені сол кезде Довиллер қателесті ( А. Dauwillier ), бірақ цирконийдің аналогы болып табылады. 1922 жылдың аяғында Костер ( Д. Костер ) және Хевеси ( Г. Хевеси ) шынында цирконий кендерінде элементтердің периодтық жүйесінде сериялық нөмірі 72 болатын жаңа элементті тапты . Бұл Бордың кванттық теориясының тағы бір тамаша жеңісі болды. Жаңа элемент Дания астанасының ежелгі атауының құрметіне гафний деп аталды.
Алып тастау принципін ашуда Бордың элементтердің периодтық жүйесіндегі атомдардың шағын топтарындағы электрондардың таралуы туралы зерттеулері маңызды рөл атқарды. Сол кезде Бор бұл принципті білмесе де, ол атомның барлық электрондары неліктен ең төмен энергиясы бар күйде шоғырланбайды деп өте орынды сұрақ қойды, яғни. X қабығында. Мұны кейіннен Паули ( В. Паули, 1900-1958) атап өтті: « . . . сол кездегі Бордың зерттеулерінің арқасында қол жеткізілген елеулі прогресс ( сфералық симметриялы атомдық модель негізінде) қалыптасуын түсіндіруден тұрды. атомның аралық қабықшалары және сирек жер элементтерінің жалпы қасиеттері Неліктен негізгі күйдегі атомның барлық электрондары ең ішкі қабықшада емес деген сұрақты Бор өзінің алғашқы жұмыстарында іргелі маңызды мәселе ретінде ерекшелеген . . . ол, атап айтқанда, гелий атомының ең ішкі К-қабықшасының толтырылуын және гелийдің жеке спектрлерінің, орто- және парагелий спектрлерінің маңызды байланысын қарастырды. Классикалық механика негізінде бұл туралы сенімді түсіндіру мүмкін болмады. Мен Бордың - сол кезде және одан кейінгі талқылауларда - кез келген электронды қабықшаны толтыру үшін шынайы болатын жалпы түсініктеме іздегеніне қатты әсер еттім . . . » .
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz